Какими свойствами обладают почвенные коллоиды

Высокодисперсная часть почвы состоит преимущественно из коллоидов. Почвенные коллоиды – совокупность почвенных частичек размером от 1 до 100 нм. Таким образом, коллоидные растворы занимают промежуточное положение между истинными, или молекулярными растворами (размер частичек 100 нм), с другой.

Почву относят к сложной полидисперсной системе – в ее состав входят частицы различного размера. Исключительно важную роль играет высокодисперсная часть почвы. Она представлена частицами, имеющими размер меньше 0,001 мм. Их содержание в почве может колебаться от 1–2% до 30–40% к массе почвы. Значение высокодисперсной части почвы состоит в том, что она во многом определяет физические и водно-физические свойства почвы, режим питания растений, поглотительную способность почвы.
Происхождение почвенных коллоидов может быть связано с лиспегацией (раздроблением) более крупных частичек, что происходит при выветривании пород. Другой путь образования коллоидов – в результате активизации поликонденсации и полимеризации низкомолекулярных органических соединений.
По составу бывают минеральные, органические и органоминеральные коллоиды.
Минеральные коллоиды представлены преимущественно глинистыми, а также некоторыми первичными минералами (например, кварц), измельченными до коллоидного состояния. Кроме того, минеральные коллоиды образуют гидрооксиды кремния SiO2 • пН2О; железа Fe(OH)3 • пН2О, алюминия А1(ОН)3 • п Н2О, марганца Мп2О3 • пН2О. На долю минералов коллоидов приходится около 80–90 % от массы всех коллоидов почвы.
Органические коллоиды образуются при гумификации органического вещества. Представлены в почве гумусовыми кислотами и их солями: гуматами, фульватами, алюмо-железогумусовыми соединениями.
При взаимодействии гумуса с высокодисперсными минералы частичками почвы образуются комплексные соединения сложного состава – органо-минеральные коллоиды.
Количество коллоидов в почве может сильно колебаться в зависимости от содержания в ней гумусовых веществ и частичек физической глины, с их увеличением возрастает количество коллоидов.
Коллоидная система почвы состоит из дисперсной фазы (масса коллоидных частичек) и дисперсионной среды (почвенного раствора), они взаимодействуют, в результате этого вокруг коллоидной частички создается двойной ионогенный слой. Коллоидную частичку с двойным ионогенным слоем называют мицеллой. Общая схема ее строения дана на рисунке 1.

Рис. 1. Схема строения коллоидной мицеллы (по Н.И. Горбунову)
Внутри мицеллы находится ядро – масса недисоциированных молекул коллоидообразующего вещества. К ядру примыкает потенциал-определяющий (внутренний) слой ионов определенного электрического заряда. Он неподвижный, прочно связан с ядром. Ядро вместе с потен-циалопределяюшим слоем образует гранулу. Вокруг нее формируется слой компенсирующих ионов, имеющих противоположный заряд по сравнению с ионами внутреннего слоя. Часть его ионов образует неподвижный слой компенсирующих ионов, другая часть отходит от внутреннего слоя на значительное расстояние, теряет с ним прочную связь и образует диффузный слой. Ионы диффузионного слоя способны к различным обменным реакциям с почвенным раствором. При потере диффузным слоем части ионов между зарядами слоя потенциалопределяющих ионов и слоем компенсирующих ионов возникает определенная разность потенциалов, называемая дзета-потенциалом. Величина его колеблется от 0 до 40–60 мВ.
Основная масса мицеллы принадлежит грануле, поэтому заряд последней рассматривается как заряд всего коллоида. Коллоиды, имеющие во внутреннем слое отрицательно заряженные ионы и диссоциирующие в раствор Н-ионы, называются ацидоидами. Они способны к поглощению и обмену катионов. Положительным зарядом характеризуются базоиды – их потенциалопределяющий слой состоит из катионов, а диффузный – из ОН-ионов (анионов). Базоиды способны поглощать и обменивать анионы.
Некоторые коллоиды (гидроксиды железа, алюминия) при изменении реакции среды меняют и знак заряда: в кислой среде они заряжены положительно, а в щелочной – отрицательно. Такие коллоиды называют амфолитоидами. Большинство почвенных коллоидов являются ацидоидами – это коллоиды гумусовых веществ, глинистых минералов и кремнекислоты. К базидам можно отнести гидрооксиды алюминия, железа.
Взаимодействию и соединению коллоидных частиц препятствуют водные пленки, образующиеся на их поверхности. По количеству воды, которую удерживают коллоиды, они подразделяются на гидрофильные и гидрофобные. Первые сильно гидротируются, набухают в воде. К ним относятся коллоиды гумуса, глинистых минералов. Гидрофобные коллоиды удерживают небольшое количество воды – это минералы каолинитовой группы и др.
Почвенные коллоиды могут находиться в двух состояниях: золя или коллоидного раствора, и геля или студенистого, комковатого или аморфного осадка. Под влиянием тех или других факторов коллоиды из состояния раствора могут переходить в осадок и наоборот. Процесс соединения отдельных коллоидных частичек и выпадения осадка называется коагуляцией. Осадок, образующийся при коагуляции, называется гелем. Переход геля в золь – пептизация.
При снижении дзета-потенциала и гидротированности частичек состояние золя делается неустойчивым, и как только коллоид теряет заряд или он уменьшается настолько, что силы притяжения превышают силы отталкивания, коллоидные частички начинают сцепляться, образовывать комочки и выпадать в осадок. Коагуляция коллоидов происходит главным образом при взаимодействии с электролитами (растворами солей, кислот, щелочей). При этом ацидоиды коагулируются под влиянием катионов электролита, базоиды – под влиянием анионов. Коагулирующая способность двух-трехвалентных катионов более сильная, чем одновалентных катионов, за исключением Н-.
Коагуляцию почвенных коллоидов могут вызывать и такие явления, как старение коллоидов, обезвоживание и замораживание почв. Скоагулированные коллоиды могут переходить от состояния геля в золь. Обычно это происходит с гидрофильными коллоидами, насыщенными одновалентными катионами – Н-, NH4+,Na+, и др. В этих условиях не может образоваться водопрочная структура почвы. Коллоиды передаются вниз по профилю, что может ухудшить физико-химические свойства почвы.
Переход геля в золь затруднен или вообще невозможен для гидрофобных коллоидов, насыщенных двух- и трехвалентными катионами – Са2+, Mg2+, A13+, Fe3+. В таких условиях пептизации коллоидов почти не наблюдается, образуются водопрочные структурные агрегаты, в почве закрепляются гумусовые вещества.
Почвенные коллоиды являются носителями сорбционных свойств почвы. Они способны поглощать и обменивать ионы диффузного слоя мицеллы на ионы почвенного раствора.
Адсорбционные свойства коллоидов обусловлены большой удельной поверхностью, благодаря которой коллоидные частички приобретают силы электростатического притяжения – вокруг их могут концентрироваться молекулы воды, газов и др.
Источник
Накопление в почве элементов питания растений связано с поглотительной способностью почв. Академик К. К. Гедройц предложил под поглотительной способностью почвы понимать способность ее поглощать жидкости, газы, солевые растворы и удерживать твердые частички, а также живыемикроорганизмы. Поглотительные процессы в почве обусловлены преимущественно тонкодисперсной частью почвы и особенно коллоидами. Содержание коллоидов в почве редко превышает 30 % почвенной массы, но влияние их на свойства почвы и уровень плодородия исключительно велико.
Почва состоит из частиц различного размера. Почвенными коллоидами называют частицы диаметром от 0,2 до 0,001 мкм. Они образуются при диспергировании (раздроблении) крупных частиц или при конденсации вследствие физического или химического соединения молекул.
По происхождению почвенные коллоиды бывают минеральные, органические и органо-минеральные.
Минеральные коллоиды образуются при выветривании горных пород. Это глинистые минералы, коллоидные формы кремнезема и полуторные оксиды.
К органическим коллоидам относятся гумусовые вещества почвы, сформированные в процессе гумификации растительных и животных остатков.
Органо-минеральные коллоиды образуются при взаимодействии минеральных и органических коллоидов.
В различных почвах содержание коллоидов составляет от 1…2 до 30…40 % массы почвы. Наибольшее количество коллоидов отмечено в глинистых и суглинистых почвах с высоким содержанием гумуса, наименьшее — в песчаных и супесчаных почвах, бедных гумусом.
Строение коллоидной частицы (мицеллы). На рисунке показано строение коллоидной мицеллы. Ядро мицеллы — это внутренняя ее часть, состоящая из недиссоциированных молекул. Оно может быть аморфным или кристаллическим. На поверхности ядра находится двойной электрический слой ионов, соприкасающийся с дисперсной средой (почвенным раствором): внутренний — потенциал определяющий слой неподвижных ионов, прочно связанных с ядром, и внешний — компенсирующий слой ионов, имеющий противоположный заряд.
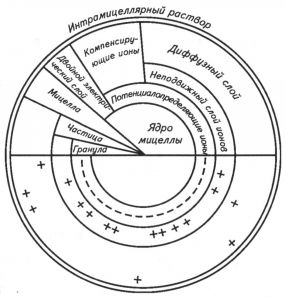
Рис. Схема строения коллоидной мицеллы (по Н. И. Горбунову)
Заряд коллоидной мицеллы определяют ионы, непосредственно связанные с поверхностью ядра. Этот заряд возникает в результате диссоциации молекул на поверхности ядра. Например, молекулы гидроксида алюминия Аl(ОН)з, составляющие ядро мицеллы, в кислой среде диссоциируют на ионы Al(OH)2+ и ОН-, а в щелочной — на АlO(OН)2- и Н+. Сложные ионы удерживаются на поверхности ядра и определяют знак заряда коллоидной мицеллы. Поэтому коллоидная частица гидроксида алюминия в кислой среде имеет положительный заряд, а в щелочной — отрицательный.
Коллоиды, имеющие кристаллическое строение, приобретают заряд иным путем. Известно, что ионы кристаллических частиц, находящиеся на поверхности, не насыщены связями и поэтому могут притягивать ионы из растворов. При этом притягиваются ионы противоположного заряда, вследствие чего образуется диффузный слой коллоидной мицеллы.
Ядро мицеллы и потенциалопределяющий слой ионов образуют гранулу. За потенциалопределяющим слоем гранулы расположены компенсирующие ионы. Прочносвязанные ионы этого слоя образуют неподвижный слой компенсирующих ионов. Затем следует внешний, или диффузный, слой ионов, способных обмениваться на ионы почвенного раствора. Таким образом, коллоидная мицелла состоит из ядра и двух противоположно заряженных слоев ионов.
Почвенные коллоиды по знаку заряда потенциал определяющего слоя подразделяются на отрицательные (ацидоиды) и положительные (базоиды). К отрицательным коллоидам относятся кремниевая кислота, глинистые минералы и гумусовые кислоты, к положительным — гидроксиды железа и алюминия.
Потенциал почвенных коллоидов зависит от их природы и реакции среды. Поскольку почвенные частицы имеют заряд, они способны притягивать дипольные молекулы воды из окружающего раствора, образуя гидратные пленки. Толщина этой пленки зависит от величины заряда. В связи с этим различают гидрофильные коллоиды (кремниевая кислота, гумусовые кислоты), удерживающие многослойные пленки воды, и гидрофобные, то есть слабогидратированные коллоиды (гидроксид железа, каолинит). Гидрофильные коллоиды имеют сродство с водой и способны сильно набухать, что предотвращает их слипание. Гидрофобные коллоиды набухают слабо, поэтому у них выражена способность свертываться и выпадать в осадок.
Коагуляция и пептизация коллоидов. Коллоиды могут находиться в двух состояниях: золя (коллоидного раствора) и геля (коллоидного осадка).
Коагуляцией называется процесс перехода коллоидов из состояния золя в состояние геля. Слипание коллоидов в агрегаты происходит под влиянием электролитов. Коагуляция ацидоидов вызвана катионами электролита, базоидов — анионами. Свертывание (слипание) коллоидов может происходить при взаимодействии противоположно заряженных коллоидных систем. При высушивании или замораживании почвы наблюдаются дегидратация (обезвоживание) гидрофильных коллоидов и повышение концентрации электролита почвенного раствора, что также вызывает коагуляцию коллоидов.
При коагуляции коллоидов происходит склеивание элементарных почвенных частиц в комочки, в результате чего улучшаются физические свойства почвы. Коагуляцию вызывают двухвалентные катионы, особенно Са2+. Кальций называют «стражем почвенного плодородия», так как он способствует образованию структуры и уменьшает кислотность почв.
Пептизация — это обратный процесс коагуляции, при котором коллоиды переходят из геля в золь. Пептизация происходит при воздействии растворов щелочных солей. Например, под влиянием одновалентного катиона натрия наблюдается усиленная гидратация коллоидов и переход их в состояние золя. При пептизации почвенных коллоидов разрушается ценная структура и ухудшаются свойства почвы. Так, столбчатый горизонт солонцовых почв, насыщенный гидратированными катионами натрия, во влажном состоянии набухает, а при высыхании растрескивается на крупные отдельности.
Роль коллоидов в почве исключительно велика: от содержания коллоидной фракции зависят связность, водопроницаемость, буферность и другие свойства почвы.
Источник:https://www.zoodrug.ru/topic3543.html
39. Почвенный поглощающий комплекс. Насыщенные и ненасыщенные основаниями почвы. Кислотность и буферность почв.
Материальным носителем обменной способности почв является почвенный поглощающий комплекс (ППК) — совокупность минеральных, органических и органо-минеральных соединений высокой степени дисперсности, нерастворимых в воде и способных к обменным реакциям. Поглотительной способностью обладала коллоидные частицы (0,001—0,200 мкм) и в меньшей степени предколлоидная фракция (0,2—1,0 мкм). Основным механизмом обменной поглотительной способности почв является процесс сорбции. Природа и состав ППК связаны с типом почвообразования. Общее количество поглощенных (обменных) катионов называется емкостью поглощения, или емкостью катионного обмена (ЕКО). Она зависит от содержания в почве илистой фракции, природы ППК и реакции среды. Емкость катионного обмена больше в почвах тяжелого гранулометрического состава, чем в легких. Органические коллоиды обладают более высокой ЕКО, чем минеральные. Минеральные коллоиды в почвах, содержащих монтмориллонит, характеризуются большим ЕКО, чем в почвах с преобладанием каолинита и гидрослюд. В обменной форме находятся многие макро — и микроэлементы минерального питания растений. Наиболее важны для диагностики процессов почвообразования и плодородия почв обменные катионы почвенного поглощающего комплекса: Са2+, Mg2+, Na+, Н+, Аl3+.
Кислотность почвы,одно из важнейших свойств многих почв, обусловленное наличием водородных ионов в почвенном растворе, а также обменных ионов водорода и алюминия в почвенном поглощающем комплексе. Повышенная К. п. отрицательно влияет на развитие растений и многих полезных микроорганизмов. Различают 2 формы К. п.: актуальную, или активную, — кислотность почвенного раствора, почвенной суспензии или водной вытяжки из почв, и потенциальную, или пассивную, “скрытую”, — кислотность твёрдой фазы почвы. Актуальная К. п. обусловлена наличием ионов водорода. Выражается условной величиной pH (отрицательный логарифм концентрации водородных ионов); при pH 7 реакция почвенного раствора нейтральная, ниже 7 — кислая; чем ниже числовое значение рН, тем выше К. п. Потенциальную К. п. делят на обменную и гидролитическую. Обменная К. п. вызывает значительное подкисление почвенного раствора при взаимодействии почвы с нейтральной солью, что наблюдается при внесении физиологически кислых удобрений (хлористый калий, сернокислый аммоний и др.). По представлениям русского учёного К. К. Гедройца и некоторых других исследователей, обменная К. п. обусловлена присутствием в твердой фазе почвы ионов водорода, не вытесняемых нейтральными солями из поглощаемого комплекса, но способных к замещению (обмену) на другие катионы при обработке почвы растворами щелочей или гидролитически щелочных солей (например, раствором ацетата натрия, который и применяется при определении гидролитической кислотности). Степень К. п. необходимо учитывать при выборе минеральных удобрений, подготовке их перед внесением в почву. Основной способ борьбы с повышенной К. п. — известкование почв
Буферность почвы
свойство почвы препятствовать изменению её реакции (pH) под действием кислот и щелочей. Чем больше в почвенном растворе солей сильных оснований и слабых кислот, тем более буферна почва по отношению к кислым удобрениям; соли слабых оснований и сильных кислот буферны к щелочным удобрениям. Так как раствор находится в постоянном взаимодействии с твёрдой фазой почвы, то последняя также оказывает существенное влияние на буферность. Чем больше коллоидных частиц и гумуса в почве (например, чернозёмы) и чем больше они содержат поглощённых оснований, тем буфернее почва по отношению к кислым удобрениям; поглощённый коллоидами водород (подзолистые почвы, краснозёмы) способствует увеличению Б. п. к щелочным удобрениям. Наиболее буферны почвы тяжёлого (глинистого) механического состава. Атмосферные осадки, грунтовая и оросительная вода могут изменить реакцию почвы, если последняя не обладает буферностью, и наоборот. Растения реагируют на изменение реакции почвы, поэтому Б. п. играет большую роль в их росте и развитии. Б. п. можно повысить внесением органических удобрений
40. систематика почв, ее цели и задачи. Таксономия почв. Номенклатура почв и диагностика почв.
Источник
Основоположником науки о коллоидах по праву считается К. К. Ге- дройц.
В состав почвенной массы входят частицы разного размера. Самые мелкие из них (от 0,2 до 0,001 мкм) относятся к коллоидам. Образуются они путем диспергации (раздробления) более крупных частиц или путем конденсации молекул в агрегаты молекул.
В почвах коллоиды образуют двухфазную систему, состоящую из дисперсной фазы (твердые коллоидные частицы) и дисперсионной среды {почвенный раствор). Высокодисперсные системы по величине частиц делятся на три группы:
- 1) предколлоидные системы (диаметр частиц 1 мкм… 100 нм);
- 2) коллоидные системы (диаметр частиц 100… 1 нм);
- 3) молекулярные растворы (диаметр частиц
Коллоиды в почвах представлены сложной системой минеральных,
органических и органоминеральных соединений. В большинстве почв преобладают минеральные коллоиды, на долю которых приходится 85…90% их общей массы (А.Ф. Тюлин).
К минеральным коллоидам относятся глинистые минералы (каолинит, монтмориллонит, галлуазит, гидрослюда, иллит, вермикулит и др.); гидроксиды железа (Fe(OH)3 • wH20), алюминия (А1(ОН)3 • «Н20), марганца (Мп203 • дН20), кремния (Si02 • дН20) и их комплексные соли — коагели. К органическим — аморфные гумусовые вещества, некоторые полисахариды и клетки наиболее мелких бактерий. Органоминеральные коллоиды представлены сложными образованиями гумусовых веществ с минеральными коллоидами.
Основное свойство коллоидов — способность к поглощению веществ из растворов как в виде молекул, так и в виде ионов. Поглощенные вещества могут обмениваться на другие, находящиеся в растворе, т.е. коллоиды обусловливают поглотительную и обменную способность почв. Это свойство определяется высокой реакционной способностью, обусловленной большой суммарной и удельной поверхностью (м2/г или м2/см3), которая тем больше, чем выше дисперсность коллоидов (табл. 5.1). Если в почве содержится 10% коллоидных частиц, то сумма их поверхности на площади 1 га составит 70 тыс. га.
С увеличением суммарной поверхности растет суммарная поверхностная энергия и возрастает химическая активность коллоидов. Удельная поверхность выше в суглинистых почвах, чем в песках и супесях, и выше в гумусовом горизонте, чем в нижележащих. Удельная поверхность коллоидов в гумусовых горизонтах суглинистых дерново-подзолистых почв составляет 29 м2/г, серых лесных — 33 м2/г и чернозёмов — 48 м2/г. Свободная поверхностная энергия коллоидов стремится к сокращению, что достигается или укрупнением частиц, или путем физической адсорбции на их поверхности молекул некоторых веществ.
Таблица 5.1
Роль частиц различного размера в формировании общей поверхности среднесуглинистой почвы (Н.И. Горбунов, 1974)
Размер частиц, мм | Содержание, % к массе | Поверхность, м2 на 1 г почвы | Доля общей поверхности, % |
0,25…0,05 | 17 | 0,5 | 0,2 |
0,05…0,01 | 50 | 4,1 | 1,7 |
0,01…0,005 | 20 | 9,9 | 4,1 |
0,005…0,001 | 6 | 12,7 | 5,2 |
0,001.-0,0001 | 3 | 18,8 | 7,8 |
0,0001 | 4 | 194,0 | 81,0 |
Итого | 100 | 240,0 | 100,0 |
Вторая характерная особенность коллоидов — наличие двойного электрического слоя ионов на границе дисперсной фазы и дисперсионной среды.
Коллоид имеет сложное строение. Внутренняя часть, состоящая из агрегатов аморфного или кристаллического вещества разного химического состава, называется ядром (рис. 5.1). На его поверхности расположен слой прочно удерживаемых потенциалопределяющих ионов, которые вместе с ядром образуют гранулу. Вокруг гранулы в два слоя располагаются ионы противоположного (компенсирующего) заряда. К грануле примыкает слой неподвижных противоионов, прочно удерживаемых электростатическими силами ионов потенциалопределяю- щего слоя, образуя вместе с гранулой частицу. Часть противоионов удалена от частицы, их связь с ней по мере удаления уменьшается. Это диффузный слой, ионы которого способны к эквивалентному обмену на ионы того же заряда из дисперсионной среды и вместе с частицей образуют коллоидную мицеллу. Свободный электрический заряд коллоидной частицы (дзета-потенциал) — разность потенциалов вследствие удаления частиц противоионов от границы компенсирующего слоя
Рис. 5.1. Схема строения коллоидной мицеллы (по Н.И. Горбунову)
к внешней границе диффузного слоя. Он колеблется от 0 до 40…60 мВ. Коллоидная мицелла электронейтральна при дзета-потенциале, равном нулю, что является изоэлектрической точкой коллоида.
Заряд коллоида появляется в связи с нарушением равновесия между зарядами, расположенными на поверхности раздела твердая частица — раствор, а также в связи с изменением химического состава и структуры коллоидного вещества.
В зависимости от заряда ионов потенциалопределяюшего слоя коллоиды делятся на ацидоиды — отрицательно заряженные, базоиды — положительно заряженные и амфолитоиды, имеющие в кислой среде положительный заряд, в щелочной — отрицательный. К ацидоидам относятся глинистые минералы, гидроксиды кремния и марганца, гумусовые кислоты и органоминеральные коллоиды. В качестве базои- дов в кислой среде выступают гидроксиды железа и алюминия, белки, тела мелких бактерий, которые в щелочной среде имеют свойства ацидоидов. В кислой среде, когда в растворе много ионов Н+ и мало ионов ОН-, молекулы гидроксидов алюминия и железа диссоциируют как основания, посылая в окружающий раствор ионы ОН-, и приобретают положительный заряд:
При щелочной реакции, наоборот, они ведут себя как кислоты, посылая в окружающий раствор ионы Н+, и приобретают отрицательный заряд:
Отрицательный заряд глинистых минералов возникает в результате изоморфных замещений части ионов кремния внутри кремнекислородных тетраэдров на трехвалентные ионы алюминия. В алюмогидрок- сильных октаэдрах часть трехвалентных ионов алюминия может быть замещена на двухвалентные ионы магния. Отрицательный заряд может вызывать и наличие свободных ионов кислорода на краях слоя кремнекислородного тетраэдра, которые соединяются с одним ионом кремния, а вторая валентность при этом остается свободной для связи с ионом водорода или основанием. Возникающий отрицательный заряд компенсируется соответствующим количеством катионов К+, Na+, Са2+, которые могут обмениваться на катионы почвенного раствора. При этом катионы, компенсирующие отрицательный заряд, могут попадать как на поверхность, так и в межпакетные пространства кристаллической решетки глинистых минералов, увеличивая тем самым поглотительную способность глинистого минерала. Последняя выше у монтмориллонита по сравнению с каолинитом, который, кстати, может приобретать положительный заряд в кислой среде.
Коллоиды в почве могут находиться в состоянии геля (коллоидный осадок) или золя (коллоидный раствор). Золь может переходить в гель, и наоборот. Первый процесс называется коагуляцией, второй — пепти- зацией. Переход коллоидов из одного состояния в другое обусловлен изменением электрического потенциала коллоидных частиц и зависит от степени их гидратации. Однако заряженные частицы, отталкиваясь друг от друга, могут долго находиться в растворе, не образуя осадка и не укрупняясь. Коагуляция вызывается действием электролитов, несущих противоположный заряд. При этом коллоиды теряют заряд и слипаются в агрегаты: ацидоиды — под действием катионов, базоиды — под действием анионов. Схематически механизм коагуляции проявляется как нейтрализация заряда коллоидных частиц и снижение их гидратации, в результате чего они могут соединяться (склеиваться) друг с другом. Коагулирующая способность электролитов зависит от массы и валентности иона: чем выше валентность и чем больше масса в пределах одной валентности, тем выше его коагулирующее действие. По К. К. Гедройцу, коагулирующая способность катионов располагается в следующий ряд:
а анионов в ряд
Исключение составляет Н+, который стоит между двухвалентными Mg и Са, обладая наименьшей атомной массой (1). Это объясняется тем, что коагулирующая способность ионов зависит от степени гидратации или сольватации ионов. Каждый ион окружен диполями воды (Н+ОН~), и чем больше водная пленка, тем меньше его коагулирующая способность, так как сильногидратированный ион не может достаточно близко подойти к частице.
Если степень гидратации иона Са принять за 100, то по относительной степени гидратации ионы других элементов расположатся в следующий ряд: Mg — 101, К — 178, N — 452, Li — 552. Ион водорода характеризуется малой степенью гидратации, присоединяет только одну молекулу воды, образуя гидроксоний (Н30), чем и объясняются его хорошие коагулирующие свойства и энергичное поглощение. Постоянного места в ряду поглощения Н+ не имеет, так как его поглощение зависит от состава твердой фазы почвы.
При насыщении одновалентными катионами коллоиды находятся преимущественно в состоянии золя, а чем выше заряд и ниже степень гидратации, тем сильнее поглощение иона и его коагулирующее действие. Коагуляция может происходить также при встрече разнозаряженных коллоидных частиц, которые, соединяясь друг с другом, образуют коагель.
При прочих равных условиях пептизация происходит при уменьшении концентрации солей в растворе. Коллоиды, легко переходящие из геля в золь, называются обратимыми. Обратимыми являются гидрофильные коллоиды, насыщенные высокогидратированными одновалентными катионами, необратимыми — гидрофобные коллоиды, насыщенные двух- и особенно трехвалентными катионами с низкой степенью гидратации (низкой обводненностью).
Особым видом коагуляции является тиксотропия: когда масса геля неотделима от золя, образуется студень, который можно превратить в состояние золя при механическом воздействии. Тиксотропия распространена в почвах, образующихся под воздействием вечной мерзлоты.
От состава и свойств коллоидов зависит поглотительная способность почвы, ее биологическая активность и агрофизические свойства, аккумуляция гумуса и питательных элементов.
Одним из основополагающих путей оптимизации свойств почвы под влиянием антропогенной нагрузки является всесторонняя оценка органоминеральных коллоидов.
Комплекс органоминеральных коллоидов обозначил К. К. Гедройц. А.Н. Соколовский установил, что они сосредоточены в илистой фракции (
Частицы 1-й группы формируются в межкорневых пространствах и покрыты пленками-гелями, образованными при коагуляции катионами Са+2 и Mg2-. При взаимодействии с Na+ они могут перейти в золи, т.е. частицы 1-й группы обратимы.
Частицы 2-й группы формируются вблизи корней, содержат пленки-гели, образованные при взаимной коагуляции базоидов железа и алюминия и ацидоидов гумусовых кислот. Частицы этой группы необратимы. А.Ф. Тюлин указывал на то, что групповой состав органоминеральных коллоидов можно взять за комплексный критерий для оценки плодородия и почвенной структуры, так как в них аккумулируются гумус и питательные элементы. По данным БГСХА (А.И. Горбы- лёва, В.Б. Воробьев, Е.Ф. Валейша), преобладающее значение в аккумуляции гумуса и питательных элементов дерново-подзолистой легкосуглинистой почвы имеют частицы 2-й группы, на которые приходится 74, 67 и 70% валового азота и подвижных соединений фосфора и калия, а на долю частиц 1-й группы 26, 33 и 30% соответственно. Содержание гумуса в частицах 1-й группы в 2,3—2,7 раза, 2-й группы — в 3,7—4,2 раза выше, чем в почве, причем гумус в частицах 1-й группы в 1,5 раза подвижнее, чем гумус частиц 2-й группы. При длительных опытах установлено, что на фоне органоминеральных систем удобрения формируется более широкое отношение между частицами 2-й и 1-й групп (1,18…3,34), чем на фоне минеральной системы (0,63…1,74) и в вариантах без удобрений (0,52… 1,17).
Наиболее заметный эффект в этом же опыте на количество и качество коллоидов оказала отвальная поярусная обработка и безотвальная глубокая по сравнению с традиционной отвальной.
Учитывая многостороннее влияние органоминеральных коллоидов на почву, подтверждается мнение А.Ф. Тюлина о том, что их групповой состав может служить приоритетным диагностическим признаком почвенного плодородия.
Источник
