Какими свойствами обладают щелочные металлы
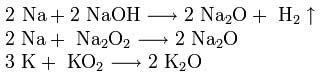
Щелочными металлами называются химические элементы-металлы (IA) группы Периодической системы Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы (IA) характерна степень окисления (+1).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия (NaCl)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 (·) 10H2O,
- сильвин — хлорид калия (KCl),
- сильвинит — двойной хлорид калия-натрия (KCL) (·)(NaCl) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами (IA) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод ((–)): 2Na++2e=2Na,
анод ((+)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
Источник
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за
их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционной способности. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li – 2s1
- Na – 3s1
- K – 4s1
- Rb – 5s1
- Cs – 6s1
- Fr – 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl – галит (каменная соль)
- KCl – сильвит
- NaCl*KCl – сильвинит

Получение
Получить такие активные металлы электролизом водного раствора – невозможно. Для их получения применяют электролиз расплавов при
высоких температурах (естественно – безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Реакции с неметаллами
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид,
натрий – пероксид, калий, рубидий и цезий – супероксиды.
Li + O2 → Li2O (оксид лития)
Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления
+1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда – взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH – натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: “… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет”.
Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий – в желтый, калий – в фиолетовый, рубидий – синевато-красный,
цезий – синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
Li + O2 → Li2O (оксид лития)
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из
пероксида, так и из супероксида, при желании можно получить оксид:
Na2O2 + Na → Na2O
KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание – реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание – мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам – растворимым основаниям. Наиболее известные представители: NaOH – едкий натр, KOH – едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции
щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде – хлор)
Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
K + H2O → KOH + H2↑
Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется
газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке – получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке – получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 – получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 – получается средняя соль)
NaOH + MgBr2 → NaBr + Mg(OH)2↓
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием оксиелов –
смешанных оксидов (при высоких температурах – прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется оксиел – смесь двух оксидов: Al2O3
и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
Подобная схема универсальная для брома и для йода. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO + NaI + H2O (без нагревания)
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам – и азотной,
и азотистой.
LiOH + NO2 → LiNO2 + LiNO3 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Щелочные металлы — группа неорганических веществ, простых элементов  таблицы Менделеева. Все они обладают похожим атомным строением и соответственно, похожими свойствами. В группу входят калий, натрий, литий, цезий, рубидий, франций и теоретически описанный, но еще не синтезированный элемент унуне́нний. Первые пять веществ существуют в природе, франций — искусственно созданный, радиоактивный элемент. Свое название щелочные металлы получили из-за способности образовывать щелочи в реакции с водой.
таблицы Менделеева. Все они обладают похожим атомным строением и соответственно, похожими свойствами. В группу входят калий, натрий, литий, цезий, рубидий, франций и теоретически описанный, но еще не синтезированный элемент унуне́нний. Первые пять веществ существуют в природе, франций — искусственно созданный, радиоактивный элемент. Свое название щелочные металлы получили из-за способности образовывать щелочи в реакции с водой.
Вся элементы группы химически активны, поэтому на Земле встречаются только в составе различных минералов, например, каменной, калийной, поваренной соли, буры, полевого шпата, морской воды, подземных рассолов, чилийской селитры. Франций часто сопутствует урановым рудам; рубидий и цезий — минералам с натрием и калием.
Свойства
Все представители группы — мягкие металлы, их можно резать ножом, сгибать руками. Внешне — блестящие, белого цвета (кроме цезия). Цезий отливает золотистым блеском. Легкие: натрий и калий легче воды, литий всплывает даже в керосине. Классические металлы с хорошей электро- и теплопроводностью. Горят, придают пламени характерный цвет, являющийся одним из аналитических способов определить тип металла. Легкоплавкие, самым «тугоплавким» является литий (+180,5 °С). Цезий тает прямо в руках при температуре +28,4 °С.
 Активность в группе увеличивается по мере роста атомной массы: Li →Cs. Обладают восстановительными свойствами, в том числе в реакции с водородом. Проявляют валентность -1. Бурно реагируют с водой (все кроме лития — со взрывом); с кислотами, кислородом. Взаимодействуют с неметаллами, спиртами, водным аммиаком и его производными, карбоновыми кислотами, многими металлами.
Активность в группе увеличивается по мере роста атомной массы: Li →Cs. Обладают восстановительными свойствами, в том числе в реакции с водородом. Проявляют валентность -1. Бурно реагируют с водой (все кроме лития — со взрывом); с кислотами, кислородом. Взаимодействуют с неметаллами, спиртами, водным аммиаком и его производными, карбоновыми кислотами, многими металлами.
Калий и натрий являются биогенными элементами, участвуют в водно-солевом и кислотно-щелочном балансе человеческого организма, необходимы для нормальной циркуляции крови и функционирования многих энзимов. Калий важен для растений.
В нашем организме есть и рубидий. Его нашли в крови, костях, головном мозге, легких. Он оказывает противовоспалительное, противоаллергическое действие, притормаживает реакции нервной системы, усиливает иммунитет, положительно влияет на состав крови.
Меры предосторожности
Щелочные металлы очень опасны, способны воспламеняться и взрываться просто от контакта с водой или воздухом. Многие реакции протекают бурно, поэтому работать с ними допускается только после тщательного инструктажа, с применением всех мер предосторожностей, в защитной маске и защитных очках.
Растворы калия, натрия и лития в воде являются сильными щелочами (гидроксиды калия, натрия, лития); контакт с кожей приводит к глубоким болезненным ожогам. Попадание щелочей, даже низкой концентрации, в глаза может привести к слепоте. Реакции с кислотами, аммиаком, спиртами проходят с выделением пожаро- и взрывоопасного водорода.
Щелочные металлы хранят под слоем керосина или вазелина в герметичных емкостях. Манипуляции с чистыми реактивами проводят в аргоновой атмосфере.
Следует тщательно следить за утилизацией остатков после опытов со щелочными металлами. Все остатки металлов предварительно должны быть нейтрализованы.
Применение
- Цезий и рубидий используются в фотоэлементах, топливных элементах.

- Цезий применяется в источниках тока, энергоемких аккумуляторах, счетчиках радиоактивных частиц, гамма-спектрометрах для космических аппаратов; приборах ночного видения и оружейных прицелах. Изотопы цезия используются для стерилизации пищевой тары, медицинских инструментов, мясных продуктов, лекарств; они входят в состав некоторых лекарств, применяются для радиотерапии опухолей.
- Рубидий входит в состав болеутоляющих, снотворных, успокаивающих препаратов. Применяется в телевизионных трубках, оптических приборах, низкотемпературных источниках тока, в смазке для космических аппаратов, высокочувствительных магнитометрах для космических и геофизических исследований. Производные рубидия используются в атомной промышленности, химпроме, вакуумных радиолампах, высокотемпературных термометрах.
- Калий и натрий применяются в воздухо-восстановительных системах на подводных лодках и батискафах, в автономных противогазах и дыхательных аппаратах.
- Литий востребован в источниках тока, для производства подшипниковых сплавов и литийорганических соединений, как катализатор в химпроме.
- Натрий применяется в газоразрядных лампах, в металлургии; как теплоноситель в атомной индустрии; в химической индустрии в процессах орг.синтеза.
- В разных сферах промышленности и быта используется большое количество производных щелочных металлов, например, пищевая и кальцинированная сода, поваренная соль, натриевая и калийная селитра, нитраты, сульфаты, карбонаты, гидроксиды натрия, калия и лития и пр.
Источник
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns1. В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
2LiCl = 2Li + Cl2↑
2NaCl = 2Na + Cl2↑
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900![]() С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
2MeCl + Ca = 2Mе↑ + CaCl2,
где Ме – металл.
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
2Me + H2O = 2MeOH + H2↑
где Ме – металл.
Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
4Li + O2 = 2Li2O
2Na + O2 =Na2O2
K + O2 = KO2
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
2Na + Cl2 =2NaCl
6Li + N2 = 2Li3N
2Li +2C = Li2C2
2K + S = K2S
2Na + H2 = 2NaH
Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
2Li + 2NH3 = 2LiNH2 + H2↑
Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
3Na + AlCl3 = 3NaCl + Al
Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
2Na + 2C2H5OH = 2C2H5ONa + H2↑
2K + 2C6H5OH = 2C6H5OK + H2↑
2Na + 2CH3COOH = 2CH3COONa + H2↑
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li+ окрашивает пламя в красный цвет, Na+ — в
желтый, а K+, Rb+, Cs+ — в фиолетовый.
Примеры решения задач
Источник
Щелочные металлы.
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Далее таблица свойств щелочных металлов:
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода: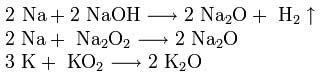
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):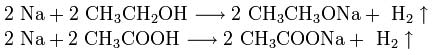
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li+ + e → Li
анод: 2Cl- — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:

катод: Na+ + e → Na
анод: 4OH- — 4e → 2H2O + O2
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Источник
