Какими свойствами обладают вещества между молекулами которых образуется водородная связь

Как известно, атомы, имеющие большую электроотрицательность, имеют тенденцию притягивать к себе электроны менее электроотрицательного партнера, давая ему низкий положительный заряд (σ+). В случае с водородом этот заряд позволяет ему взаимодействовать с другим атомом. У второго атома должны присутствовать неподеленные электронные пары, которые позволят ему взаимодействовать с водородом. Механизм образования связи схож с ковалентной и может быть рассмотрен в качестве ее варианта.
Водородная связь
Это связь, образующаяся между атомом водорода, который уже связан с атомом, имеющим высокую электроотрицательность, и другим электроотрицательным атомом.
Можно представить структуру обсуждаемого явления так: сравнительно большие электроотрицательные атомы — это двое взрослых, которые держат за руки малыша-водорода. Наиболее распространенные кандидаты на роль «родителей» — это фтор, кислород и азот.
Свойства и типы водородных связей
Ковалентная и водородная связь сильно различаются по силе. Водородная значительно слабее, однако ее энергия и стабильность выше, чем у слабых межмолекулярных взаимодействий, таких как силы Ван-дер-Ваальса. Образование и разрушение водородной связи не требуют значительных затрат энергии, и она является достаточно стабильной при нормальных условиях. Подобная гибкость, обуславливает ее широкое распространение в молекулах, используемых живыми организмами, – «сборка» и «разборка» таких молекул легко осуществляется силами естественных энзимов. Можно выделить два подтипа обсуждаемой связи:
- внутримолекулярная – образуется между атомами одной молекулы;
- межмолекулярная – между атомами двух молекул.
Чтобы лучше понять, что к чему, давайте рассмотрим каждую из них.
Водородная связь: примеры
Две цепи ДНК, соединенные между собой при помощи большого количества водородных связей, — один из самых очевидных примеров внутримолекулярной водородной связи в биомолекулах. В процессе копирования, записи и восстановления генетической информации связи между цепями разрываются и соединяются множество раз на ограниченном участке молекулы.
Примерами веществ, между которыми образуются водородные связи могут служить спирты. Водородные связи, образующиеся между отдельными молекулами спиртов, обеспечивают им высокие точки кипения и плавления. Молекулы спиртов «держатся» друг за друга при помощи водородных связей, образуя более устойчивую структуру. Больше водородных связей – больше энергии необходимо для доведения вещества до кипения.
Обсуждаемые связи могут образовываться и между неорганическими молекулами, например, между молекулами воды. Рассмотрим этот случай подробнее.
Водородные связи в воде
Для начала давайте вспомним, как выглядит молекула воды. Она представляет собой атом кислорода, связанный с двумя атомами водорода и имеющий две неподеленные электронные пары – H2O. Каждый из атомов водорода может образовать связь с еще одной молекулой, из-за чего вода приобретает некоторые интересные свойства.
В числе прочего такая организация, позволяет воде иметь более высокую температуру кипения. Механизм достижения подобной стабильности по сути такой же, как и в спиртах. При температурах, превышающих ноль по шкале Цельсия, но ниже температуры кипения, молекулы воды образуют структуры, подобные изображенной на рисунке выше, но они представляют собой отдельные конгломерации, а не целостную структуру. При низкой температуре вода образует лед, в котором водородные связи присутствуют в полном объеме, образуя решетку. Ячейки решетки крупнее, чем молекула воды, что обеспечивает еще одно интересное свойство – более низкую плотность в твердом агрегатном состоянии.
Вода является отличным растворителем.
Полярные молекулы воды легко реорганизуются вокруг положительно или отрицательно заряженных ионов, поворачиваясь к ним соответствующей стороной. Особенно хорошо в воде растворяются другие водородосодержащие соединения, способные к образованию водородных связей с молекулами воды и самими собой. Поэтому спирты, а также аммиак и некоторые другие соединения способны растворяться в воде в колоссальных объемах.
Источник
Гидрогенная связь — образовывается между «+» заряженными атомами водорода и «-» заряженными атомами других молекул.
Очень часто эта взаимосвязь возникает и существует из-за взаимодействия атома водорода с такими атомами: оксиген (О), нитроген (N). Это происходит вследствие того, что данные элементы имеют небольшой удельный вес и характеризуются высокой электроотрицательностью. Элементы, которые имеют больший удельный вес — сера S или хлор Cl—связываются с водородом менее прочно, хотя их электроотрицательность сравнима с нитрогеном.
…
Типы гидрогенной связи
- Межмолекулярная водородная — возникает между двумя элементами, пример: метиловый спирт.
- Водородная (гидрогенная) внутримолекулярная — образуется внутри элемента, пример: 2-нитрофенол.
Это интересно: механизм образования металлической химической связи, примеры.
Межмолекулярная гидрогенная связь
Совместная электронная пара смещается от атома водорода к отрицательно заряженному атому. При этом водород входит в комплекс с неразделенной электронной парой другого атома или иона.
Н-связь графически изображают в виде точек, тем самым показывая, что она слабее ковалентной (примерно в 10−15 раз).
Молекулы воды (две) и молекулы уксусной кислоты (две)
Внутримолекулярная гидрогенная взаимосвязь. Ей свойственно находиться в таких структурах, как многоатомные спирты, углеводы, белки.
Это интересно: типы кристаллических решеток — таблица различных материалов.
Молекула салициловой кислоты
Химические взаимодействия делятся на слабые и сильные. Их отличие состоит в том, что при разрыве они выделяют разную энергию и у них различные по длине (расстояние между атомами):
1. Слабые. Содержание энергии — 15−25 кдж/моль, длина равна 30.
2. Сильные. Энергия — 300 кдж/моль, длина 22−23.
Для образования Н-св. характерно два типа отдачи ионов — электростатический и донорно — акцепторный. Интересно то, что донором выступает более сильный элемент (F, O, N), а акцептором — атом водорода.
Это интересно: как определить валентность по таблице Менделеева?
Механизм образования водородной связи
Хорошо разбирать механизм образования водородной связи на примере её между молекулами воды. Н-св. на рисунках обозначается 3 точками. Атом гидрогена имеет всего лишь один электрон, который при взаимодействии с атомом большей электроотрицательности может условно оголять ядро, что, в свою очередь, образует дополнительную взаимосвязь с другим атомом. Это и есть водородная связь.
Вода — это вещество, между молекулами которого образуются водородные связи.
Кластеры из нескольких молекул воды
Благодаря водородным взаимосвязям молекулы воды взаимодействуют друг с другом, что приводит к образованию кластеров или комплексов воды. Одним из ярких примеров является димер воды.
Н-св. считаются довольно слабыми и неустойчивыми: считается, что они легко возникают, но и также легко разрушаются. Для водородных связей характерен симптом тепловой флюктуации. Вода представляет собой сеть из молекул, связанных водородными связями.
Аномальные свойства, обеспеченные водородной взаимосвязью
Молекула воды состоит из трёх молекул и содержит 4 Н-св. Здесь присутствуют 2 атома водорода , а кислород, имея две неподеленные электронные пары, связывается с атомами Н ближайших молекул Н2О.
Н-св. обеспечивают высокие температуры кипения и плавления. Без них эти показатели были бы намного меньше.
Н-св. в молекулах воды обладают достаточной силой и препятствуют её плавлению и испарению.
А также они обеспечивают ещё одно свойство Н2О, которое характеризуется тем, что при плавлении воды её плотность повышается.
Наибольшее значение имеет плотность воды (1,00 г/мл) при температуре 4 градуса Цельсия. Эта температура характерна для зимнего времени и находится на дне пресных водоёмов, там же и находится вода с максимальной плотностью.
Как изменяются свойства веществ в зависимости от водородной связи
Наиболее достоверным признаком наличия в веществе межмолекулярной Н-св. является показатель кипения вещества. Одна из высоких температур кипения у воды (100 oC так как для того чтобы разрушить межмолекулярные связи в H2O нужно затратить больше энергии). Н-св. сильно может влиять на физические и химические свойства вещества. Межмолекулярная связь обеспечивает повышение температуры плавления и кипения различных веществ. Вещества, которые содержат ОН-группы —моносахариды, дисахариды, как правило, обладают отличной гидрофильностью.
Источник
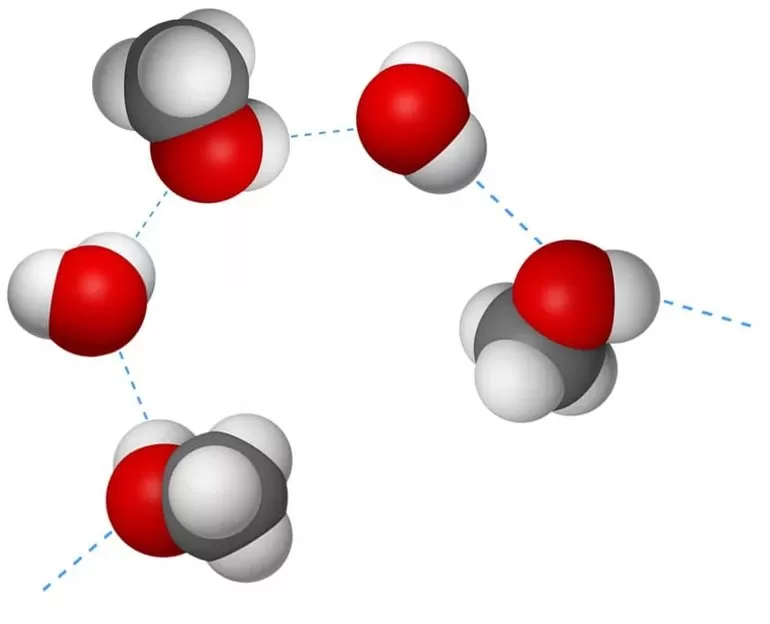
Характерные особенности
Этот тип связи возникает в молекулах, когда их атом водорода, поляризованный положительно, взаимодействует с атомом другой молекулы, имеющим заряд отрицательный. Расстояние между атомами-участниками процесса должно оказаться меньше, чем сумма их радиусов. Выделяют два вида H-связей:
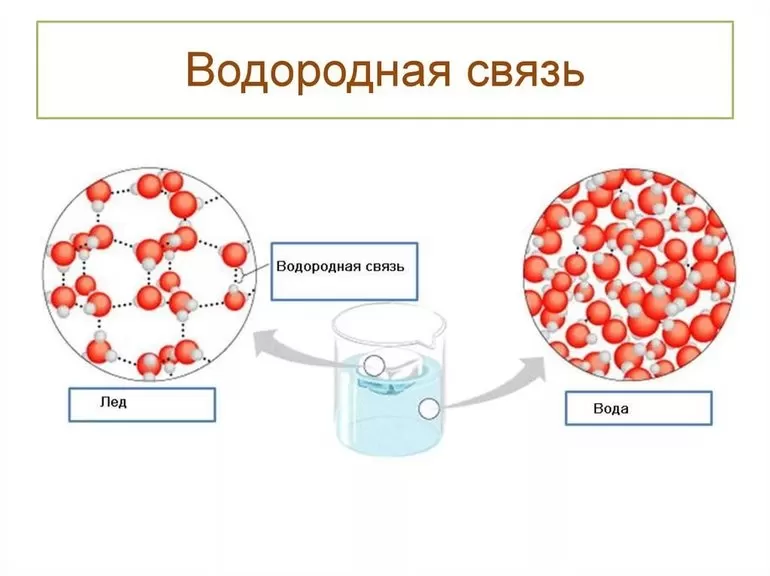
- Межмолекулярная. Возникает между различными молекулами веществ: для этого необходимо присутствие водорода и одного из элементов с хорошей способностью притягивать электроны других атомов. Высокая электроотрицательность фтора (F), кислорода (O), азота (N), хлора (Cl) и серы (S) служит этому надёжной поддержкой. Общие пары взаимодействующих электронов смещаются к атомам отрицательно заряженных элементов, а положительные электрические заряды водорода концентрируются в малых объёмах. Протоны взаимодействуют с электронными парами соседних атомов, что приводит к их обобществлению.
- Внутримолекулярная. Образуется в пределах одной молекулы, для чего в ней наряду с положительно заряженными атомами водорода должны присутствовать отрицательно поляризованные группы. Явление обнаруживается в природе у многоатомных спиртов, белков, углеводов и ряда других органических соединений.
Энергия H-связи обладает низкими прочностными характеристиками: она в несколько раз ниже, чем у остальных подобных взаимодействий. Это позволяет ей существовать промежуточным звеном между основными химическими связями (ковалентной, ионной и металлической) и силами притяжения и отталкивания Ван-дер-Ваальса, стремящимися удержать частицы в твёрдом или жидком состоянии. Кристаллические решётки с молекулами в узлах — характерная особенность веществ с водородной связью. Примеры можно привести различные:

- вода H2O в виде льда;
- кристаллы йода I;
- хлор Cl;
- бром Br;
- диоксид углерода CO2 в форме «сухого льда»;
- твёрдый аммиак NH3;
- конденсированная органика (метан CH4, бензол C6H6, фенол C6H5OH, нафталин C10H8, различные белки).
Механизм образования водородной связи считается смешанным — одновременно электростатическим и донорно-акцепторным. Решающая роль в этом принадлежит повышению электроотрицательности одного атома (A), позволяющей оттягивать в свою сторону электронную пару другого атома (H), принимающего участие в этом взаимодействии. В результате:
- первый атом приобретает частично отрицательный заряд (d-);
- второй участник заряжается положительно (d+);
- происходит поляризация химической связи (Аd-) — (Hd+).
Образовавшиеся атомы водорода, заряд которых частично положителен, обладают способностями притягивать другие молекулы, содержащие электроотрицательные группы. Эти электростатические взаимодействия и обуславливают появление Н-связей, для формирования которых необходимы три обязательных элемента:
- атом-донор протона;
- атом-акцептор протона;
- атом водорода Н.
Такое донорство в обычных условиях никогда не осуществляется на все 100%. Атом-донор остается химически связанным с водородом. Графически это обозначается в виде линии из точек, указывающей, что сила взаимодействия слабее ковалентной связи. Схема записи структуры выглядит следующим образом: Б ··· Нd+ – Аd-.
Только три химических элемента полностью проявляют донорские способности, и их атомы поставляют протоны для образования Н-связей: азот (N), кислород (O) и фтор (F). В атомах-акцепторах недостатка не наблюдается. Низкомолекулярным соединениям H-связь придаёт способность в обычных условиях иметь жидкое агрегатное состояние, как это происходит у этанола (C2H5OH), метанола (CH3OH) и воды (H2O), или становиться сжижающимися при охлаждении газами — аммиаком (NH3) и гидрофторидом (HF).
Проявление в неорганической химии
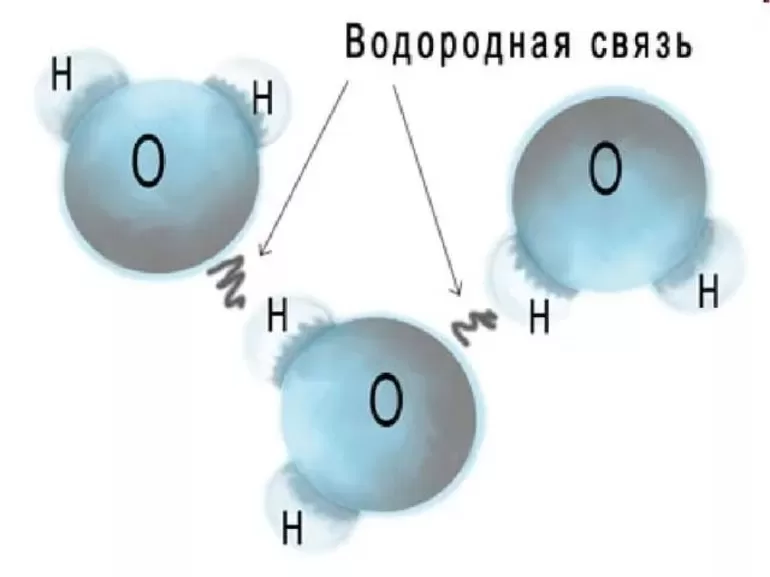
Определение «водородная связь» появилось в 1920 году. Его применили учёные Латимер и Родебуш для объяснения сущности аномалий, наблюдавшихся при кипении воды, предельных одноатомных спиртов и жидкого фтороводорода. При сопоставлении точек кипения в ряду водородсодержащих родственных соединений Н2O (вода), Н2S (сероводород), Н2Se (селеноводород) и Н2Te (теллуроводород) обнаружилось, что первый участник этого списка (H2O) переходит из жидкости в пар гораздо раньше, чем можно было бы ожидать, следуя закономерности, которой подчиняются остальные члены. Истинное значение точки кипения воды оказалось на 200° C выше ожидаемого.
Это справедливо и для другого ряда — NH3 (аммиак), PH3 (фосфин), H3As (арсин), Н3Sb (стибин), где фактическая (-33 °C) температура кипения аммиака на 80 градусов превышает ожидаемую. Если считать, что молекулы в жидкости удерживаются исключительно Ван-дер-Ваальсовыми силами, разрушающимися при переходе в газообразную фазу, то эти скачки не должны наблюдаться, а объяснить их невозможно.
Неожиданные повышения температур кипения привели к выводам о присутствии дополнительно связывающих молекулы сил, изменяющих физические свойства. Водородной связи принадлежит роль в создании аномальных температур кипения спиртов, если их сравнивать с аналогами без гидроксильных групп (-ОН). В перечне заслуг H-связей не только изменение точек кипения веществ, но и упрочнение их кристаллических решёток, вызывающее повышение температур плавления, поверхностного натяжения и вязкости.
Например, борная кислота с формулой H3BO3 имеет слоистую триклинную кристаллическую решётку, где каждая из молекул посредством H-связей крепится к трём другим. В результате образуются плоские слои, которые за счёт межмолекулярных связей создают кристаллическую структуру — «паркет» из шестиугольников.
При помощи инфракрасной спектроскопии сегодня можно достоверно выявить любой тип межмолекулярного взаимодействия: группы с Н-связями заметно отличаются по спектральным характеристикам от остальных случаев. Исследования структуры вещества помогают измерить дистанцию между водородом и атомом-акцептором, сравнить её с суммой радиусов и, если первое значение не превышает второе, доказать существование явления.
Понятие водных кластеров

Земля — чемпион по содержанию воды среди других планет Солнечной системы. Моря и океаны, реки и озёра, средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов.
Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете. Это связано с особенностями, нехарактерными для соединений, считающихся её близкими аналогами. Только вода находится в жидком и твёрдом состоянии при условиях, в которых водородные соединения серы или селена с большей атомной массой становятся газообразными.
Присутствие H-связей в молекулах воды обуславливает образование водных кластеров или комплексов, а димеры воды служат их простейшими примерами. Энергия их водородных связей ненамного больше энергии броуновского движения при нормальных условиях, но сильно отличается от мощности ковалентных связей в гидроксильных группах, а они в 200 раз превышают тепловые показатели. Вода из простой жидкости превращается в сложную, «связанную» сетью H-связей, хотя они относительно слабы и неустойчивы, самопроизвольно возникают и исчезают при температурных изменениях.
Кристаллическая структура льда имеет объёмную сетку из этих связей, и молекулы H2O расположены так, чтобы атомы водорода одних молекул оказывались направленными к атомам кислорода соседей. В ледяном кристалле между молекулами обязательно присутствуют пустоты, их объёмы немного превышают размеры отдельных молекул воды. Именно благодаря таким «карманам» плотность льда меньше, чем у его жидкой фазы, а гигантские айсберги остаются дрейфовать на поверхности, в то время как замерзание большинства других веществ существенно увеличивает их плотность.
Водородные связи сообщают воде уникальную характеристику, обеспечивающую существование разнообразных форм жизни в областях, где окружающие температуры опускаются ниже нуля. Если на минуту представить, что лёд начнёт тонуть в воде, то моря зимой рано или поздно промёрзнут до самого дна, и рыбы будут обречены на вымирание. Люди могли бы растапливать лёд для получения живительной влаги, но это потребует больших энергозатрат.

Ещё одно проявление H-связей — голубая окраска чистой воды в её толще. Колебание одной молекулы воды вызывает движение соседних частиц, соединенных с ней водородными связями. Красные лучи из состава солнечного спектра будут расходоваться на поддержание этих колебаний, поскольку больше всего соответствуют им энергетически. Происходит фильтрация красных лучей — их энергия поглощается и рассеивается в виде тепла колеблющимися молекулами.
Начинает проступать голубой участок спектра, уравновешивающий отсутствие красного. Вода самостоятельно окрасится в волшебный небесный цвет. Для этого необходимо, чтобы солнечные лучи прошли через двухметровую толщу чистой воды и потеряли достаточное количество красного спектра.
Значение для органических соединений
Многие органические вещества не могут растворяться в воде. Но если это происходит, то процесс не обходится без активного участия H-связей. Кислород и азот, главные доноры протонов, часто играют роли акцепторов. Органические соединения, содержащие O и N, легко растворяются в воде: здесь кислород и азот выступают в качестве атомов-акцепторов, а атомом-донором является кислород из молекул воды. Возникающие H-связи перемещают органическое вещество в раствор, «растаскивая» его на молекулы.

Просматривается эмпирическая закономерность: органическое соединение будет легко растворяться в воде, если в составе его молекул на каждый атом кислорода приходится не более 3 атомов углерода. Например, бензол C6H6 в воде растворяется плохо, но замена одной группы (-СН) на (-N) даёт пиридин С5Н5N, смешивающийся с водой в любых пропорциях.
Для неводных растворов, в которых растворителями служат органические вещества, тоже характерны H-связи. В них водород частично положительно поляризован, а поблизости обнаруживается молекула с сильным акцептором — чаще всего это бывает кислород. Жирные кислоты приобретают полезную способность растворяться в хлороформе HCCl3, а растворённый в ацетоне ацетилен получил важное техническое применение. Горючий газ C2H2 под давлением чувствителен к сотрясениям и взрывоопасен, но его растворение в ацетоне C3H6O позволяет безопасно хранить и транспортировать любые объёмы.
Трудно переоценить роль H-связей в прочных полимерных и биополимерных структурах. Целлюлоза (клетчатка древесины) в строении молекулы располагает гидроксильные группы по бокам полимерной структуры, в которой чередуются циклические фрагменты. Невысокая энергия единичной Н-связи, умноженная на количество по всей длине молекулярной цепи, вызывает в итоге мощное притяжение. Из-за этого целлюлозу можно растворить только в высокополярных растворителях — дигидроксотетрааммиакате меди, известном как реактив Швейцера.
Карбонильные (=C=O) и аминогруппы (-NH2) в расположенных рядом полимерных цепочках капрона и нейлона тоже образуют связи этого типа и увеличивают механическую прочность веществ, поскольку в полиамидных структурах создаются кристаллические фрагменты. Аналогично ведут себя полиуретаны и белки: витки белковых спиралей закрепляются всё теми же H-связями, возникающими при взаимодействии функциональных групп.

Полимерная макромолекула ДНК — хранилище запасов информации о живом организме, зашифрованной в чередующихся фрагментарных циклах. Их карбонильные и аминогруппы имеют четыре типа азотистых оснований (аденин A, гуанин G, тимин T, цитозин C) и располагаются в форме боковых ответвлений по длине молекулы. От порядка их чередования зависят индивидуальные особенности всего живого на планете. Взаимодействия пар в составе аминогруппы и атома азота дают начало множеству Н-связей, которые удерживают 2 молекулы ДНК в виде классической двойной спирали.
Источник
