Какими свойствами отличаются изомеры

Различия изомеров по свойствам.
Понятие изомерии является в современной химии одним из основных. Впервые учащиеся с ним знакомятся в курсе органической химии, обычно в 10 классе. В учебниках различия свойств изомеров приводится по мере последовательного изучения веществ различных классов и в результате, к моменту завершения курса, в лучшем случае сохраняются лишь разрозненные сведения, освещающие этот вопрос.
В настоящей работе сделана попытка обобщения данного материала, что может быть полезным на итоговых уроках по курсу органической химии, особенно при профильном обучении в свете новых ФГОС, а также на факультативах и элективных курсах по предмету.
В основу систематизации различий изомеров по свойствам были положены параметры, характеризующие именно эти различия, а не классы соединений. Это освещает проблему с несколько иной стороны и дает учителю возможность как использовать приведенные ниже примеры, так и предложить учащимся подобрать примеры собственные, что, конечно, поможет выработать взгляд на курс органической химии как на единое целое.
Традиционно, описывать различие изомеров начинают с физических свойств веществ, принадлежащих к разным классам, например, этанола и диметилового эфира. Вместе с тем, это можно показать и на примере веществ одного класса. Так натуральный каучук (цис- изомер) эластичен, тогда как гуттаперча (транс- изомер) обладает лишь пластичностью.
Различия по температурам кипения можно показать как на примере алканов
2,2-диметилбутан кипит при 50о С, а н- гексан при 69о С. Такое различие показывает, что разветвленные изомеры имеют температуры кипения ниже, чем неразветвленные.
Геометрические изомеры – малеиновая и фумаровая кислоты – плавятся при разных температурах ( соответственно, 130,5о C и 187о С). Видимо играет роль характер водородных связей. У малеиновой кислоты преобладают внутримолекулярные, а у фумаровой – межмолекулярные водородные связи.
Изомеры различаются и скоростями однотипных реакций в которые они вступают. В частности, 2-метилбутан в реакциях радикального галогенирования более активен, чем 2,2-диметилпропан, так как было установлено, что водород при третичном атоме углерода замещается легче, нежели при первичном.
Эти же кинетические различия проявляются и в реакциях электрофильного замещения у аренов. Пропилбензол галогенируется или нитруется медленнее, чем изопропилбензол, ведь более разветвленный радикал проявляет индуктивный эффект большей величины, что облегчает подобные реакции.
Изомеры, имеющие одну и ту же функциональную группу могут вести себя по разному. Пара-метилфенол легко нейтрализуется раствором щелочи, тогда как бензиловый спирт со щелочами практически не реагирует. В этом, в частности, проявляется разница в поведении фенольного и спиртового гидроксила.
Таутомерные формы глюкозы различаются, например, отношением к реактиву Толленса. В реакцию серебряного зеркала вступает только линейная форма, тогда как циклические формы этой реакции не дают.
Возможно у изомеров протекание реакций с одним и тем же реагентом, но по различным механизмам. Галогенирование пропена протекает по электрофильному механизму, а механизм галогенирования циклопропана, видимо, радикальный.
Образование продуктов разных классов также может иллюстрировать различия изомеров по свойствам. Пентадиен-1,4 при гидратации образует непредельный двухатомный спирт, а любой изомерный алкин – кетон.
Направление реакций при действии одного реагента на изомеры может быть различным. В амиде молочной кислоты при действии хлороводорода гидроксил замещается хлором, аминогруппа при этом сохраняется. Аминопропионовая кислота же охотно образует соль – гидрохлорид.
Возможно также образование разного числа продуктов реакции. При гидрогалогенировании бутена-1, как и в других подобных реакциях, несмотря на правило Марковникова, все равно образуется два продукта, один из которых преобладает. Бутен-2 образует единственный продукт.
В заключение, следует отметить, что приведенные примеры далеко не исчерпывают рассматриваемую тему. Ведь изомерия возможна и для неорганических соединений. Гремучая кислота (НОNС) сильно отличается по свойствам от циановой кислоты (НОСN). Цис и транс формы дихлордиамминплатины обладают принципиально разной противоопухолевой активностью. «Изомерию», если можно так выразиться, можно встретить даже в русском языке, ведь слова НОС и СОН; ПАЛЬТО и ЛАПОТЬ; АПЕЛЬСИН и СПАНИЕЛЬ по сути дела тоже «изомерны».
В.О.Воробьев, учитель химии ГОУ №77, методист ИМЦ Петроградского района Санкт-Петербурга.
Источник
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
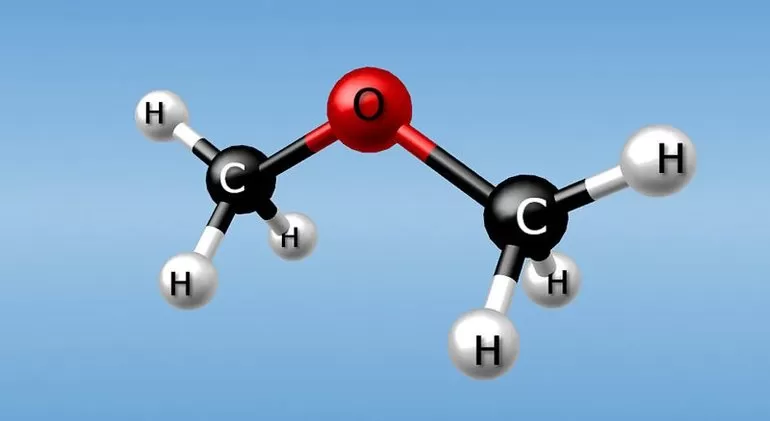
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
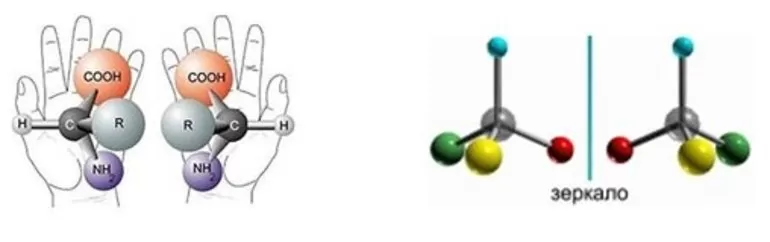
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Источник

Определение понятия

В 1823 году завязался спор между учеными Ф. Велером и Ю. Либихом из-за разных свойств одного вещества — AgCNO. Эта формула соответствовала и гремучему, и циановокислому серебру. Второй подобный случай произошел с Й. Берцелиусом. Он исследовал виноградную и винную кислоты и в 1830 году впервые использовал термин «изомерия». Это явление ученый объяснил тем, что простые атомы таблицы Менделеева по-разному распределяются в молекуле.
И лишь во второй половине XIX века появилось подлинное определение термина. В его основание легли стереохимическое учение Я. Вант-Гоффа и теории строения А. Бутлерова. Первый выявил пространственную изомерию, второй — структурную. Сегодня это название носит явление, которое заключается в существовании соединений с одинаковой массой и атомным составом, но разным расположением в пространстве и строением.
Структурный тип
Существует несколько типов изомерии. Структурным является тот, при котором различия наблюдаются в химическом строении молекулы. Сюда можно отнести несколько видов:
- углеродного скелета;
- валентную;
- межклассовую;
- положения;
- метамерию.
Разный порядок связи атомов обуславливает изомерию углеродного скелета. Самые простые примеры для этого случая: бутан и изобутан. Формула первого — СН3-СН2-СН2-СН3, а второго — (СН3)3СН. Сюда же можно отнести такие вещества, как фенантрен и антрацен, метилциклопропан и циклобутан. А также структурная изомерия характерна для гомологического ряда алканов.
Валентной изомерией называется вид структурной, при котором атомы переходят из одного в другой только благодаря перераспределению связей. То есть у каждого вещества есть свои изомеры: у бензола это призман, бензол Дьюара и бензвален.
Если отличается характер функциональной группы, то говорят о межклассовом типе. К нему относят диметиловый эфир и этанол: СН3-О-СН3 и СН3-СН2-ОН. Отличия в положении одних и тех же кратных связей или функциональных групп при общем углеродном скелете — характерные черты одноименной изомерии. Основные примеры: 4-хлорбутановая кислота или 2-хлорбутановая кислота.
Метамерия — еще один вид изомерии органических соединений. Его особенности заключаются в том, что атомы углерода по-разному распределяются между углеводородными радикалами, которые разделены гетероатомом. Известен этот тип в числе простых и сложных эфиров, аминов и тиоспиртов. Но сегодня это понятие редко используется. А. Бутлеров называл явление изомерией нецельных структур, а наглядными примерами служат диэтиловый и метилпропиловый эфир: СН3СН2ОСН2СН3 и СН3ОСН2СН2СН3.
Особенности стереоизомерии

Причина возникновения пространственной или стереоизомерии — молекулы различаются в пространственной конфигурации, но имеют абсолютно одинаковое химическое строение. Их обозначают с помощью специальной стереохимической номенклатуры, собранной в разделе Е правил ИЮПАК.
Эту группу делят на несколько видов:
- энантиомерия или оптическая изомерия;
- диастереомерия;
- геометрический тип.
Если комбинация пространственных изомеров не составляет пару антиподов, то их относят к диастереомерам. Такие молекулы имеют различную конфигурацию элементов хиральности.
Подобные вещества: D -манноза и D -глюкоза, винная и мезовинная кислота. Другие виды стереоизомерии лучше рассмотреть более детально.
Геометрический вид
Геометрическая классификация характеризуется одинаковым порядком соединения атомов при разном их расположении. В таких изомерах стереогенная группа — это малые циклы или кратная связь. Но они могут существовать только при наличии функциональных соединений. Названия такого явления могут отличаться — транс и цис изомерия.
В первом случае отличающиеся заместители находятся по разные стороны от двойной связи. А во втором одинаковые элементы при разных углеродных атомах имеют общее место расположения. Разные заместители обозначают латинскими буквами E — entgegen или Z — zusammen. Если необходимо установить тип конфигурации, то определяют старшинство атомов, сравнивают их порядковые числа.

Пометку буквой Z имеют изомеры, в которых оба старших заместителя расположены на одной стороне связи. А у E-молекул они находятся по разным бокам. Пример расчетов: вещество с формулой 1-бром-1-хлор-2-нитроэтилена, старшие заместители — Н с номером 1, Br (35), N (7) и Cl (17). В первом атоме углерода главнее бром (35), во втором — азот (7). Они находятся по разным сторонам, поэтому изомер относится к группе E. А если старший заместитель у первого атома Cl (17), а у второго Br (35), то это Z-изомер.
Иногда элементы одинаковы, они связаны с ненасыщенными атомами углерода, тогда необходимо сравнивать второй и третий слой молекулы. Если в конкретном примере заместители одинаковы, то нужно рассматривать следующие группы.
Оптическая группа
В 19 веке ученые выявили, что при пропускании поляризованных лучей через некоторые виды веществ, они отклоняют плоскость света на определенный угол. Есть также два соединения, которые искажают поляризацию на углы, одинаковые по величине, но разные по знаку. Эти молекулы получили название оптических изомеров — энантиомеров или антиподов.
Если в составе смеси содержится одинаковое количество изомеров, которые вращаются в разные стороны, то ее называют рацемической. Вещества, содержащие один и более асимметричных атомов углерода, считаются оптически активными. Два таких изомера отличаются, как какой-либо предмет и его отражение в зеркале. Если их наложить друг на друга, то они не совпадут — хиральные молекулы. Но иногда они полностью идентичны — ахиральные вещества.
К хиральным, кроме углерода, относятся соединения с атомами кремния, фосфора, азота. У них есть общая черта — стереогенная плоскость или ось. Изобразить такие изомеры можно с помощью уравнений Фишера. Ключевые моменты построения:
- проекции связей, направленных от зрителя, рисуют вертикальной пунктирной линией;
- устремленные к наблюдателю — горизонтальная черта;
- центр их пересечения называется хиральным — это асимметричный атом углерода;
- на концах линий изображают заместители.
В этой схеме не нужно рисовать символ атома углерода. Но если центром является другая частица, то ее необходимо подписать. При изображении заместителей строго соблюдают их пространственное расположение.
Химические превращения

Явление, при котором структурные изомеры превращаются один в другой, называют изомеризацией. Эти процессы особенно важны в промышленности. Есть особая технология превращения алканов в изоалканы, что повышает октановое число моторного топлива. Пентан изомеризуется в изопентан, затем его дегидрируют и создают изопрен.
Перегруппировки внутри молекул также считаются изомеризацией. Большое значение в промышленности имеет явление Бекмана — циклогексаноноксим переходит в капролактам, так называется сырье для изготовления капрона.
Рацемизацией является процесс взаимного превращения энантиомеров. Следствие этого явления — исчезновение оптической активности из-за появления эквимолярной смеси отрицательных и положительных форм. Диастереомеры при взаимопревращении образуют тремодинамически устойчивую смесь. А процесс с конформационными изомерами называется одноименным равновесием.
Изомерия приводит к увеличению известных и потенциально возможных соединений. Ученые выявили более 500 видов структурных дециловых спиртов, 1500 пространственных изомеров. Для подсчетов используются специальные математические формулы, а при рассмотрении проблем химического явления применяют топологические методы.
Источник

ОСНОВНЫЕ ПОЛОЖЕНИЯ
ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ А.М. БУТЛЕРОВА
1 ПОЛОЖЕНИЕ:
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям.
Органические вещества образуют углеродные цепи, в которых углерод всегда имеет валентность IV.
2 ПОЛОЖЕНИЕ
Свойства веществ определяются не только их качественным и количественным составом, но и химическим строением молекулы (порядком связи атомов друг с другом).
СТРУКТУРНАЯ ФОРМУЛА, ИЛИ ФОРМУЛА СТРОЕНИЯ – схематическое изображение строения молекулы, показывающее последовательность соединения атомов и функциональных групп

3 ПОЛОЖЕНИЕ
По свойствам можно описать строение его молекулы, а по строению молекулы – предсказать свойства вещества.
4 ПОЛОЖЕНИЕ
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга, причем влияние ослабевает при увеличении расстояния между ними. Это отражается на химических и физических свойствах вещества.
ВИДЫ УГЛЕРОДНЫХ ЦЕПЕЙ

ГОМОЛОГИ
Вещества, имеющие сходное химическое строение (тип углеродного скелета, вид, количество и расположение заместителей, вид, количество и расположение кратных связей и т.д.), но отличающиеся лишь длиной углеродной цепи (на одну или несколько –СН2- групп)


ИЗОМЕРЫ
вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение, а, следовательно, и свойства. Возможность образовывать изомеры называется изомерией.
ВИДЫ ИЗОМЕРИИ
1. структурная
2. пространственная (стереоизомерия).
СТРУКТУРНАЯ ИЗОМЕРИЯ И ЕЕ ВИДЫ
Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле;
1. ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА:
вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Веществ с молекулярной формулой С4Н10 существует два:

2. ИЗОМЕРИЯ ПОЛОЖЕНИЯ
обусловлена различным положением кратной связи или функциональной группы при одинаковом углеродном скелете молекул.
Например:
С3Н8О:


3. МЕЖКЛАССОВАЯ ИЗОМЕРИЯ
вещества из разных классов веществ имеют одинаковую общую формулу.
ПАРЫ МЕЖКЛАССОВЫХ ИЗОМЕРОВ:
CnH2n – алкены и циклоалканы
CnH2n-2 – алкины и алкадиены (и циклоалкены)
СnH2n+2O – спирты и простые эфиры
CnH2nO – альдегиды и кетоны, а также: циклические спирты, циклические эфиры, непредельные спирты и эфиры
CnH2nO2 – карбоновые кислоты и сложные эфиры
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ И ЕЕ ВИДЫ
стереоизомеры отличаются расположением атомов в пространстве при одинаковом порядке связей между ними.
1. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ (ИЛИ ЦИС-ТРАНС-ИЗОМЕРИЯ)
Геометрическая изомерия свойственна соединениям, содержащим двойные связи С = С и циклопарафинам.
Заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение).

Геометрические изомеры различаются по физическим свойствам (температурам кипения и плавления, растворимости и др
Некоторые физические свойства малеиновой и фумаровой кислот

2. ОПТИЧЕСКАЯ ИЗОМЕРИЯ
свойственна молекулам органических веществ, не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Это кислоты, спирты, углеводы и др.

ИЗОМЕРИЯ АЛКАНОВ
СТРУКТУРНАЯ ИЗОМЕРИЯ
1.изомерия углеродного скелета.

ИЗОМЕРИЯ ЦИКЛОАЛКАНОВ
1. Изомерия углеродного скелета
a) число углеродных атомов в кольце:

б) число углеродных атомов в заместителях:

в) положение заместителя в кольце:

2. Межклассовая изомерия: циклоалканы изомерны алкенам.

ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):

ИЗОМЕРИЯ АЛКЕНОВ:
1. Изомерия углеродного скелета:
(начиная с С4Н8 – бутен и 2-метилпропен)

2. Изомерия положения кратной связи:

3. Межклассовая изомерия:
с циклоалканами (начиная с пропена): C4H8 – бутен и циклобутан.

ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ:
Из-за того, что вокруг двойной связи невозможно свободное вращение, становится возможной цис-транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи:

ИЗОМЕРИЯ ДИЕНОВ
1. Изомерия положения двойных связей:

2. Изомерия углеродного скелета:

3. Межклассовая изомерия с алкинами и циклоалкенами.
Например, формуле С4Н6 соответствуют следующие соединения:

4. Пространственная изомерия: цис-транс-изомерия.










12(Б) Тесты ЕГЭ ФИПИ 2015 Гомология и изомерия. Радикал. Функциональная группа.
Источник
