Какими свойствами восстановительными или окислительными обладает фосфор

Фосфор (греч. phos – свет + phoros – несущий) – химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.

Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 – фосфорит
- Ca10(PO4)6(F,Cl,OH)2 – апатит

Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ – фосфин – боевое
отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑

2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество
является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 – гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
KClO3 + P → KCl + P2O5

Оксид фосфора V – P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль – определяет соотношение основного
оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи – соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида – соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида – соотношение 2:1)

Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 – метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота – H3PO4 (соли – фосфаты PO43-)
- Метафосфорная кислота – HPO3 (соли – метафосфаты PO3-)
- Фосфористая – H3PO3 (соли – фосфиты PO33-)
- Фосфорноватистая – H3PO2 (соли гипофосфиты – PO23- )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета – фосфат серебра – образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука – Ca3(PO4)2
- Простой суперфосфат – смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат – Ca(H2PO4)2*H2O
- Преципитат – CaHPO4*2H2O
- Костная мука – продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос – в основном состоит из моноаммонийфосфата – NH4H2PO4

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Фосфор – жизненно важный элемент из пятой группы периодической таблицы Менделеева. Химические свойства фосфора зависят от его модификации. Наиболее активным веществом является белый фосфор, окисляющийся на воздухе. Фосфор имеет две валентности (III и V) и три степени окисления – +5, +3, -3.

Фосфор и соединения
Фосфор имеет три аллотропические модификации, отличающиеся химическими и физическими свойствами:
- белый;
- красный;
- чёрный.
Под фосфором в химических реакциях чаще всего понимают белый фосфор (P4). Красный фосфор вступает в реакции при определённых условиях. Например, реагирует с водой при нагревании и под давлением. Чёрный фосфор практически инертен.

Рис. 1. Светящийся белый фосфор.
Фосфор реагирует с простыми и сложными веществами, образуя:
- фосфин;
- фосфорную кислоту;
- фосфиды;
- оксиды.
Фосфин (РН3) – плохо растворимый в воде ядовитый газ, аналог аммиака. В отсутствии кислорода при нагревании разлагается на простые вещества – фосфор и водород.
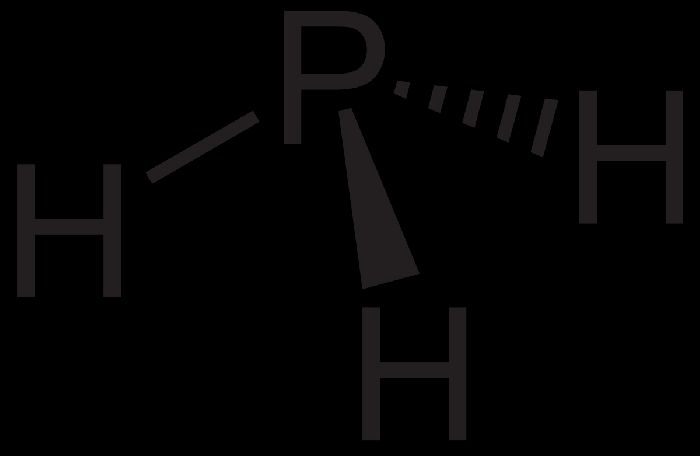
Рис. 2. Фосфин.
Фосфорная или ортофосфорная кислота (H3PO4) образуется при взаимодействии фосфора или оксида фосфора (V) с водой.
Фосфиды – соли, образующиеся при взаимодействии с металлами или неметаллами. Они неустойчивы и легко разлагаются под действием кислот или воды.
Фосфор может образовывать два оксида – P2O3 и P2O5.
H3PO4 – кислота средней силы, проявляющая амфотерные свойства при взаимодействии с сильной кислотой. Фосфорная кислота образует фосфаты.
Химические свойства
Основные химические свойства фосфора и его соединений описаны в таблице.
Вещество | Реакция | Особенности | Уравнение |
Фосфор | С O2 | При избытке O2 образует оксид фосфора (V) | – 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
С металлом | Является окислителем | 3Mg + 2P → Mg3P2 | |
С галогенами и неметаллами | Не реагирует с водородом | 2P + 3S → P2S3 | |
С Н2О | 8Р + 12Н2О → 5РН3 + 3Н3РО2 | ||
С кислотами | 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O | ||
Со щелочами | P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 | ||
РН3 | С O2 | Воспламеняется на воздухе | РН3 + 2O2 → H3PO4 |
С галогенами и неметаллами | РН3 + 2I2 + 2H2O → H(PH2O2) + 4HI | ||
С кислотами | Проявляет свойства восстановителя | РН3 + 3H2SO4 → H2(PHO2) + 3SO2 + 3H2O | |
H3PO4 | С металлами | С активными металлами | 2H3PO4 + 3Ca → Ca3(PO4)2 + 3H2↑ |
С Н2О | Подвергается диссоциации | H3PO4 + H2O ↔ H3O+ + H2PO4– | |
Со щелочами | Образует кислые или щелочные фосфаты | H3PO4 + 3NaOH → Na3PO4 + 3H2O | |
С оксидами | 2H3PO4 + 3K2O → 2K3PO4 + 3H2O | ||
С солями | 2H3PO4 + 3CaCO3 → Ca3(PO4)2 + 3H2O + 3CO2↑ | ||
С аммиаком | H3PO4 + 3NH3 → (NH4)3PO4 | ||
P2O3 | С галогенами и неметаллами | – 2P2O3 + 6Cl2 → 4PCl3O + O2; – 2P2O3 + 9S → P4S6 + 3SO2 | |
С Н2О | Медленно реагирует с холодной водой и быстро – с горячей | P2O3 + 3H2O → 2H3PO3 | |
Со щелочами | P2O3 + 4NaOH → 2Na2HPO3 + H2O | ||
P2O5 | С Н2О | Реагирует с взрывом | 2P2O5 + 6H2O → 4H3PO4 |
С кислотами | Реакция замещения | 4HNO3 + 2P2O5 → 4HPO3 + 2N2O5 | |
Фосфиды | С Н2О | Образуют гидроксиды металлов и фосфин | Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 |
С кислотами | Реакция замещения | Ca3P2 + 6HCl → 3CaCl2 + 2PH3 |
При нагревании оксид фосфора распадается. Причём P2O3 образует красный фосфор, а P2O5 – оксид фосфора (III) и кислород.

Рис. 3. Красный фосфор.
Использование
Широкое применение имеют соединения фосфора:
- из фосфатов получают удобрения и моющие средства;
- фосфорная кислота используется для окрашивания ткани;
- оксид фосфора (V) осушает жидкости и газы.
Красный фосфор используется в производстве спичек и взрывчатых веществ.
Что мы узнали?
Фосфор – активный неметалл, реагирующий с простыми и сложными веществами. В результате реакций образует оксиды (III) и (V), фосфин, фосфорную кислоту и фосфиды. Соединения фосфора вступают в реакцию с металлами, неметаллами, кислотами, щелочами, водой. Фосфор и его соединения используются в промышленности и сельском хозяйстве.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Алина Батарова
5/5
Оценка доклада
Средняя оценка: 4.8. Всего получено оценок: 149.
Источник
Цель урока: Определить положение фосфора в периодической системе химических элементов Д.И.Менделеева, рассмотреть строение атома фосфора, физические и химические свойства, области применения фосфора.
Задачи урока:
Образовательные:
- Рассмотреть строение атома фосфора согласно его положение в периодической системе химических элементов Д.И.Менделеева, аллотропные модификации фосфора.
- Изучить физические и химические свойства фосфора, нахождение в природе, его области применения.
- Продолжить формирование умения учащихся работать с периодической системой химических элементов Д.И.Менделеева.
- Совершенствовать умения составлять уравнения химических реакций.
Развивающие:
- Развивать память и внимание учащихся.
- Формировать положительную мотивацию на изучение предмета химии.
- Учить применять имеющиеся знания в новой ситуации.
Воспитательные:
- Показать значимость химических знаний для современного человека.
Оборудование: ПСХЭ, компьютер, мультимедийный проектор, электронное пособие «Видеодемонстрации».
Тип урока:
Комбинированный. Урок изучения нового материала.
Формы организации учебной деятельности:
- самостоятельная работа с текстом учебника;
- фронтальная;
- сообщения учащихся (индивидуальная);
- работа в группах.
Методы обучения. Методы организации учебной деятельности:
- словесные (эвристическая беседа),
- наглядные (коллекция, видеофрагмент)на основе познавательной деятельности,
- частично-поисковый.
Педагогические приемы:
- учебно-организационные (определение цели и задачи урока, создание благоприятных условий деятельности);
- учебно-информационные (беседа, постановка проблемы, ее обсуждение, работа с учебником, наблюдение);
- учебно-интеллектуальные (восприятие, осмысление, запоминание информации, решение проблемных задач, мотивация деятельности).
Ход урока
I. Организационный момент
психологический настрой учащихся, проверка готовности к уроку.
II. Актуализация знаний
(слайд 2.)
Мы продолжаем изучение отдельных элементов периодической системы Менделеева. Сегодня на уроке речь пойдет о химическом элементе, участвующем в детективной истории, отрывок из которой я вам сейчас прочту.
Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я”.
Артур Конан-Дойл. “Собака Баскервилей”
Узнали? Что же это за произведение? (Ответ детей)
Да, вы правы. Это отрывок из произведения Артура Конан Дойля “Собака Баскервилей». Назовите химический элемент, который замешан в этой истории. Предлагает ученикам ответить на вопрос: «А могла ли существовать такая собака или это вымысел А.Конан-Дойля?» Чтобы правильно ответить на этот вопрос предлагает ученикам более подробно изучить элемент и простое вещество «фосфор».
Называет тему урока «Фосфор и его соединения».
Откройте тетради и запишите тему урока. «Фосфор и его соединения».
Цель урока: получить знания о о химическом элементе, простом веществе фосфоре, его аллотропных модификациях, химических свойствах, применении и значении фосфора в природе и жизни человека.
3. Изучение нового материала
1. Положение фосфора в периодической системе химических элементов (слайд 1, 2)
Задание: Используя периодическую систему химических элементов, дайте характеристику химическим элементам фосфора и азота.
- Вариант 1 – положение в ПСХЭ и строение атома азота.
- Вариант 2 – положение в ПСХЭ и строение атома фосфора.
1. Найдите черты сходства, различия между строением атома азота и фосфора (табл.1 стр.4-5)
Вывод: Оба элемента находятся в главной подгруппе V группы ПСХЭ, на последнем энергетическом уровне по 5 электронов, имеют одинаковые значения низших степеней окисления
-3 (если проявляют окислительные свойства, например, с металлами, водородом) и +5 в кислородсодержащих соединениях.
2. Определите степени окисления фосфора в следующих соединениях:
PH3; Ca3P2; P; P2O3; P2O5; H3PO3; H3PO4
1) Какие соединения фосфора наиболее устойчивы? С какой степенью окисления?
2) Какими свойствами – восстановительными или окислительными – обладает фосфор? Почему?
2. Открытие фосфора – сообщение учащейся
ВЫСТУПЛЕНИЕ УЧАЩЕГОСЯ № 1 «История открытия фосфора»
Из всех древних элементов только фосфор имеет точную дату открытия – 1669 год.
В поисках эликсира молодости и попытках получения золота алхимик XVII столетия Геннинг Бранд из Гамбурга пытался изготовить “философский камень”. Для этой цели он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он подверг сильному прокаливанию в смеси с песком и древесным углем без доступа воздуха.
В результате Бранд получил вещество, обладающее необыкновенными свойствами: оно светилось в темноте.
Интерес к новому веществу был огромный, и Бранд надеялся извлечь из своего открытия изрядную прибыль: недаром он был в прошлом гамбургским купцом. Сохраняя способ изготовления в строжайшей тайне, Бранд показывал новое вещество за деньги. А желающим продавал его небольшими порциями только за чистое золото. Спустя некоторое время Бранд продал также и секрет изготовления фосфора дрезденскому химику Крафту, который, подобно Бранду, стал ездить по дворцам влиятельных особ, показывая фосфор за деньги, наживая огромное состояние.
Конец «философскому бизнесу» положил английский химик Роберт Бойль, который в 1680 году опубликовал в научном журнале более простую и доступную методику получения фосфора.
Наименование элемента происходит от греческих слов «фос» – свет и «форос», – несущий.
В России термин фосфор введен в 1746 году Михаилом Васильевичем Ломоносовым.
4. Физические свойства
Речь мы поведем о фосфоре как о простом веществе. Необычное светящееся вещество – белый фосфор. Кроме белого, есть еще красный фосфор. Ребята, как называется явление существования нескольких простых веществ, образованных одним химическим элементом?
УЧАЩИЕСЯ: Аллотропия.
УЧИТЕЛЬ: А как в таком случае вы назовете вещества белый фосфор и красный фосфор?
УЧАЩИЕСЯ: Аллотропными модификациями фосфора.
УЧИТЕЛЬ: Я предлагаю вам самостоятельно заполнить таблицу, лежащую у вас на столе и сравнить физические свойства аллотропных видоизменений фосфора.
А поможет вам выполнить это задание параграф учебника. Сравните физические свойства аллотропных видоизменений фосфора – самостоятельная работа в парах (2.5 мин)
Аллотропные модификации.
Индивидуальная работа учащихся с учебником (стр. 159-160)
Задание: дайте характеристику:
1 ряд – белому фосфору
2 ряд – красному фосфор
По следующему плану: Аллотропныемодификации
Характер особенности | Белый | Красный |
1. Тип кристаллической решетки | ||
2. Внешний вид | ||
3. Ядовит (или нет) | ||
4. В чем растворяется | ||
5. Свечение | ||
6. Химическая активность |
Обмен полученной информацией и обсуждение.
Сходны или различны свойства белого и красного фосфора?
Ребята, вы видите, что свойства белого, красного различны, хотя они образованы одним химическим элементом. Как вы думаете, почему различны их свойства?
УЧИТЕЛЬ: Правильно. Различие заключается в строении этих веществ.
А знаете ли вы что, кроме упомянутых белого и красного существует еще и черный фосфор. Это тоже аллотропная модификация фосфора. По внешнему виду похож на графит, но является полупроводником, а при повышенном давлении проводит ток как метал. Черный фосфор – имеет слоистую атомную кристаллическую решетку. В то время, как белый и красный фосфор обладают изоляционными свойствами. Не ядовит. Черный фосфор – это наименее активная аллотропная модификация фосфора.
5. Химические свойства
Фосфор часто называют многоликим элементом. Не только из-за аллотропных видоизменений, но и благодаря химическим свойствам. Этот элемент может проявлять как окислительные, так и восстановительные свойства.
1) Взаимодействие фосфора с простыми веществами:
А) с металлами, образуя фосфиды.
Например, взаимодействие белого фосфора с кальцием.(видеофрагмент)
1. Задание: Запишите уравнение реакции, составьте уравнение электронного баланса. Взаимодействует с металлами с образованием фосфидов: (окислитель)
2Р + 3Са = Ca3P2 (фосфид кальция)
Б) Взаимодействие фосфора с неметаллами.
Например: Взаимодействие фосфора и кислорода (видеофрагмент горение белого фосфора). Как горит фосфор на воздухе и в кислороде?
Горит в кислороде и на воздухе с образованием оксида фосфора (V): (восстановитель)
Задание: Запишите уравнения реакции, составьте уравнение электронного баланса.
4Р + 5О2 = 2 Р2О5
Формулирование решения исходной задачи.
– Ребята, давайте вернемся к произведению писателя Артура Конан-Дойла «Собака Баскервилей». Сейчас самый подходящий момент обратиться к проблеме, поставленной в начале урока: прав ли был А.Конан-Дойл в описании собаки Баскервилей? Не допустил ли он химической ошибки в своем произведении?
Ученики находят ошибку и дают объяснение.
Ошибка в тексте
Белый фосфор действительно светится в темноте, что объясняется окислением его паров кислородом воздуха. Мелкодисперсный фосфор на воздухе самовоспламеняется. Белый фосфор – сильнодействующий яд (0,1 г – смертельная доза). Из его свойств следует, что если бы и удалось каким-то образом «расписать» не только собаку снаружи, но и ее пасть, то она быстро погибла бы от отравления, а ее труп превратился в костер.
В) Взаимодействие фосфора со сложными веществами (хлоратом калия) (слайд 18)
В смеси с бертолетовой солью от удара взрывается, воспламеняется.
5KClO3 + 6P = 3Р2О5 + 5KCl
Такая реакция происходит, когда мы зажигаем спички. В головке спичек содержится бертолетова соль, в намазке шкурки – красный фосфор.
6. Соединения фосфора
РН3 – фосфин. Бесцветный ядовитый газ с запахом гнилой рыбы, легко самовоспламеняется на воздухе. Образуется при гидролизе фосфидов:
Mg3P2 + 6 H2O = 3 Mg(OH)2 + 2 PH3 ↑
Ca3P2+6HCI= 3CaCI2+2PH3↑
1. Задание. Прочитайте в § 28 п. 3, с. 160 – 161 «Соединения фосфора».
Ответьте на вопросы:
2. Какими физическими свойствами обладает оксид фосфора(V)? Кислотные или основные свойства проявляет Р2О5?
Р2О5 – оксид фосфора (V). Белый гигроскопичный порошок, хорошо растворяется в воде, является кислотным оксидом, образует несколько кислот.
3. Запишите уравнения реакций взаимодействия оксида фосфора(V):
а) с CaО;
б) с H22O;
в) с Ca(OH)2.
4. Какая кислота соответствует оксиду Р2О5?
Р2О5 +3Н2О(гор) = 2Н3РО4
Н3РО4 – ортофосфорная кислота. Охарактеризуйте ее физические свойства. Твердое кристаллическое вещество белого или прозрачного цвета, не ядовита, кислота средней силы, хорошо растворима в воде.
5. Почему ортофосфорная кислота образует три ряда солей? Приведите примеры этих солей.
Соли. Средние – фосфаты Na3PO4; Кислые – гидрофосфаты Na2HPO4; дигидрофосфаты NaH2PO4
Реагирует со щелочами, основными оксидами, солями.
ВОПРОС УЧИТЕЛЯ: Реагирует ли фосфорная кислота с металлами? Почему?
Назовите качественный реактив на Н3РО4 и ее соли. Запишите уравнение соответствующей химической реакции в молекулярном и ионном видах.
Качественная реакция на фосфат-ион.
Лабораторный опыт: К3РО4+АgNO3 =
Задание классу:
1. В каком виде фосфор встречается в природе? (стр.161)
2. «Получение фосфора»: УПР.4, СТР.163
Свободный фосфор получают в электрических печах без доступа воздуха из ортофосфата кальция, смешивая с песком и углем. Процесс проходит в две стадии. Мы запишем суммарное уравнение процесса и уравняем его с помощью электронного баланса:
Са3(РО4)2 + 3SiО2 + 5СО t = 3CаSiО3 +2Р + 5СО
Цели. Самостоятельно изучить биологическое значение фосфора.
Задание
1. Прочитайте в § 28 п. 4 и 5, с. 161 – 162 «Биологическое значение фосфора».
2. Ответьте на вопросы:
1) В каких тканях организма человека химического элемента фосфора содержится больше всего?
2) В состав каких органических веществ входит химический элемент фосфор? Какова роль этих органических веществ в жизнедеятельности человека?
3) Где применяется фосфор и его соединения? (стр.162-163)
7. Закрепление изученного материала (фронтальный опрос)
Тест по теме «Фосфор»
Часть А. Вариант 1
1. В каком из перечисленных соединениях степень окисления фосфора равны +3
А. Р2О5
Б. NaPO3
В. Na3PO4
Г. РСl3
2. Какое из перечисленных веществ взаимодействует с оксидом фосфора (V)
А. оксид серы (IV)
Б. гидроксид натрия
В. Кислород
Г. серная кислота
3. В каком году был открыт фосфор
А. 1996
Б. 1969
В. 1669
Г. 1696
4. Составьте уравнение реакции горения фосфора. Коэффициент перед формулой восстановителя равен
А. 1
Б. 2
В. 5
Г. 4
5. Определите число протонов и нейтронов в ядре атома фосфора
А. р15 и n16
Б. р31 и n15
В. р16 и n31
Г. р16 и n6
Часть В.
1. Установите соответствие между названием соли и ее формулой. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
НАЗВАНИЕ СОЛИ | ФОРМУЛА СОЛИ |
А) гидрофосфат кальция | 1) Ca3P2 |
Б) дигидрофосфат калия | 2) Ca3(PO4)2 |
В) дигидрофосфат кальция | 3) KH2PO4 |
Г) фосфат кальция | 4) Ca HPO4 |
Д) фосфид кальция | 5) Ca(H2PO4)2 |
Тест по теме «Фосфор»
Часть А. Вариант 2
1. Степень окисления фосфора не может быть рана
А. -4
Б. +3
В. +5
Г. 0
2. Какое из перечисленных веществ не взаимодействует с оксидом фосфора (V)
А. оксид углерода (IV)
Б. оксид кальция
В. гидроксид натрия
Г. вода
3. Кем был открыт фосфор
А. Лавуазье
Б. Велером
В. Ломоносовым
Г. Брандом
4. Составьте уравнение реакции фосфора с кальцием. Коэффициент перед формулой окислителя равен
А. 1
Б. 2
В. 5
Г. 4
5. Охарактеризуйте оксид фосфора (V)
А. ядовитый газ
Б. основный оксид
В. кислотный оксид
Г. твердое вещество
Часть В
1. Установите соответствие между названием соли и ее формулой. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
НАЗВАНИЕ СОЛИ | ФОРМУЛА СОЛИ |
А) фосфат кальция | 1) Ca(H2PO4)2 |
Б) фосфид кальция | 2) Ca HPO4 |
В) дигидрофосфат кальция | 3) Ca3P2 |
Г) гидрофосфат кальция | 4) KH2PO4 |
Д) дигидрофосфат калия | 5) Ca3(PO4)2 |
8. Рефлексивно-оценочный этап
УЧИТЕЛЬ: Ребята, давайте поделимся своими впечатлениями по уроку.
- я знал…
- я хотел узнать…
- я узнал…
Выставляем оценки за работу на уроке.
9. Домашнее задание
§ 28 упр.
Приложение
Источник
