Какое число молекул двухатомного газа содержится в сосуде объемом 20 см3 при давлении

В сосуде содержится гелий под давлением кПа. Концентрацию гелия увеличили в раза, а среднюю кинетическую энергию его молекул уменьшили в раза.
Определите установившееся давление газа.
Ответ дайте в кПа.
Это задание решали 153 раза. С ним справились 34% пользователей.
Газ, который можно считать идеальным, перешел из состояния в состояние
Определите отношение давлений газа в начальном и конечном состояниях
Масса газа постоянна.
Это задание решали 43 раза. С ним справились 28% пользователей.
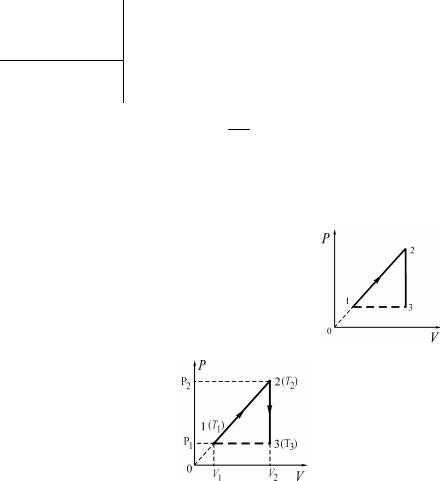
На рисунке изображен процесс перехода идеального газа постоянной массы из состояния в состояние
Найдите, во сколько раз изменилась абсолютная температура газа в состоянии по сравнению с абсолютной температурой в состоянии
Это задание решали 84 раза. С ним справились 70% пользователей.
Это задание решали 37 раз. С ним справились 59% пользователей.
На рисунке изображена зависимость давления от абсолютной температуры для
постоянной массы идеального газа.
Объем газа в состоянии равен л.
Определите объем газа (в л) в состоянии
Это задание решали 55 раз. С ним справились 69% пользователей.
Это задание решали 51 раз. С ним справились 47% пользователей.
моль идеального газа изохорно нагревают на К, при этом его давление
увеличивается в раза.
Какова первоначальная абсолютная температура газа?
Это задание решали 43 раза. С ним справились 35% пользователей.
Во сколько раз увеличится значение квадрата среднеквадратичной скорости
движения молекул, если для данной массы газа его внутренняя энергия
увеличится в раза?
Это задание решали 47 раз. С ним справились 64% пользователей.
Давление идеального газа в герметичном сосуде объемом л равно кПа.
Каким будет давление (в кПа) этого газа, если объем сосуда изотермически
увеличить в раза?
Это задание решали 56 раз. С ним справились 59% пользователей.
Давление газа на стенки герметичного баллона равно кПа.
Чему будет равно давление этого газа (в кПа) при увеличении квадрата средней скорости движения молекул газа в раза?
Это задание решали 41 раз. С ним справились 76% пользователей.
В ходе эксперимента давление разреженного газа в сосуде увеличилось в раза, а средняя энергия теплового движения его молекул уменьшилась в раза.
Во сколько раз увеличилась концентрация молекул газа в сосуде?
Это задание решали 115 раз. С ним справились 23% пользователей.
В сосуде находится идеальный газ при температуре C. Концентрация молекул этого газа равна м
Определите давление (в кПа), создаваемое
газом на стенки сосуда.
Постоянная Больцмана равна Дж/К.
Это задание решали 73 раза. С ним справились 55% пользователей.
В ходе эксперимента давление разреженного газа в сосуде уменьшилось в
раза.
Во сколько раз уменьшилось среднее значения квадрата скорости
движения молекул этого газа, если его концентрация осталась неизменной?
Это задание решали 22 раза. С ним справились 41% пользователей.
Идеальный газ находится в закрытом сосуде.
Во сколько раз уменьшится давление в этом сосуде, если его наполнить другим идеальным газом, молярная масса которого в два раза больше?
Абсолютная температура и плотность газа в
сосуде не изменились.
Это задание решали 62 раза. С ним справились 77% пользователей.
При проведении опыта в сосуд постоянного объема закачали воздух и одновременно сосуд с воздухом нагрели. В конечном равновесном состоянии воздуха в сосуде абсолютная температура повысилась в раза, а его давление возросло в раза по сравнению с начальными значениями.
Во сколько раз увеличилась масса воздуха в сосуде?
Это задание решали 75 раз. С ним справились 53% пользователей.
Источник
Задача 62.
Вычислить массу: а) 2л Н2 при 15 °С и давлении 100,7кПа (755мм рт. ст.); 6) 1м3 N2 при 10 °С и давлении 102,9 кПа (772мм рт. ст.); в) 0,5 м3 Cl2 при 20 °С и давлении 99,9 кПа (749,3мм рт. ст.).
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где P и V – давление и объём газа при температуре T; P0 (101,325кПа) и V0 – давление и объём газа при нормальных условиях; T0 (273К) – абсолютная температура. Преобразуя уравнение, получим выражение для расчета объёма газов при нормальных условиях:

Рассчитаем массу каждого газа, учитывая, что мольный объём газа равен 22,4л и, зная молекулярную массу газов, получим:

Ответ: а) 0,168г; б) 1.23кг; в) 1,456кг.
Задача 63.
Определить объем, занимаемый 0,07кг N2 при 21°С и давлении 142 кПа (106 мм рт. ст.).
Решение:
Зная мольный объём и мольную массу азота (28г/моль), находим объём, который будет занимать 0,07кг (70г) азота при нормальных условиях:

Затем приведём полученный объём к температуре Т = 21оС (294К) и Р = 142кПа, используя выражение, объединяющее законы Гей-Люссака и Бойля-Мариотта:

где P и V – давление и объём газа при температуре T; P0 (101,325кПа) и V0 – давление и объём газа при нормальных условиях; (273 К) – абсолютная температура. Преобразуя уравнение, получим выражение для расчета объёма газа при заданной температуре

Ответ: 43л.
Задача 64.
Бертолетова соль при нагревании разлагается с образованием КСI и О2. Сколько литров кислорода при 0 °С и давлении 101,3 кПа можно получить из 1 моля КСIО3?
Решение:
Уравнение реакции термического разложения бертолетовой соли имеет вид:

Из уравнения реакции следует, что из двух молей бертолетовой соли образуется три моля кислорода, т.е. из одного моля соли образуется полтора моля кислорода (2:3 = 1:х; x = 1.3/2 = 1,5моль).
Объём кислорода при нормальных условиях (T0 =0 °С и P0 =101.325кПа) можно рассчитать по формуле:

V(B) – объём газа, л;
 (B) – количество газа, моль;
(B) – количество газа, моль;
V(M) – мольный объём, 22,4л.
Тогда
V(кислорода) = 1,5 . 22,4 = 33,6л.
Ответ: 33,6л.
Задача 65.
Сколько молей содержится в 1м3 любого газа при нормальных условиях?
Решение:
Зная, что один моль любого газа при нормальных условиях (Т0 =0 °С и Р0 =101.325 кПа) занимает 22,4л, рассчитаем количество молей газа в 1м3 (1000 л) из пропорции:

Ответ: 44,64моль.
Задача 66.
Чему равно атмосферное давление на вершине Казбека, если при 0 °С масса 1л взятого там воздуха равна 700 мг?
Решение:
Мольная масса воздуха равна 29 г/моль. Нормальными условиями для газов являются температура 0 °С и давление 101,325 кПа (760 мм рт ст.). Масса одного литра воздуха при нормальных условиях равна 1296,64 мг:

Теперь рассчитаем атмосферное давление на вершине Казбека из пропорции:

Ответ: 54,7к Па (410,3 мм рт. ст.).
Задача 67.
При взаимодействии одного объема СО и одного объема Сl2 образуется один объем фосгена. Установить формулу фосгена.
Решение:
По условию задачи выходит, что из молекулы угарного газа и одной молекулы хлора образуется одна молекула фосгена. Так как молекула угарного газа СО состоит из одного атома углерода и одного атома кислорода, а молекула хлора Cl2 состоит из двух атомов хлора, то, следовательно, молекула фосгена будет состоять из одного атома углерода, одного атома кислорода и двух атомов хлора. Тогда формула фосгена будет иметь вид: CCl2O.
Уравнение реакции будет иметь вид:
СО + Cl2 → ССl2O.
Ответ: ССl2O.
Задача 68.
Какой объем СО2 получается при сгорании 2л бутана? Объемы обоих газов измерены при одинаковых условиях.
Решение:
Уравнение реакции горения бутана имеет вид:
2С4Н10 + 13О2 = 8СО2 + 10Н2О
Из уравнения реакции следует, что при сгорании одного моля бутана образуется четыре моля углекислого газа. Известно, что при одинаковых условиях одинаковое количество газов занимают одинаковый объём. Один моль любого газа при нормальных условиях занимает объём в 22,4 л.
Исходя, из этих утверждений рассчитаем объём выделившегося углекислого газа при сгорании 2 л бутана, составив пропорцию:

Ответ: 8л.
Задача 69.
В замкнутом сосуде при 120°С и давлении 600 кПа находится смесь, состоящая из трех объемов О2 и одного объема СН4. Каково будет давление в сосуде, если взорвать смесь и привести содержимое сосуда к первоначальной температуре?
Решение:
Уравнение реакции имеет вид:
CH4 + 2O2 → CO2 + 2H2O
Из уравнения реакции следует, что из одной молекулы метана и двух молекул кислорода образуются одна молекула углекислого газа и две молекулы воды, т. е. реакция протекает без изменения объёма. Начальный объём системы состоял из одного объёма метана и трёх объёмов кислорода, после реакции в системе остался один объём не прореагировавшего кислорода и три объёма продуктов реакции (один объём метана и два объёма паров воды). Поскольку реакция протекает без изменения объёма, а по окончании реакции содержимое сосуда приводится к первоначальной температуре, а общее число молекул газов не изменилось, то давление в системе останется прежним, т. е. 600 кПа.
Ответ: не изменится.
Задача 70. После взрыва 0,020 л смеси водорода с кислородом осталось 0,0032 л кислорода. Выразить в процентах по объему первоначальный состав смеси.
Решение:
Находим объём газов, вступивших в реакцию:
0,020 – 0,0032 = 0,0168 л.
Уравнение реакции горения водорода имеет вид:
2Н2 + О2 = 2Н2О
При взаимодействии водорода с кислородом из двух молекул водорода и одной молекулы кислорода получаются две молекулы воды, следовательно, из трёх молекул образовавшихся газов одна молекула будет принадлежать кислороду. Таким образом, объём кислорода, вступившего в реакцию, будет составлять одну треть объёма смеси газов – продуктов реакции. Отсюда количество кислорода, вступившего в реакцию, составляет 0,00565 л (0 0168/3 = 0,0056).
Следовательно, общее количество кислорода до реакции составляло 0,0088л (0,0056 + 0,0032 = 0,0088).
Тогда содержимое водорода до реакции составляло 0,0112л (0,02 – 0,0088 = 0.0112).
Рассчитаем в процентах первоначальный состав газовой смеси:

Ответ: 56%Н2; 44%О2.
Источник

IV. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
7.ЗАКОНЫ ИДЕАЛЬНЫХ ГАЗОВ.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
Основные формулы
1. Количество вещества
ν m , или ν N ,
NA
где N – число структурных элементов системы (молекул, атомов, ионов и т. д.); NA – постоянная Авогадро; – молекулярная масса.
2. Уравнение состояния идеальных газов (уравнение Менделеева– Клапейрона)
pV m RT ,
где т – масса газа; – молярная масса газа; R – универсальная газовая постоянная; Т – термодинамическая температура.
3. Закон Дальтона
p p1 p2 … pn,
где р – давление смеси газов; рi – парциальное давление i-го компонента смеси;
п – число компонентов смеси. 4. Молярная масса смеси газов
cм m1 m2 … mn . ν1 ν2 … νn
5. Концентрация частиц (молекул, атомов и т.п.) однородной системы
n N V NA
V NA  .
.
где V – объем системы; – плотность вещества.
6. В МКТ пользуются физической (идеализированной) моделью, называемой идеальным газом, согласно которой:
а) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда.
б) пренебрегают силами взаимодействия между молекулами. Следовательно, потенциальная энергия взаимодействия молекул принимается равной нулю, а внутренняя энергия идеально газа – равной средней кинетической энергии молекул.
в) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
68

Заметим, что понятие идеального газа не применимо при очень низких температурах (близких к температуре конденсации данного газа) и при очень высоких давлениях.
Макропараметры газа р, V, T.
Основное уравнение МКТ идеального газа – уравнение, которое связывает макропараметры идеального газа с микропараметрами:
р | 1 | nm V 2 , | (3.1) | ||||||||||||||||||||||||||||||||
3 | ср | ||||||||||||||||||||||||||||||||||
где р – давление газа; m0 – масса молекулы газа m0 | ; n – число моле- | ||||||||||||||||||||||||||||||||||
кул газа в единице объема; Vср2 | NA | ||||||||||||||||||||||||||||||||||
– среднеквадратичная скорость молекул. | |||||||||||||||||||||||||||||||||||
р | 1 | nm V 2 | 2 | nm | Vср2 | 2 | n E | , | (3.2) | ||||||||||||||||||||||||||
2 | |||||||||||||||||||||||||||||||||||
3 | 0 ср | 3 | 3 | кин | |||||||||||||||||||||||||||||||
где Eкин | – средняя кинетическая энергия поступательного движения моле- | ||||||||||||||||||||||||||||||||||
кулы. | 3 | ||||||||||||||||||||||||||||||||||
Eкин | kT, | (3.3) | |||||||||||||||||||||||||||||||||
R | 2 | ||||||||||||||||||||||||||||||||||
где k | – постоянная Больцмана (k = 1,38 · 10–23 Дж/К). | ||||||||||||||||||||||||||||||||||
NA | |||||||||||||||||||||||||||||||||||
Основное управление МКТ можно записать в виде | |||||||||||||||||||||||||||||||||||
р nkT. | (3.4) | ||||||||||||||||||||||||||||||||||
Из уравнения (3.3) следует, что кинетическая энергия не зависит от ро- | |||||||||||||||||||||||||||||||||||
да вещества, а зависит только от температуры. | |||||||||||||||||||||||||||||||||||
7. Скорость молекул: средняя квадратичная | |||||||||||||||||||||||||||||||||||
vкв | , | или | vкв | ; | |||||||||||||||||||||||||||||||
3kT m1 | 3RT | ||||||||||||||||||||||||||||||||||
средняя арифметическая | |||||||||||||||||||||||||||||||||||
v | , | или | v | ; | |||||||||||||||||||||||||||||||
8kT m1 | 8RT | ||||||||||||||||||||||||||||||||||
наиболее вероятная | |||||||||||||||||||||||||||||||||||
v | , | или | v | 2RT | , | ||||||||||||||||||||||||||||||
в | 2kT m | в | |||||||||||||||||||||||||||||||||
1 | |||||||||||||||||||||||||||||||||||
где т1 – масса одной молекулы. | |||||||||||||||||||||||||||||||||||
69
Примеры решения задач
Задача 1. Сколько молекул содержится в 1 м3 водорода при нормальных условиях? Какова масса одной молекулы водорода?
Д а н о:
V = 1 м3
T = 273 ºК р = 1·105 Па
= 2·10–3 кг/моль
п0 = ? т = ?
Р е ш е н и е
Число молекул в одном моле любого газа (число Авогадро) NА = 6,02·1023 1/моль. Объем одного моля любого газа (в том числе и водорода) при нормальных условиях V0 = 22, 4 л/моль = 22,4·10–3 м3/моль.
Следовательно, число молекул водорода, содержащихся в 1 м3 при нормальных условиях, определяется соотношением
n0 NA 2,69 1025 1/моль.
V0
Эта величина одинакова для любого газа и называется числом Лошмидта. Масса одной молекулы водорода
NA
Задача 2. Моль одноатомного идеального газа участвует в процессе 1–2–3, представленном на p–V диаграмме.
Всостоянии 1 температура газа равна Т1 =
=100 ºК, а в состоянии 2 – Т2 = 400 ºК. Определите температуру газа Т3 в точке 3.
Т1 | Дано: | Решение |
= 100 ºК | ||
Т2 | = 400 ºК | V1 p1; |
Т3 = ? | ||
V2 p2. | ||
Запишем уравнение Менделеева–Клапейрона для состояний газа 1 и2:
pV RT ; | p2 RT ; | |||||
1 | 1 | 1 | 1 | 1 | ||
p2 RT | p2 | T | ||||
p V RT , | или | 1 | 1 | . | ||
p2 | ||||||
2 2 | 2 | 2 | 2 | T | ||
2 | 2 | |||||
70 | ||||||
Для изохорического процесса (2–3) можно записать:
p1 | T3 | ; | T1 | T3 | , следовательно, | ||
p2 | T2 | T2 | T2 | ||||
T3 
 T1 T2 200К.
T1 T2 200К.
Задача 3. Температур поверхностного слоя Солнца (фотосферы) – около 6000 ºК. Почему с поверхности Солнца не улетают атомы водорода, из которых в основном состоит фотосфера?
Р е ш е н и е
Средняя квадратичная скорость атомов водорода в фотосфере
Вторая космическая скорость
Как видно, средняя квадратичная скорость в 51 раз меньше второй космической скорости, поэтому большинство атомов водорода не могут вырваться из поля тяготения Солнца.
Задача 4. Определить плотность смеси 4 г водорода и 32 г кислорода при температуре 7 ºС и давлении 700 мм рт.ст.
Д а н о:
m1 = 4 г = 0,004 кг1 = 2·10–3 кг/моль m2 = 32 г = 0,032 кг
2 = 32·10–3 кг/моль T = 280 0К
рсм = 700 мм рт.ст. = = 700·133 = 9,31·104 Па
см = ?
отсюда
Р е ш е н и е
Чтобы найти плотность смеси, необходимо знать ее массу и объем, тогда
cм mсм ; mсм m1 m2 .
V
Объем смеси можно найти, используя уравнение Менделеева–Клапейрона:
p | см | p p | 2 | ; p V | m1 | RT; | p V | m2 | RT ; | |||||||
1 | 1 | 1 | 2 | 2 | ||||||||||||
m | m | 2 | RT | |||||||||||||
pсм | 1 | , | ||||||||||||||
V | ||||||||||||||||
2 | ||||||||||||||||
1 | ||||||||||||||||
71

m | m | ||||||||||
1 | 2 | ||||||||||
1 | 2 | RT | |||||||||
V | , | ||||||||||
и тогда | pсм | ||||||||||
4 10 3 | 32 10 3 9,31 104 | ||||||||||
m1 | m2 pсм | 3 | |||||||||
см | 0,48 кг/м . | ||||||||||
m | m | 2 | 4 10 | 3 | 32 10 | 3 | |||||
1 | RT | 8,31 280 | |||||||||
3 | 3 | ||||||||||
1 | 2 10 | 32 10 | |||||||||
2 | |||||||||||
Задача 5. На осях р-V изображены графически процессы, с помощью которых идеальный газ был переведен из состояния 1 в состояние 4. Начертить, как будут выглядеть эти же процессы 1-2, 2-3 и
3-4 на осях р-Т и V-Т, если 1-2 – изотерма. Расшифруем, графики каких процессов пока-
заны на осях:
1-2 – изотермическое сжатие;
2-3 – изобарическое сжатие;
3-4 – изохорический процесс с понижением давления.
Вычертим графики этих же процессов на других осях.
72
Задачи
7-1. В баллоне объемом 22,4 л находится водород при нормальных условиях. После того как в баллон было дополнительно введено некоторое количество гелия, давление в баллоне возросло до р2 = 0,25 МПа, а температура не изменилась. Определить массу гелия, введенного в баллон.
7-2. Смесь водорода и азота общей массой т = 290 г при температуре Т = 600 ºК и давлении р = 2,46 МПа занимает объем V = 30 л. Определить массу т1 водорода и массу т2 азота.
7-3. Оболочка воздушного шара имеет объем V = 1 600 м3. Найти подъемную силу FП водорода, наполняющего оболочку, на высоте, где давление р = 60 кПа и температура Т = 280 ºК. При подъеме шара водород может выходить через отверстиев нижней части.
7-4. Водород находится при температуре Т = 300 ºК. Найти среднюю кинетическую энергию вращательного движения одной молекулы, а также суммарную кинетическую энергию всех молекул этого газа; количество вещества водорода = 0,5 моль.
7-5. В баллоне объемом 10 л находится гелий под давлением р1 = 1 МПа при температуре Т1 = 300 ºК. После того как из баллона было взято 10 г гелия, температура в баллоне понизилась до Т2 = 290 ºК. Определить давление р2 гелия, оставшегося в баллоне.
7-6. Баллон содержит т1 = 80 г кислорода и т2 = 320 г аргона. Давление смеси р = 1 МПа, температура 300 ºК. Принимая данные газа за идеальные, определить объем баллона.
7-7. Какой объем занимает смесь азота массой т1 = 1 кг и гелия массой т2 = 1 кг при нормальных условиях?
7-8. В баллоне емкостью 15 л находится смесь, содержащая т1 = 10 г водорода, т2 = 54 г водяного пара и т3 = 60 г окиси углерода. Температура смеси 27 ºС. Определить давление.
7-9. Количество вещества гелия = 1,5 моль, температура Т = 120 ºК. Определить суммарную кинетическую энергию поступательного движения всех молекул этого газа.
7-10. Теплоизолированный сосуд объемом V = 2 м3 разделен пористой перегородкой на две равные части. Атомы гелия могут свободно проникать через поры в перегородке, а атомы аргона – нет. В начальный момент в одной части сосуда находится m = 1 кг гелия, а в другой – m = 1 кг аргона, а средняя квадратичная скорость атомов аргона игелия одинакова и составляет1000 м/с.
Определить температуру гелий-аргоновой смеси после установления равновесия в системе.
7-11. Найти плотность газовой смеси водорода и кислорода, если их массовые доли 1 и 2 равны соответственно 1/9 и 8/9. Давление смеси равно 100 кПа, температура Т = 300 ºК.
7-12. В сосуде объемом 2,24 л при нормальных условиях находится кислород. Определить количество вещества и массу т кислорода, а также концентрацию п0 его молекул в сосуде.
73

7-13. В сосуде находится смесь 10 г углекислого газа (СО2) и 15 г азота (N2). Найти плотность этой смеси при температуре 27 0С и давлении 1,5·105 Па.
7-14. Сосуд объемом 20 л содержит смесь водорода и гелия при температуре t = 20 ºС и давлении 2 атм. Масса смеси т = 5 г. Найти отношение массы водорода к массе гелия в данной смеси.
7-15. В баллон емкостью V = 12 л поместили т1 = 1,5 кг азота при температуре t1 = 327 ºС. Какое давление р2 будет создавать азот в баллоне при температуре t2 = 50 ºС, если 35 % азота будет выпущено. Каково было начальное дав-
ление р1?
7-16. На дне сосуда, заполненного воздухом, лежит полыйстальной шарик радиусом r = 2 см. Масса шарика 5 г. До какого давления р надо сжать воздух в сосуде, чтобы шарик поднялся вверх? Считать, что воздух при больших давлениях подчиняется уравнению газового состояния. Температура воздуха t = 20 ºС = = const (сжатие воздуха происходитдостаточно медленно).
7-17. На какой глубине радиус пузырька воздуха вдвое меньше, чем у поверхности воды, если давление у поверхности равно р0?
7-18. Определить температуру газа, находящегося в закрытом баллоне, если его давление увеличилось на 0,4 % первоначально при нагревании на
T = 1 К.
7-19. Тонкостенный резиновый шар собственным весом 0,6 Н наполнен неоном и погружен в озеро на глубину h = 120 м. Найти массу неона, если шар находится в положении равновесия. Атмосферное давление р0 = 1,03·105 Па, температура на глубине озера t = + 4 ºС. Натяжением резины пренебречь.
7-20. В закрытом сосуде емкостью V = 2 м3 находится т1 = 2,7 кг воды и т2 = 3,2 кг кислорода. Найти давление в сосуде при температуре t = 527 ºС, зная, что в этих условиях вся вода превращается в пар (считать, что пар в данном случае подчиняется законам идеального газа).
7-21. В теплоизолированный сосуд объемом V = 2 л, содержащий одноатомный идеальный газ при температуре Т1 = 300 К, помещают кусочек железа массой m = 100 г, нагретый до температуры Т2 = 500 К. Определить давление р2 газа после установления теплового равновесия, если его начальное давление равно р1 = 105 Па. Объемом железа по сравнению с объемом сосуда пренебречь. Удельная теплоемкость железа с = 0,46 · 103 Дж/кг·К.
7-22. В идеальном газе происходят процессы 1-2; 2-3; 3-4. Изобразить эти процессы на координатных осях р–T, р–V.
7-23. В лифте, движущимся с ускорением а = 5 м/с2, направленным вверх, находится цилиндрический сосуд, закрытый поршнем массой М = 20 кг и площадью S = 100 см2. Под поршнем находится идеальный газ. Поршень расположен на расстоянии h = 22 см от дна сосуда. Определите, на
74

какую величину h переместится поршень, если лифт будет перемещаться с тем же по модулю ускорением, направленным вниз. Температура газа не изменяется, атмосферное давление p0 = 105 Па. Ускорение свободного падения поршня g = 10 м/с2. Трением поршня о стенки сосуда пренебречь.
7-24. В цилиндре под невесомым поршнем площадью S = 100 см2 находится 1 моль идеального газа при температуре t1 = 100 ºС. К поршню через два блока на невесомой нерастяжимой нити подвешен груз массой М = 17 кг. На какую высоту h поднимется груз, если охладить газ до температуры t2 = 0 ºС. Атмосферное давление p0 = 105 Па. Трением пренебречь.
7-25. В вертикально расположенном цилиндрическом сосуде находится идеальный газ массой m с молярной массой . Газ отделен от атмосферы поршнем, соединенным с дном сосуда с пружиной жесткости k. При температуре T1 поршень расположен на расстоянии h от дна сосуда. До какой температуры T2 надо нагреть газ, чтобы поршень поднялся до высоты H = 2h? Поршень считать невесомым. Атмосферное давление p0.
7-26. Два сосуда, содержащие одинаковые массы одного газа, соединены трубкой с краном. В первом сосуде давление р1 = 5·103 Па, во втором – р2 = 8·103 Па. Какое давление установится после открытия крана, если температура остается неизменной?
7-27. Найти отношение средних квадратичных скоростей молекул гелия и азота при одинаковых температурах.
7-28. Какое число молекул двухатомного газа содержится в сосуде объемом 20 см3 при давлении р = 1,06·104 Па и температуре t = 27 ºС? Какой энергией теплового движения обладают эти молекулы?
7-29. Над газом совершен цикл 1-2-3-4-1. Начертите график этого цикла на осях координат V, T; p, T; p, .
7-30. Газ, занимающий при температуре Т1 = 100 ºК и давлении р1 = 0,2 МПа объем V1 = 1 л, изотермически сжимают до объема V2 и давления р2, затем изобарно охлаждают до температуры Т3 = 50 ºК, после чего изотермически изменяют объем до V4 = 0,5 л. Найти конечное давление р4. Построить графики этих процессов в координатах р, V; р, Т.
75

8.ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ФИЗИКИ
Основные формулы
1. Распределение Больцмана (распределение частиц в силовом поле)
n n0e U kT ,
kT ,
где п – концентрация частиц; U – их потенциальная энергия; п0 – концентрация частиц в точках поля, где U = O; k – постоянная Больцмана; T – термодинамическая температура; е – основание натуральных логарифмов.
2. Барометрическая формула (распределение давления в однородном поле силы тяжести)
p p e mgh/ kT , или | p h e gh/ RT , |
где р – давление газа; т – масса частицы; – молярная масса; h – высота точки по отношению к уровню, принятому за нулевой; р0 – давление на этом уровне; g – ускорение свободного падения; R – универсальная газовая постоянная.
3. Вероятность того, что физическая величина х, характеризующая молекулу, лежит в интервале значений от х до х + dх, равна
dW x f x dx,
где f(х) – функция распределения молекул по значениям данной физической величины х (плотность вероятности).
4. Количество молекул, для которых физическая величина х, характеризующая их, заключена в интервале значений от х до х + dх,
dN NdW x N f x dx.
5. Распределение Максвелла (распределение молекул по скоростям) выражается двумя соотношениями:
а) число молекул, скорости которых заключены в пределах от vдо v + dv,
m | 3/2 | 2 | / 2kT v |
dN v N f v dv 4 N | e mv | 2dv, | |
2 kT | |||
где f (v) – функция распределения молекул по абсолютным значениям скоростей, выражающая отношение вероятности того, что скорость молекулы лежит в интервале от v до v + dv, к величине этого интервала, а также долю числа молекул, скорости которых лежат в указанном интервале; N – общее число молекул; т – масса молекулы;
б) число молекул, относительные скорости которых заключены в пределах от и до и + dи,
dN u N f u du | 4 | Ne u2 u2du, | |
76 | |||

где u v/vв – относительная скорость, равная отношению скорости v к наи-
вероятнейшей скорости vв; f(и) – функция распределения по относительным скоростям.
6. Среднее число соударений, испытываемых одной молекулой газа в единицу времени,
 z
z

 2 d2n
2 d2n v
v ,
,
где d – эффективный диаметр молекулы; п – концентрация молекул;  v
v –
–
средняя арифметическая скорость молекул.
7. Средняя длина свободного пробега молекул газа
8. Импульс (количество движения), переносимый молекулами из одного слоя газа в другой через элемент поверхности,
dp dv/dz S dt,
где – динамическая вязкость газа; dv/dz – градиент (поперечный) скорости течения его слоев; S – площадь элемента поверхности; dt – время переноса.
9. Динамическая вязкость
1 3
3  v
v
 l
l ,
,
где – плотность газа (жидкости);  v
v – средняя скорость хаотического дви-
– средняя скорость хаотического дви-
жения его молекул;  l
l – их средняя длина свободного пробега. 10. Закон Ньютона
– их средняя длина свободного пробега. 10. Закон Ньютона
F dp/dt dv/dz S,
где F – сила внутреннего трения между движущимися слоями газа. 11. Закон Фурье
Q K dT /dx S t,
где Q – теплота, прошедшая посредством теплопроводности через сечение площадью S – за время t; К – теплопроводность; dT/dx – градиент температуры.
12. Теплопроводность (коэффициент теплопроводности) газа
K 1 3cV v | l , или K 1 6kn v l , |
где сV – удельная теплоемкость газа при постоянном объеме; – плотность газа;  v
v – средняя арифметическая скорость его молекулы;
– средняя арифметическая скорость его молекулы;  l
l – средняя длина свободного пробега молекул.
– средняя длина свободного пробега молекул.
77
Источник
