Какое число молекул содержится в газообразном веществе

В сентябре, когда я начинаю работать с новыми учениками, всегда волнуюсь. Первые занятия – самые важные, поскольку происходит построение “призмы”, через которую я буду передавать знания и опыт, а ученик – воспринимать информацию и учиться работать с ней.
Я преподаю химию как точный предмет, в основе которого лежит строгая математическая логика. Я учу строить систему в любой поступающей информации, видеть главные узлы системы и связи между ними. Только так можно изучить такой сложный предмет, каким является химия. Ребята учатся грамотно учиться, затем свои знания и опыт работы они переносят в высшую школу, изучая более сложные медицинские предметы.
Не все проходит гладко. Накопление информации и опыта всегда индивидуально и связано с формированием сложной системы условных рефлексов. Но даже в самых тяжелых и запущенных случаях я не опускаю руки, использую современные технологии нейрофизиологии для ускорения процесса образования и повышения его качества.
Вспоминаю 2008 год. Это был последний год без ЕГЭ. Тяжелые задания на письменных вступительных экзаменах подразумевали серьезную подготовку, особенно по решению сложных задач. В тот год у меня были очень сильные ученики. Все как на подбор, быстро схватывали материал, набирались опыта и решали сложные задачи. И только Дима резко отставал от всех остальных. На занятиях он работал отлично, но как только покидал стены кабинета, весь изученный материал и накопленный опыт исчезали бесследно. На следующем занятии приходилось начинать все с начала. Так продолжалось несколько месяцев. Я понимала, что это не вина, а беда мальчика, а ключ к решению проблемы спрятан в индивидуальных особенностях физиологии высшей нервной деятельности. Пришлось обратиться за советом к своим бывшим ученикам, профессиональным нейрофизиологам. Как решилась проблема Димы и кем он стал теперь, я расскажу позже. А мы продолжим изучать химию. Тема сегодняшней статьи – количество вещества (моль).
Количество вещества (моль)
Количество вещества (моль) – важная расчетная величина в химии. Это именно тот золотой ключик, которым открывают любую, даже самую потайную дверь химической задачи. Термины “моль” и “молекула” – однокоренные, они произошли от латинского слова “moles”. В XVII в. появился термин “молекула” (“маленькая масса”). Понятие “моль” (“большая масса”, “порция”) появилось в начале XX века. Автор термина “моль” – немецкий химик и физик Вильгельм Оствальд.
Количество вещества определяется числом частиц, из которых состоит данное вещество (атомов, молекул, ионов), и обозначается греческой буквой “ню”. Для характеристики количества вещества в химии используют особую единицу измерения – моль.
Моль – это количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов), сколько атомов углерода содержится в 12 г изотопа углерода 12С. Экспериментально установлено, что один моль любого вещества содержит число Авогадро структурных единиц. В настоящее время известно более 60 независимых экспериментальных методов определения значения числа Авогадро.
Молярная масса – это масса 1 моля вещества, то есть отношение массы вещества к его количеству, выраженное в г/моль.
Абсолютная масса одной молекулы (атома) определяется делением молярной массы на число Авогадро
Итак, мы освоили первые математические формулы для химических расчетов. Попробуем закрепить наши знания и умение пользоваться этими формулами на решении простейших задач по химии.
Задача 1
Определите массу карбоната натрия и воды, которые содержатся в 0,8 моль кристаллической соды
Задача 2
Вычислите абсолютную массу одной молекулы углекислого газа в граммах
Задача 3
Образец вещества, массой 5,6 г содержит десятую часть числа Авогадро молекул. Определите молярную массу вещества
Задача 4
Эквимолярная смесь оксида фосфора (V) и диоксида кремния имеет массу 60,6 г. Определите массу оксида фосфора (V)
Вот мы и освоили первые, самые важные расчетные величины и поучились с ними работать. Но это еще не все. С количеством вещества можно вытворять такие замечательные трюки, которые вы даже представить не можете! Об этом скоро в следующих статьях.
А теперь о Диме и его проблеме с изучением химии. Тайна лежала в индивидуальных особенностях бета-тета активности головного мозга. Мои бывшие ученики, а теперь – ведущие нейрофизиологи МГУ работают с ритмами мозга. Они определили, что бета-тета ритмы мозга находится под влиянием гиппокампа, который играет ключевую роль в ускоренной переработке информации и активации долговременной памяти. Стимуляция бета-тета волновой активности способствует изучению иностранных языков, усвоению новых терминов, более быстрому и конструктивному получению фундаментальных знаний. Дима прошел курс БОС терапии по стимуляции мозговой активности в одной из лабораторий МГУ. Уже через месяц он не только достиг уровня своих товарищей, но и даже превзошел их. Как показали исследования, после трех часов решения задач по химии также происходил невероятный всплеск бета-тета волн, а через три месяца регулярных занятий формировался высокий уровень бета-тета потенциала! Дима блестяще сдал вступительные экзамены и в 2008 году поступил в РГМУ им. Н.И.Пирогова (РНИМУ им. Н.И. Пирогова). Сегодня Дима работает врачом-педиатром в одной из центральных клиник Москвы.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии https://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Источник
Ìîëü — êîëè÷åñòâî âåùåñòâà, ìàññà êîòîðîãî, âûðàæåííàÿ â ãðàììàõ, ÷èñëåííî ðàâíà îòíîñèòåëüíîé àòîìíîé (ìîëåêóëÿðíîé) ìàññå.
Ìîëü — åäèíèöà êîëè÷åñòâà âåùåñòâà â ÑÈ (îäíà èç îñíîâíûõ åäèíèö ÑÈ).
 1 ìîëå ñîäåðæèòñÿ ñòîëüêî ìîëåêóë (àòîìîâ èëè äðóãèõ ÷àñòèö âåùåñòâà), ñêîëüêî àòîìîâ ñîäåðæèòñÿ â 0,012 êã íóêëèäà óãëåðîäà 12Ñ ñ àòîìíîé ìàññîé 12.
Èç ýòîãî îïðåäåëåíèÿ ñëåäóåò, ÷òî â îäíîì ìîëå ëþáîãî âåùåñòâà ñîäåðæèòñÿ îäíî è òî æå ÷èñëî àòîìîâ èëè ìîëåêóë.
×èñëî ýòî íàçûâàåòñÿ ïîñòîÿííîé Àâîãàäðî è îáîçíà÷àåòñÿ NA:
NA = 6,022054(32) · 1023 ìîëü–1.
Ïîñòîÿííàÿ Àâîãàäðî (÷èñëî Àâîãàäðî) — ýòî ÷èñëî àòîìîâ (ìîëåêóë, èëè äðóãèõ ñòðóêòóðíûõ ýëåìåíòîâ âåùåñòâà), ñîäåðæàùèõñÿ â 1 ìîëå.
Ïîñòîÿííàÿ Àâîãàäðî — îäíà èç ôóíäàìåíòàëüíûõ ôèçè÷åñêèõ êîíñòàíò. Îíà âõîäèò â íåêîòîðûå äðóãèå ïîñòîÿííûå, íàïðèìåð, â ïîñòîÿííóþ Áîëüöìàíà.
Êîëè÷åñòâî âåùåñòâà.
Êîëè÷åñòâî âåùåñòâà — ýòî ÷èñëî ÷àñòèö âåùåñòâà (àòîìîâ, ìîëåêóë), âûðàæåííîå â ìîëÿõ. Ó÷èòûâàÿ îïðåäåëåíèå ìîëÿ è ÷èñëà Àâîãàäðî, ìîæíî ñêàçàòü, ÷òî êîëè÷åñòâî âåùåñòâà v ðàâíî îòíîøåíèþ ÷èñëà ìîëåêóë N â äàííîì òåëå ê ïîñòîÿííîé Àâîãàäðî NA, ò.å. ê ÷èñëó ìîëåêóë â 1 ìîëå âåùåñòâà:
.
Êàëüêóëÿòîðû ïî ôèçèêå | |
| Ðåøåíèå çàäà÷ ïî ôèçèêå, ïîäãîòîâêà ê ÝÃÅ è ÃÈÀ, ìåõàíèêà òåðìîäèíàìèêà è äð. | |
| Êàëüêóëÿòîðû ïî ôèçèêå | |
Âåùåñòâî. Õàðàêòåðèñòèêè âåùåñòâ. | |
| Ìàãíèòíûå, ôèçè÷åñêèå, õèìè÷åñêèå ñâîéñòâà æèäêèõ, òâåðäûõ, ãàçîîáðàçíûõ âåùåñòâ, ñòðîåíèå âåùåñòâ | |
| Âåùåñòâî. Õàðàêòåðèñòèêè âåùåñòâ. | |
Ìîëåêóëÿðíàÿ ôèçèêà | |
| Êèïåíèå, èñïàðåíèå, êîíäåíñàöèÿ, ïëàâëåíèå, êðèñòàëèçàöèÿ æèäêîñòè, âëàæíîñòü, àòîìíàÿ ìàññà, îñíîâû ìîëåêóëÿðíî-êèíåòè÷åñêîé òåîðèè | |
| Ìîëåêóëÿðíàÿ ôèçèêà | |
Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó ôèçèêè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Источник
Урок посвящен изучению закона Авогадро, который применятся только для газообразных веществ и позволяет сравнивать число молекул в порциях газообразных веществ. Вы узнаете, как на основании данного закона можно сделать вывод о составе молекул газа, познакомитесь с моделями молекул некоторых веществ.
I. Особенности строения веществ в различных агрегатных состояниях
В твердых телах, по сравнению с жидкостями и тем более газами, частицы вещества находятся в тесной взаимосвязи, на небольших расстояниях. В газообразных же веществах расстояния между молекулами настолько велики, что практически исключает взаимодействие между ними.
При отсутствии взаимодействия между молекулами их индивидуальность не проявляется. Значит, можно считать, что между молекулами в любых газах расстояния одинаковые. Но при условии, что эти газы находятся в одинаковых условиях – при одинаковых давлении и температуре.
II. Предположение Авогадро
Раз расстояния между молекулами газов равны, значит, равные объемы газов содержат равное число молекул. Такое предположение высказал в 1811 г. итальянский ученыйАмедео Авогадро.Впоследствии его предположение было доказано и названо законом Авогадро.
III. Модели молекул некоторых газообразных веществ
Свою гипотезу Авогадро использовал для объяснения результатов опытов с газообразными веществами. В процессе рассуждений он смог сделать важные выводы о составе молекул некоторых веществ.
Рассмотрим результаты экспериментов, на основании которых Авогадро смог смоделировать молекулы некоторых веществ.
Вы уже знаете, что при пропускании через воду электрического тока, вода разлагается на два газообразных вещества – водород и кислород.
Опыт по разложению воды проведем в электролизере. При пропускании электрического тока через воду на электродах начнут выделяться газы, которые вытеснят воду из пробирок. Газы получатся чистыми, потому что воздуха в пробирках, заполненных водой, нет. Причем объем выделившегося водорода будет в 2 раза больше, чем объем выделившегося кислорода.
Какой вывод сделал из этого Авогадро? Если объем водорода в два раза больше объема кислорода, значит, молекул водорода образовалось тоже в 2 раза больше. Следовательно, в молекуле воды на два атома водорода приходится один атом кислорода.
Рассмотрим результаты других опытов, которые позволяют сделать предположение о строении молекул веществ. Известно, что при разложении 2 л аммиака образуется 1 л азота и 3 л водорода (Рис. 2).
Отсюда можно сделать вывод, что в молекуле аммиака на один атом азота приходится три атома водорода. Но почему тогда для реакции потребовалось не 1л аммиака, а 2л?
Если воспользоваться моделями молекул водорода и аммиака, которые предложил Д. Дальтон, то получил результат, противоречащий эксперименту, т.к. из 1 атома азота и трех атомов водорода получится только 1 молекула аммиака. Таким образом, по закону Авогадро объем разложившегося аммиака в этом случае будет равен 1 л.
Если же предположить, что каждая молекула водорода и азота состоит из двух атомов, то у модели не будет противоречия с экспериментальным результатом. В этом случае одна молекула азота и три молекулы водорода образуются из двух молекул аммиака.
Рассмотрим результаты еще одного опыта. Известно, что при взаимодействии 1 л кислорода с 2 л водорода образовалось 2 л паров воды (т.к. реакцию проводят при температуре больше 100 С). Какой вывод можно сделать о составе молекул кислорода, водорода и воды?Такое соотношение можно объяснить, если предположить, что молекулы водорода и кислорода состоят из двух атомов:
Из двух молекул водорода и 1 молекулы кислорода образуется 2 молекулы воды.
IV. Закон Авогадро и его следствия
В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается Vm
Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.):
Vm = 22,4 л/моль
н.у. – это
p = 1амт (101325 Па)
t = 0 ˚C (273 К)
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
υ = V / Vm = N / Na = m / M
M = ρVm
V. Решение задач
Задача №1 (образец)
Какой объем занимает 0,2 моль N2 при н.у.?
Дано: н.у. Vm = 22, 4 л/моль ν (N2) = 0,2 моль | Решение: ν (N2) = V(N2 ) / Vm , следовательно V (N2 ) = ν (N2) · Vm = 0,2 моль · 22,4 л / моль = 4,48 л Ответ: V (N2 ) = 4,48 л |
Найти: V – ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какой объем занимают 5 моль О2 при н.у.?
2. Какой объем занимают 2,5 моль Н2 при н.у.?
Задача №2 (образец)
Какое количество вещества содержит водород объемом 33,6 л при н.у.?
Дано: н.у. Vm = 22, 4 л/моль V (H2) = 33,6 л | Решение: ν (Н2) = V(N2 ) / Vm = 33,6 л / 22,4 л/моль = 1,5 моль Ответ: ν (Н2) = 1,5 моль |
Найти: ν – ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
2. Какое количество вещества содержит углекислый газ объемом 4,48 л при н.у.?
Задача №3 (образец)
Какой объем займут 56 г. газа СО при н.у.?
Дано: н.у. Vm = 22, 4 л/моль m (CO) = 56 г | Решение: ν (CO) = V(CO) / Vm , следовательно V (CO ) = ν (CO) · Vm Неизвестное количество вещества найдём по формуле: ν = m/M M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль ν (СО) = m/M = 56 г / 28 г/моль = 2 моль V (CO ) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л Ответ: V (CO ) = 44,8 л |
Найти: V – ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какой объем займут 8 г. газа О2 при н.у.?
2. Какой объем займут 64 г. газа SО2 при н.у.?
Задача №4 (образец)
В каком объеме содержится 3·1023 молекул водорода Н2 при н.у.?
Дано: н.у. Vm = 22, 4 л/моль N = 3·1023 молекул Na = 6,02 ·1023 моль-1 | Решение: ν (Н2) = V(Н2) / Vm , следовательно V (Н2 ) = ν (Н2) · Vm Неизвестное количество вещества найдём по формуле: ν = N / Na = 3·1023 / 6,02 ·1023 моль-1 = 0,48 моль V (Н2 ) = ν (Н2) · Vm = 0,48 моль · 22,4 л/моль = 10,752 л Ответ: V (Н2 ) = 10,752 л |
Найти: V – ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. В каком объеме содержится 12,04 ·1023 молекул углекислого газа – СО2 при н.у.?
2. В каком объеме содержится 3,01·1023 молекул кислорода – О2 при н.у.?
Решите задачи для закрепления:
1. Найдите массу (н.у.):
а) 6 л. О3;
б) 14 л. газа Н2S?
2. Какой объём водорода при н.у. образуется при взаимодействии 0,23 г натрия с водой?
3. Какова молярная масса газа, если 1 л. его имеет массу 3,17 г.? (Подсказка! m = ρ·V)
Источник
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?

Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.

Рис. 1. Закон Авогадро.
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
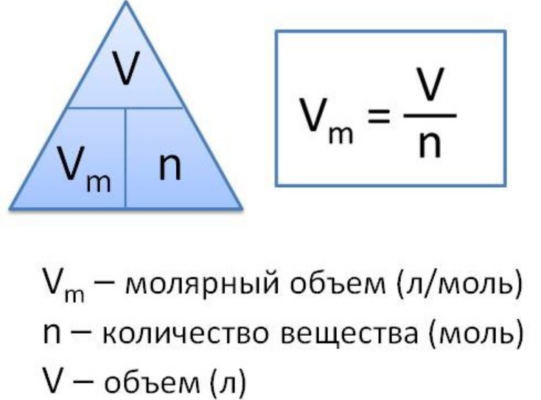
Рис. 2. Молярный объем формула.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.

Рис. 3. Молярный объем газа при нормальных условиях.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Настя Бабич
5/5
Александр Котков
5/5
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 242.
Источник
