Какое из органических веществ проявляет амфотерные свойства

Амфотерность – это очень важная тема школьного курса химии, которая очень часто бывает недопонята учениками старших классов. Если так происходит, в дальнейшем, это может привести к серьезным проблемам на уроках, так как в химии все новые темы базируются на предыдущих.
Сегодня, я хочу поговорить об амфотерности, наиболее простым и доступным языком. Надеюсь, что эта статья сможет стать полезна учащимся школ, проходящим эту тему, учителям при ее объяснение и всем, кто просто хочет разобраться в химии по каким либо причинам.
Начнем мы вот с чего. Есть такие версии Таблицы Менделеева, в которых химические элементы разделены по цветам. Например, периодическая система из школьных учебников по химии от автора О.С. Габриеляна выглядит так:
В ней, черным цветом обозначены знаки металлов, образующих основные оксиды и основания, красным – знаки неметаллов, зеленым – знаки металлов, обладающих амфотерными свойствами.
Теперь вспоминаем другое, когда мы проходили основания, мы должны были заметить, что их образует метал, которому соответствует основный оксид, например:
Na – Na2O – NaOH
K – K2O – KOH
Ca – CaO – Ca(OH)2
Все эти металлы, в периодической системе Д,И. Менделеева обозначены черным цветом.
Так же мы должны были заметить, что в основе кислот лежат неметаллы, которым соответствуют кислотные оксиды, например:
S – SO3 – H2SO4
N – N2O5 – HNO3
P – P2O5 – H3PO4
Cl – Cl2O7 – HCLO4
Все они обозначены в Таблице красным цветом.
Однако, у нас остаются еще и зеленые элементы, которые являются металлами, образующими амфотерные оксиды и гидроксиды. Что же это значит? Давайте начнем с определения амфотерных веществ.
Амфотерные вещества (от греч. Амфотеро – и тот, и другой) – это вещества, которые в зависимости от условий реакций проявляют основные или кислотные свойства.
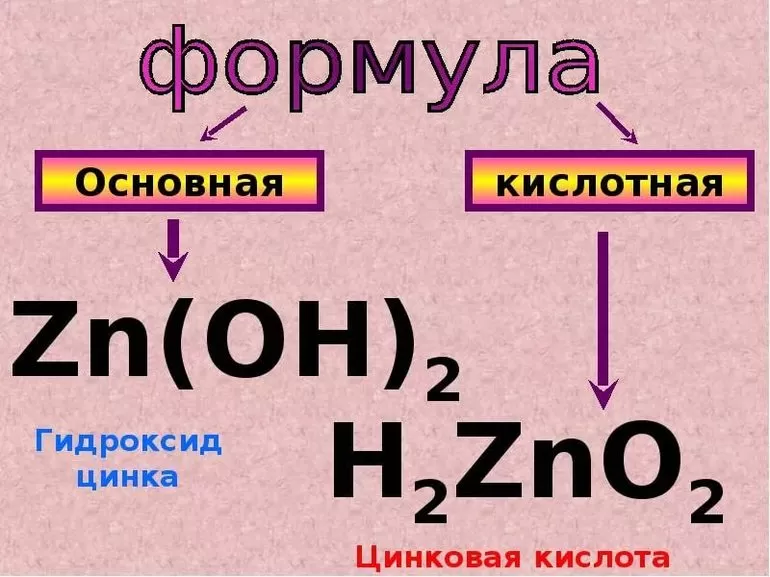
Чтобы это понять, в школах часто предлагают провести такой эксперимент (или подобный). Возьмем любую водорастворимую соль цинка и добавим в нее немного щелочи, в результате реакции образуется осадок:
ZnCl2 + NaOH = NaCl + Zn(OH)2 (осадок)
Помимо прочего, этот осадок амфотерный гидроксид и сейчас мы это докажем.
Отфильтруем осадок и поместим небольшое его количество в две пробирки. В пробирку №1 добавим несколько миллилитров раствора серной кислоты. При этом осадок растворится, значит реакция будет идти:
Zn(OH)2 + H2SO4 (p-p) = ZnSO4 + 2H2O
В пробирку №2 с высушенным гидроксидом цинка добавим кристаллический гидроксид натрия и нагреем смесь. При этом мы будем наблюдать протекание химической реакции, которая записывается согласно следующей схеме:
Zn(OH)2 + 2NaOH =(сплавление)= Na2ZnO2(цинкат натрия) + H2O
При этом гидроксид цинка проявил свои кислотные свойства, поэтому реакция прошла так. Для простоты написания реакций мы даже можем представить амфотерные гидроксиды в их кислотной форме, например:
Zn(OH)2 – H2ZnO2
H2ZnO2 + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Кстати оксид цинка в точно таких же условиях, поведет себя как кислотный оксид:
ZnO + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Так же точно, дело будет обстоять и с другими амфотерными гидроксидами, например гидроксид алюминия можно представить в форме двух кислот:
Реакция гидроксида алюминия с кислотой будет протекать стандартно:
Al(OH)3 + 3HCL = AlCl3 + 3H20
Реакция гидроксида алюминия со щелочью, будет протекать по схеме:
Al(OH)3 + NaOH =(сплавление)= NaAlO2 + H2O
В данном случае берем остаток метаалюминиевой кислоты, так как очевидно, что при сплавление будет удаляться вода.
Стоит учесть, что в расплаве и растворе данные реакции будут протекать по разному.
Амфотерный гидроксид + Раствор щелочи = Комплексная соль
Al(OH)3 + NaOH → Na[Al(OH)4]
Реакция оксида алюминия и самого алюминия с раствором щелочи будет протекать по следующей схеме:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Точно такие же реакции будут давать другие амфотерные металы, их оксиды и гидроксиды с растворами щелочей, например цинк:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Все очень просто 🙂
Однако, не стоит забывать еще одно очень важное правило. Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Похожем образом дело обстоит и с другими элементами. Например, то же железо может проявлять степени окисления 2+, 3+ и 6+. Но зная правило, мы не растеряемся и отнесем гидроксид железа (II) к основаниям, а гидроксид железа (III) к амфотерным гидроксидам.
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Так как эти элементы могут проявляться в разных степенях окисления, их называют переходными элементами или переходными металлами.
Вот собственно и все.
До новых встреч, уважаемые читатели!
Источник

Это определение было введено при изучении общей теоретической химии в области ведущих и кислотных взаимодействий при наступлении определенных условий.
Отмечается влияние смены растворяющего вещества на дуальные характеристики.
Амфотерные свойства
В концепции электролитической диссоциации, когда происходит распадение проводящего вещества на отдельные ионы при сплавлении или растворении, субстанция реагирует по кислотному механизму или основным свойствам. В первом случае отщепляются частицы гидроксония, Н+, во втором варианте отделяются гидроксид-анионы, ОН-. Электролиты получают ионы одновременно из нейтральных молекул и атомов, процесс проходит под совместным действием кислотных и генеральных качеств вещества. В этом случае проводящие смеси имеют название амфолитов.
Гидроксиды элементов и их сцеплений из таблицы Менделеева, которые относятся к амфотерным соединениям:
- элементы головных подгрупп (алюминий, бериллий, сурьма, галлий, селен, мышьяк);
- участники дополнительных подвидов (вольфрам, цинк, молибден).
Чаще всего вещества проявляют одно из взаимодействий, которое изменяет характер при перемене условий. Например, происходят процессы ионизации азотной кислоты, при этом получаются нитрозильные анионы и нитрит-катионы, в качестве амфолита выступает вода.
Амфотерность рассматривается в виде способности проводящего вещества быть донором и акцептировать протоны в рамках протеолитической концепции Бренстеда и Лоури. В этом случае вода проявляет свойства самоионизации в форме обратимой передачи молекул между жидкостями, в результате появляется одинаковое число анионов и катионов.
Амфолитами являются субстанции с содержанием структурных включений органических молекул, которые передают свойственные характеристики разного характера.
Такие вещества представлены пептидами, белками и аминокислотами. Эти группы частично ионизируются при помещении в раствор.
Молекулы и частицы аминокислот имеют равновесные состояния:
- заряженная (цвиттер-ион);
- незаряженная форма.
В этих случаях вещество представлено кислотой (воспроизводят катионы) и протоны или работает по основному свойству и акцептирует катионы и протоны.
Характеристики гидроксидов
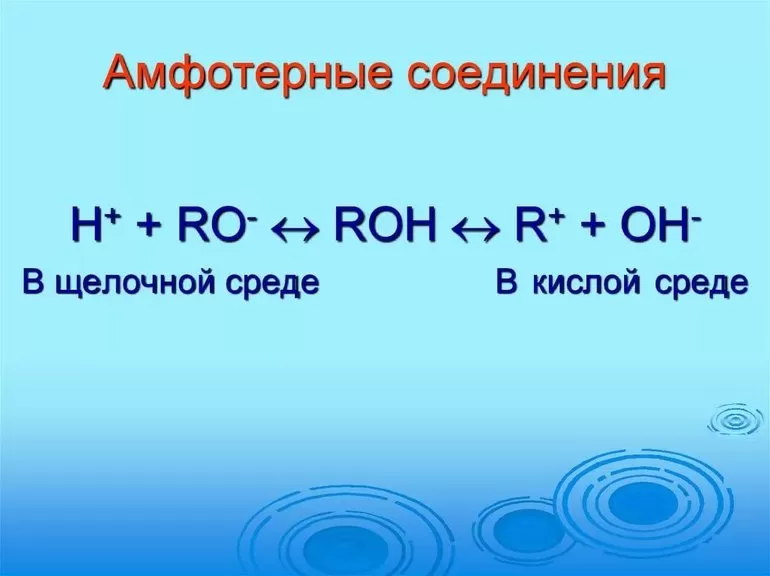
Способность амфотерного элемента проявляется и в форме взаимодействия с кислотами и основаниями.

Так ведут себя оксиды, комплексные соединения, гидроксиды и отдельные р-элементы на средней стадии окисления. Для неорганических связей с присутствием гидроксильной группы ОН такое взаимодействие является общей характеристикой.
Традиционная теория об амфотерности гидроксидов в процессе разложения на ионы по основному и кислотному виду не подтверждается. Амфотерное поведение гидроксидов заключается в реакции обмена частицами среды с молекулами, имеющими связь с акцепторным центром. Гидроксиды обладают особенностью выделять соль и по-разному взаимодействовать в кислотной среде и растворе щелочи.
В первом случае они действуют по типу оснований, а вторая среда заставляет проявлять реакцию кислот.
Амфотерность гидроксидов и оксидов проявляется в продуцировании 2 рядов солей. Двойственность свойств используется при проведении качественного анализа и отделения веществ с подобными характеристиками от других элементов. Интервал появления осадка проявляется узким промежутком, поэтому внимание уделяется тщательности регулировки растворной среды.
Номенклатура и химические особенности
На особом положении в ряду амфотерных элементов находится алюминий, он стоит на границе между кислотами и основаниями. Это ведет к его диссоциации по двум типам поведения.
Амфотерные металлы и неметаллы обладают свойствами:
- гидроксиды слабо растворяются в водной среде, поэтому не способствуют приобретению водой основных или кислотных характеристик;
- оксид-гидроксиды имеют особенности, типичные для электроположительных веществ;
- гидроксиды активных металлических групп чаще проявляют характеристики акцепторов элементарных частиц;
- по мере перехода к неметаллам свойства переходят от типичных оснований к амфотерным связкам, т. е. вещества выступают донорами протонов;
- в категории основных гидроксидов с положительными катионами существует ионная спайка, а кислород присоединяется к водороду с помощью ковалентной связи;
- в группе кислотных оксидов кислород имеет ковалентную связь с положительными электрочастицами, а с водородом соединяется полярной сцепкой ионов.
Гидроксиды с двойственными свойствами имеют физические промежуточные характеристики, доказать амфотерность можно на примере взаимодействия комплексных соединений из списка веществ 3 периода таблицы Менделеева.

В химии свойства однотипных сульфидов и оксидов, а также гидросульфитов и гидроксидов имеют разную реакцию в пределах отличающихся периодов. Свойство оснований проявляют сульфиды типичных металлов, а кислотные характеристики присутствуют в бинарных соединениях неметаллических субстанций. Различие химического происхождения наблюдается при обменной реакции между действующим веществом и растворителем, а также во взаимодействии сульфидов друг с другом.
Амфотерность гидроксидов металлических элементов объясняется тем, что в воде вещество распадается на отдельные ионы водорода по кислотному виду, а образование гидроксильных ионов проходит по типу основы.
Степени окисления
У некоторых веществ наблюдается несколько ступеней окисления, поэтому амфотерные свойства гидроксидов и оксидов подлежат разной классификации. Вещества с низкими окислительными характеристиками тяготеют к группе оснований, а сам элемент обладает свойствами металла, поскольку содержится в категории катионов. Субстанции с высокой степенью окисления являются участниками кислотных групп и проявляют неметаллические показатели, так как представляют собой анионы.
Например, у гидроксида и оксида марганца (2) главными являются основные свойства, а сам элемент входит в категорию катионов. У разновидности марганца (Vil) преобладают показатели кислоты, а само вещество относится к анионовой группы (тип МПО4).
Свойства оксидов и гидроксидов проявляются в зависимости от характеристики металла. Для элементов подвида бора (исключается таллий) типичной является 3-я степень перехода заряженных частиц от донора-восстановителя к окислительному акцептору. В результате свойства основания для элемента ослабляются.
При переходе к 3 группе встречаются вещества, которые образуют кислоты и неорганические кислоты. Последние обладают сочетанием химических и физических показателей, характерных для кислот и являются типовыми для многих элементов, за исключением щелочноземельных и щелочных металлов.

Рост свойств основного вещества происходит при увеличении радиуса движения ионов. Некоторые субстанции имеют почти одинаковую степень диссоциации с получением ионов, а у других аморфные показатели выражаются слабо.
В соединениях развитие основных свойств происходит медленно. Это объясняется тем, что атомы веществ 3 группы представляют собой аналоги с характерным строением внешней оболочки по типу благородных газов. Другие субстанции отличаются наружным слоем атома в форме электронной оболочки с 10 электронами. В таблице после алюминия наблюдается увеличение радиусов ионов, отмечается диагональное сходство, что ведет к постепенному усилению основных характеристик.
Процессы при диссоциации
В некоторых случаях амфотерные характеристики металлических гидроксидов проявляются не только в водной среде, но под действием кислотного и щелочного раствора. Если в случае с кислотой при продуцировании нейтральных частиц выделяется вода и появляется ион металла (свойство основания), то в щелочной среде не происходит отщепление протона.
При тяготении азота к висмуту степень окисления стабилизируется и усиливаются показатели основного характера. Такие соединительные субстанции выполняют одновременно окислительные и восстановительные функции. Двойственный процесс объясняется ионизацией молекулы воды, которая располагается во внутренней сфере, а протон перемещается к иону ОН.
В этом случае затрудняется определение развитости кислотных и основных показателей вещества, так как оно не имеет в составе подвижного водородного атома.
В результате из бокситов получаются другие элементы, что служит показателем использования химических характеристик при разделении. Метод основывается на применении свойства амфотерности алюминия. К этому же разряду относится выделение магния из воды морей и океанов.
Реакции взаимного действия с расплавами щелочей и кислотами ведут к появлению молекул воды и соли, а в результате степень окисления остается неизменной.
Двойственные показатели
Ионный потенциал вещества увеличивается в результате проявления двойственного механизма при диссоциации амфотерных соединений. Например, Мл (0Н) является неуравновешенным основанием, а Мп (0Н)4 представляет собой амфотерный элемент, который в равной степени проявляет кислотные особенности. НМПО4 переходит в категорию усиленных кислот, при этом снижаются свойства основания.

Щелочная среда используется для восстановления элементов с образованием гидросолей, например, гексагидроксоалюминат натрия. Если судить о тетрагидроксиде титана, то название подчеркивает возможность взаимной реакции с кислотами. Эта же субстанция гидроокиси называется ортокислотой при характеристике ее реагирования в условиях щелочной среды.
Активные металлические соединения образовывают сильнополярные ионные связи, поэтому относятся к группе оснований. Уменьшение динамичности характера вещества изменяется в сторону кислотного реагирования: НМпО, КОН, 5с (ОН)3, Са (ОН)2, НУО3 и другие.
Амфотерные оксиды М2О3 и соответствующие им гидроксиды М (ОН)3 (при этом исключается В2О3) плохо растворяются в водном растворе.
Гидроксиды характеризуются неравномерным изменением двойственных характеристик:
- А1 (0Н)3 имеет небольшое показание в области диссоциации, как основание, и представляет собой амфотерный проводящий электролит.
- Оа (0Н)3 является дуалистическим гидроксидом с неизменной константой распада, которая характеризует вещество в качестве основания и одновременно кислоты.
- Переход от Оа (0Н)3 к Т1 (0Н)3 происходит постепенно, также равномерно изменяется реакция в сторону кислотного взаимодействия в результате увеличения металлизации.
Другие вещества
Соединение гидроксида циркония является малорастворимым в воде и проявляет устойчивость к этой среде. Вещество относится к классу полимеров с положительно заряженными частицами, который содержит периодические цепи, расположенные в клеточном порядке. Материал не реагирует на основания, восстановительных и окислительных агентов.
В кислых растворах гидроксид циркония переводит анионы С1, НО3, СГО4, 8Ог на ионы ОН. Увеличение температурных показателей почти не сказывается на скорости обмена. В случае с цирконием не происходит образование определенных гидратов, термогравиметрические измерения показывают осадок полимерных частиц с образованием структурного слоя.
Германий находится ближе к группе металлов и образовывает связи, в которых его степень окисления расценивается по 2 категории. Соединения являются менее прочными, по сравнению с контактами германиевого аналога свинцовой группы, и отличаются восстановительными характеристиками. Амфотерный гидроксид с явно выраженными кислотными свойствами соответствует черному оксиду германия, молекулы которого не растворяются в жидкости. Последний носит название германистой кислоты, а его осадочные соли — германитов.
Если элемент в зависимости от условий образовывает несколько различающихся по составу оснований, то наиболее сильным признается то, которое отличается низкой окислительной степенью.
Качества основания в таких веществах выражаются ярко. Сильной является кислота, анионы которой содержат множество кислородных атомов в случае появления у элемента нескольких кислотосодержащих соединений.
Источник
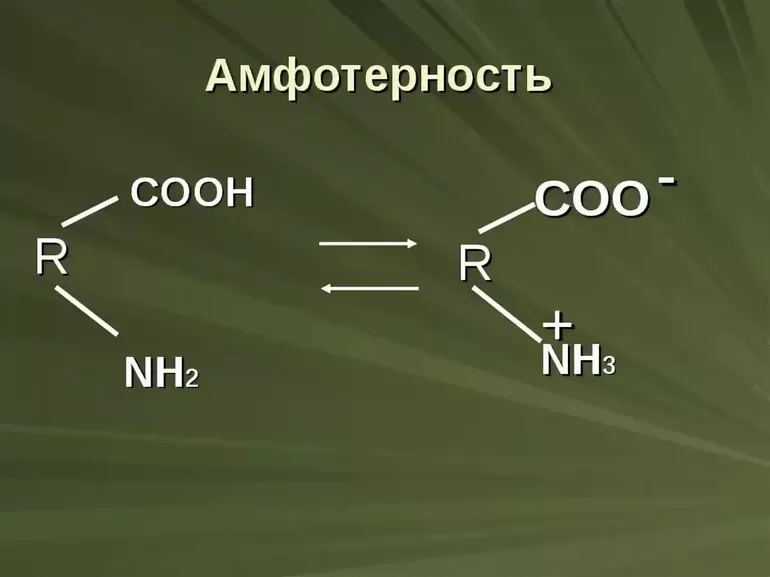
Тема урока: Амфотерные органические и неорганические соединения
Девиз урока: Ребенок – не кувшин, который надо наполнить, а лампада, которую надо зажечь.
Средневековые гуманисты
Цель:
развитие у учащихся представления об амфотерных соединениях;
создание условий для выявления амфотерности соединений посредством решения экспериментальных задач;
отработка умений в написании уравнений реакций с участием амфотерных соединений.
Задачи урока:
развивать учебно – познавательные компетенции учащихся – способность к самостоятельной познавательной деятельности, планирование, анализ, рефлексия, самооценка;
совершенствовать ценностно – смысловую компетенцию учащихся – продолжить формирование ценностного отношения к исследовательской деятельности как основному способу получения знаний в химии;
продолжить формирование коммуникативных компетенций учащихся – умение общаться в группе, высказывать своё мнение, докладывать аудитории;
способствовать развитию общеучебных компетенций учащихся – совершенствование интеллектуальных умений: умения устанавливать причинно- следственные связи, делать выводы.
Тип урока: урок – исследование
Методы обучения: частично-поисковый, исследовательский.
Формы организации познавательной деятельности: групповая, индивидуальная
Оборудование: хлорид алюминия AlCl3, гидроксид натрия NaOH, гидроксид калия, соляная кислота HCl, серная кислота, глицин, фарфоровая ступка, пестик, пипетки, стеклянная палочка, штатив с пробирками.
Предполагаемый результат: сформированное представление об амфотерности органических и неорганических соединений через установление взаимосвязи между строением и свойствами этих веществ.
Предварительная подготовка:профильная группа поделена на 2 малые группы по 3 человека, примерно равные по знаниям, умениям и навыкам.
ПЛАН УРОКА:
Организационный момент.
Целеполагание.
Сообщение учителем нового материала
Организация исследования (правила ТБ)
Эксперимент
Оформление результатов эксперимента (заполнение таблицы)
Обсуждение результатов и формулировка вопроса другим лабораториям.
Формулирование вывода по теме урока.
Подведение итогов урока.
Домашнее задание.
Средства обученияДанный урок проводится в кабинете химии, оснащенном мультимедийной техникой. На компьютере установлена авторская презентация « Амфотерные органические и неорганические соединения»; Карта исследования по теме «Амфотерные органические и неорганические соединения» на каждую группу по 2 штуки; папка по ТБ на каждую химическую «лабораторию»; распечатанные «роли» в каждой лаборатории и номера лабораторий, бэйджи для учащихся и учителя – 7 штук.
Внутрипредметные связи
Химия 10 кл. – в темах «Аминокислоты», Химия 9 кл «Основания», «Кислоты», «оксиды».
Межпредметные связи
Биология 10-11 кл.
«Органические вещества клетки», «Строение и функции белков»
ХОД УРОКА:
1. Организационный этап.
–Здравствуйте ребята!
Очень рада всех вас сегодня видеть.
2. Подготовительный этап.
В начале урока учитель ставит проблемный вопрос: можно ли варить щи в алюминиевой кастрюле, хранить в ней квашенную капусту и мыть алюминиевую посуду щелочными средствами, например, содой?
Примерный ответ учащихся:нет нельзя, так как алюминий образует на поверхности М плёнку из оксида алюминия, который является амфотерным соединением и поэтомуспособен взаимодействовать как с кислотами, так и с основаниями.
Учитель: При изучении амфотерных свойств соединений мы рассматриваем следующие вопросы: (Учитель знакомит с планом урока.)
План урока:
Амфотерные свойства оксидов и гидроксидов
Амфотерные свойства органических соединений
Учитель обращает внимание учащихся на оборудование на их столах, и поясняет, что они будут проводить исследовательскую работу и наблюдать за экспериментом.
Предлагает учащимся сформулировать цели данного урока (записываем на доске).
(Варианты целей: выяснение, что такое амфотерность; развитие умение писать уравнения с участием амфотерных соединений, применять полученные знания для решения задач.)
Вопросы для актуализации знаний:
С чем реагируют кислоты и щелочи?
С чем реагируют кислотные и основные оксиды?
Как доказать основный характер оксида, гидроксида?
Как доказать кислотный характер оксида, гидроксида?
3. Основной этап
Приступайте к выполнению своих исследований.
-Не забывайте о том, что по окончании работы вы ответите на поставленный вашей лаборатории вопрос и зададите его другой лаборатории. И это поможет нам сделать окончательное заключение. Пользуйтесь картой исследования, она Вам поможет определиться с тем, что вы будете делать.
– Ребята помните, что перед вами нет четкой инструкции по выполнению эксперимента, вы сами предлагаете решение этой проблемы и самостоятельно её решаете.
-Если будет нужна помощь, можете обращаться ко мне.
-Прошу лаборатории приступить к работе, хранители времени не забывайте о своих обязанностях, работаем в течении 20 минут.
– При выполнении вашего исследования соблюдайте правила ТБ.
– Инструкции по ТБ у Вас на столах, по мере надобности обращайтесь к ним.
Работу оформляем на картах исследования. Далее каждая лаборатория в, лице научного руководителя докладывает результаты исследования.
И мы вместе делаем окончательный вывод.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
Выполнение самостоятельного исследования:работа учащихся двумя лабораториями по 3 человека (в каждой лаборатории распределены роли: 1 лаборант, 1 зав лабораторией, 1 научный руководитель)
Учитель – консультант
– Уважаемые коллеги, исследователи прошу Вас ответить на поставленный вам вопрос, на основании которого мы и сделаем окончательный вывод.
Выдвижение гипотезы учащимися:Предполагаемая гипотеза:
Гидроксид алюминия и гидроксид цинка будут реагировать с кислотами как типичные основания, а также будут реагировать со щелочью как типичная кислота (с образованием комплексной соли).
Аминокислота глицин, как и все аминокислоты будет проявлять амфотерные свойства реагируя с кислотой по амино-группе и со щелочью по карбоксильной группе.
Подтверждение или опровержение гипотезы:
Учитель: Будет ли гидроксид алюминия амфотерным соединением? А гидроксид цинка? А как вы подтвердили амфотерный характер аминокислоты – глицин?
(Ответы учащихся).
Презентация результатов исследования: экспертное заключение лабораторий;
Формулирование вывода по работе:
Подведение итогов урока:Всем большое спасибо за работу, было приятно с вами работать. Работы сдайте, я их оценю и выставлю оценки за урок
Рефлексия.Составление синквейна
Домашнее задание:Параграф 22, упр №3 и №5стр302
КАРТА ИСССЛЕДОВАНИЯ
Лаборатория №2
План самостоятельной исследовательской работы учащихся
Цель исследования:доказать амфотерный характер гидроксида алюминия и аминокислоты -глицин.
Гипотеза:
1. Получите гидроксид алюминия исходя из тех веществ которые есть у вас на столах .
Химические свойства:
2.Проверьте известным вам способом, не проявляет ли гидроксид алюминия свойства основания.
3.Изучите, не проявляет ли гидроксид алюминия свойства характерные для кислот.
4.Исследуйте известным вам способом наличие в глицине карбоксильной и амино – группы.
Занесите полученные данные в таблицу:
Проведенный эксперимент
Наблюдения. Уравнения реакций.
1
2
3
4
5
ВЫВОД:
Ответьте на поставленный Вам вопрос и задайте его лаборатории №1
ВОПРОСЫ ДЛЯ ЛАБОРАТОРИЙ:
Лаборатория №2 Почему белки амфотерны? Какие химические реакции подтверждают двойственность их свойств?
КАРТА ИСССЛЕДОВАНИЯ
Лаборатория №1
План самостоятельной исследовательской работы учащихся
Цель исследования:доказать амфотерный характер гидроксида цинка и аминокислоты -глицин.
Гипотеза:
1. Получите гидроксид цинка исходя из тех веществ которые есть у вас на столах .
Химические свойства:
2.Проверьте известным вам способом, не проявляет ли гидроксид цинка свойства основания.
3.Изучите, не проявляет ли гидроксид цинка свойства характерные для кислот.
4.Исследуйте известным вам способом наличие в глицине карбоксильной и амино – группы.
Занесите полученные данные в таблицу:
Проведенный эксперимент
Наблюдения. Уравнения реакций.
1
2
3
4
5
ВЫВОД:
Ответьте на поставленный Вам вопрос и задайте его лаборатории №2
ВОПРОСЫ ДЛЯ ЛАБОРАТОРИЙ:
Лаборатория №1 Можно ли утверждать, что аминокислота обладает двойственными свойствами? Если да, то почему?
Экспертное заключение лаборатории №1
1. Исходя из нашего исследования, мы сделали следующие вывод по физическим свойствам :
Гидроксид цинка – это ……………………………вещество, …………………цвета, ………………………….в воде.
2. Изучив химические свойства гидроксида цинка, мы сделали следующее заключение:
3. Выполнив исследование, мы пришли к выводу, что глицин – аминокислота которая обладает не только свойствами ——————,но и свойствами ————–,
которые обеспечивают буферность живых систем образованных белками.
Итак, амфотерность это – ……………………………………….
Заключение составлено:
1. Заведующий лабораторией___________________________
2. Научный руководитель______________________________
3. Лаборант__________________________________________
Дата: 30.03.10. с.Боград
Экспертное заключение лаборатории №2
1. Исходя из нашего исследования, мы сделали следующие вывод по физическим свойствам :
Гидроксид алюминия – это ……………………………вещество, …………………цвета, ………………………….в воде.
2. Изучив химические свойства гидроксида алюминия, мы сделали следующее заключение:
3. Выполнив исследование, мы пришли к выводу, что глицин – аминокислота которая обладает не только свойствами ——————, но и свойствами ————–,которые обеспечивают буферность живых систем образованных белками.
Итак, амфотерность это – ……………………………………….
Заключение составлено:
1. Заведующий лабораторией___________________________
2. Научный руководитель______________________________
3. Лаборант__________________________________________
Дата: 30.03.10. с.Боград
ЛАБОРАТОРИЯ №1
ЛАБОРАТОРИЯ №2
Лаборант
Выполняет экспериментальную часть работы
Научный руководитель
Докладывает результаты исследования
Заведующий лабораторией
Следит за ходом выполнения по карте исследования, и записывает все результаты в таблицу
Лаборант
Выполняет экспериментальную часть работы
Научный руководитель
Докладывает результаты исследования
Заведующий лабораторией
Следит за ходом выполнения по карте исследования, и записывает все результаты в таблиц
Источник
