Какое из приведенных веществ проявляет амфотерные свойства

Амфотерность – это очень важная тема школьного курса химии, которая очень часто бывает недопонята учениками старших классов. Если так происходит, в дальнейшем, это может привести к серьезным проблемам на уроках, так как в химии все новые темы базируются на предыдущих.
Сегодня, я хочу поговорить об амфотерности, наиболее простым и доступным языком. Надеюсь, что эта статья сможет стать полезна учащимся школ, проходящим эту тему, учителям при ее объяснение и всем, кто просто хочет разобраться в химии по каким либо причинам.
Начнем мы вот с чего. Есть такие версии Таблицы Менделеева, в которых химические элементы разделены по цветам. Например, периодическая система из школьных учебников по химии от автора О.С. Габриеляна выглядит так:
В ней, черным цветом обозначены знаки металлов, образующих основные оксиды и основания, красным – знаки неметаллов, зеленым – знаки металлов, обладающих амфотерными свойствами.
Теперь вспоминаем другое, когда мы проходили основания, мы должны были заметить, что их образует метал, которому соответствует основный оксид, например:
Na – Na2O – NaOH
K – K2O – KOH
Ca – CaO – Ca(OH)2
Все эти металлы, в периодической системе Д,И. Менделеева обозначены черным цветом.
Так же мы должны были заметить, что в основе кислот лежат неметаллы, которым соответствуют кислотные оксиды, например:
S – SO3 – H2SO4
N – N2O5 – HNO3
P – P2O5 – H3PO4
Cl – Cl2O7 – HCLO4
Все они обозначены в Таблице красным цветом.
Однако, у нас остаются еще и зеленые элементы, которые являются металлами, образующими амфотерные оксиды и гидроксиды. Что же это значит? Давайте начнем с определения амфотерных веществ.
Амфотерные вещества (от греч. Амфотеро – и тот, и другой) – это вещества, которые в зависимости от условий реакций проявляют основные или кислотные свойства.
Чтобы это понять, в школах часто предлагают провести такой эксперимент (или подобный). Возьмем любую водорастворимую соль цинка и добавим в нее немного щелочи, в результате реакции образуется осадок:
ZnCl2 + NaOH = NaCl + Zn(OH)2 (осадок)
Помимо прочего, этот осадок амфотерный гидроксид и сейчас мы это докажем.
Отфильтруем осадок и поместим небольшое его количество в две пробирки. В пробирку №1 добавим несколько миллилитров раствора серной кислоты. При этом осадок растворится, значит реакция будет идти:
Zn(OH)2 + H2SO4 (p-p) = ZnSO4 + 2H2O
В пробирку №2 с высушенным гидроксидом цинка добавим кристаллический гидроксид натрия и нагреем смесь. При этом мы будем наблюдать протекание химической реакции, которая записывается согласно следующей схеме:
Zn(OH)2 + 2NaOH =(сплавление)= Na2ZnO2(цинкат натрия) + H2O
При этом гидроксид цинка проявил свои кислотные свойства, поэтому реакция прошла так. Для простоты написания реакций мы даже можем представить амфотерные гидроксиды в их кислотной форме, например:
Zn(OH)2 – H2ZnO2
H2ZnO2 + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Кстати оксид цинка в точно таких же условиях, поведет себя как кислотный оксид:
ZnO + 2NaOH =(сплавление)= Na2ZnO2 + H2O
Так же точно, дело будет обстоять и с другими амфотерными гидроксидами, например гидроксид алюминия можно представить в форме двух кислот:
Реакция гидроксида алюминия с кислотой будет протекать стандартно:
Al(OH)3 + 3HCL = AlCl3 + 3H20
Реакция гидроксида алюминия со щелочью, будет протекать по схеме:
Al(OH)3 + NaOH =(сплавление)= NaAlO2 + H2O
В данном случае берем остаток метаалюминиевой кислоты, так как очевидно, что при сплавление будет удаляться вода.
Стоит учесть, что в расплаве и растворе данные реакции будут протекать по разному.
Амфотерный гидроксид + Раствор щелочи = Комплексная соль
Al(OH)3 + NaOH → Na[Al(OH)4]
Реакция оксида алюминия и самого алюминия с раствором щелочи будет протекать по следующей схеме:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Точно такие же реакции будут давать другие амфотерные металы, их оксиды и гидроксиды с растворами щелочей, например цинк:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
Все очень просто 🙂
Однако, не стоит забывать еще одно очень важное правило. Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Похожем образом дело обстоит и с другими элементами. Например, то же железо может проявлять степени окисления 2+, 3+ и 6+. Но зная правило, мы не растеряемся и отнесем гидроксид железа (II) к основаниям, а гидроксид железа (III) к амфотерным гидроксидам.
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Так как эти элементы могут проявляться в разных степенях окисления, их называют переходными элементами или переходными металлами.
Вот собственно и все.
До новых встреч, уважаемые читатели!
Источник
- Главная
- Вопросы & Ответы
- Вопрос 10234094
более месяца назад
Просмотров : 5
Ответов : 1
Лучший ответ:

б
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время































Другие вопросы:
Прочитайте Назовите сказки пошел он к своей землянке землянки Нет уже и следа пушки с пристани палят кораблю пристать велят
более месяца назад
Смотреть ответ
Просмотров : 3
Ответов : 1
решить дробь 7.11/15-(3.9/10 1.1/30)
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Природные комплексы
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Прочитайте. 1. Девочки рисовали. 2. Дерево выросло. 3. Соловей поёт. 4. Плывут облака. •Какие изменения произойдут со
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Помогите пожалуста! Решите плиз задачу! Тема: Молярная концентрация!
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов :
Картинок: 1
Источник
Слайд 1
Описание слайда:
Амфотерные неорганические и органические соединения
МОУ «Гатчинская СОШ №2»
Учитель химии: Г.Г.Павлова
Учитель информатики: Д.П.Панасюк
Слайд 2![1. Верное утверждение о значении понятия «амфотерность»:
1) преобладание кислотных свойств вещества над основными;
2) проявление веществом как кислотных, так и основных свойств;
3) способность вещества диссоциировать с отщеплением как катиона водорода, так и гидроксид-аниона;
4) способность амфотерных веществ взаимодействовать друг с другом. Амфотерность - проявление веществом как кислотных, так и основных свойств:
Be(OH)2 + 2HCI → BeCI2 + 2H2O (основные свойства)
Be(OH)2 + 2NaOH → Na2[Be(OH)4] (кислотные свойства)
NH2 – CH2 – COOH + HCI → [NH3 – CH2 – COOH ]+CI- (основные свойства)
NH2 – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O (кислотные свойства)
Ответ: 2
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img1.jpg)
Описание слайда:
1. Верное утверждение о значении понятия «амфотерность»:
1) преобладание кислотных свойств вещества над основными;
2) проявление веществом как кислотных, так и основных свойств;
3) способность вещества диссоциировать с отщеплением как катиона водорода, так и гидроксид-аниона;
4) способность амфотерных веществ взаимодействовать друг с другом.
Амфотерность – проявление веществом как кислотных, так и основных свойств:
Be(OH)2 + 2HCI → BeCI2 + 2H2O (основные свойства)
Be(OH)2 + 2NaOH → Na2[Be(OH)4] (кислотные свойства)
NH2 – CH2 – COOH + HCI → [NH3 – CH2 – COOH ]+CI- (основные свойства)
NH2 – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O (кислотные свойства)
Ответ: 2
Слайд 3
Описание слайда:
2. Некоторый элемент образует три типа оксидов (основный, амфотерный и кислотный). Степень окисления элемента в амфотерном оксиде будет:
1) минимальной; 3) промежуточной между минимальной и максимальной;
2) максимальной; 4) нулевой.
Схема строения атома химического элемента хрома:
Cr +24 ) ) ) )
2 8 13 1
+2
СrO – основный оксид
+3
Сr2O3-2 – амфотерный оксид
+6
СrO3 – кислотный оксид
Ответ: 3
Слайд 4
Описание слайда:
3. В щелочном растворе аминоуксусная кислота существует в виде частиц:
1) H3N+ – CH2 – COOH; 3) H3N+ – CH2 – COO-;
2) H2N – CH2 – COO-; 4) H2N – CH2– COOH.
+ H+ OH-
NH3 – CH2 – COOH ↔ NH3 – CH2 – COOH ↔ NH3 – CH2 – COOH
Ответ: 2
Слайд 5
Описание слайда:
4. Какое из утверждений неверно?
1) Амфотерные оксиды взаимодействуют с растворами щелочей;
2) амфотерные гидроксиды реагируют с растворами сильных кислот;
3) органических амфотерных соединений не существует;
4) амфотерным оксидам соответствуют амфотерные гидроксиды.
Аминокислоты – амфотерные органические соединения. Карбоксильная группа (- СООН)
обуславливает кислотные свойства, аминогруппа (- NH2) – основные (см. вопрос 1).
Ответ: 3
Слайд 6
Описание слайда:
5. Лишняя формула:
1) H2ZnO2; 2) ZnCI2; 3) ZnO; 4) Zn(OH)2.
H2ZnO2 и Zn(OH)2 – соответственно кислотная и основная формы гидроксида цинка и
соответствующий гидроксиду цинка – оксид цинка ZnO, ZnCI2 – соль.
Ответ: 2
Слайд 7![6. К амфотерным гидроксидам не относят вещество, имеющее формулу:
1) Be(OH)2; 3) K2[Zn(OH)4];
2) Pb(OH)2; 4)Cu(OH)2. K2[Zn(OH)4] – тетрагидроксоцинкат калия – комплексная соль.
Ответ: 3
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img6.jpg)
Описание слайда:
6. К амфотерным гидроксидам не относят вещество, имеющее формулу:
1) Be(OH)2; 3) K2[Zn(OH)4];
2) Pb(OH)2; 4)Cu(OH)2.
K2[Zn(OH)4] – тетрагидроксоцинкат калия – комплексная соль.
Ответ: 3
Слайд 8![7. При добавлении избытка раствора гидроксида калия к раствору хлорида алюминия происходят следующие превращения:
1) вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием комплексной соли – тетрагидроксоалюмината калия;
2) образуется осадок гидроксида алюминия;
3) сначала видимых изменений не наблюдается, затем образуется осадок гидроксида алюминия;
4) вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием соли – метаалюмината калия. AICI3 + KOH → AI(OH)3↓ + 3HCI
гидроксид алюминия
AI3+ + 3OH- = AI(OH)3
AI(OH)3 + KOH → K[AI(OH)4]
гидроксоалюминат калия образуется при растворении осадка AI(OH)3 в растворе KOH
AI(OH)3 + OH- = [AI(OH)4]
Ответ: 1
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img7.jpg)
Описание слайда:
7. При добавлении избытка раствора гидроксида калия к раствору хлорида алюминия происходят следующие превращения:
1) вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием комплексной соли – тетрагидроксоалюмината калия;
2) образуется осадок гидроксида алюминия;
3) сначала видимых изменений не наблюдается, затем образуется осадок гидроксида алюминия;
4) вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием соли – метаалюмината калия.
AICI3 + KOH → AI(OH)3↓ + 3HCI
гидроксид алюминия
AI3+ + 3OH- = AI(OH)3
AI(OH)3 + KOH → K[AI(OH)4]
гидроксоалюминат калия образуется при растворении осадка AI(OH)3 в растворе KOH
AI(OH)3 + OH- = [AI(OH)4]
Ответ: 1
Слайд 9![8. При взаимодействии свежеприготовленного осадка амфотерного гидроксида с избытком щёлочи всегда образуется:
1) средняя соль; 3) двойная соль;
2) основная соль; 4) комплексная соль.
Be(OH)2 + 2NaOH → Na2[Be(OH)4] Ответ: 4
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img8.jpg)
Описание слайда:
8. При взаимодействии свежеприготовленного осадка амфотерного гидроксида с избытком щёлочи всегда образуется:
1) средняя соль; 3) двойная соль;
2) основная соль; 4) комплексная соль.
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Ответ: 4
Слайд 10![9. Свойство аминокислот, обусловленное наличием в их молекуле аминогруппы:
1) Образованием сложных эфиров; 3) взаимодействие со щелочами;
2) взаимодействие с неорганическими кислотами; 4) способность к отщеплению катиона водорода. NH2 – CH2 – COOH + HCI → [NH3 – CH2 – COOH]- CI-
Ответ: 2
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img9.jpg)
Описание слайда:
9. Свойство аминокислот, обусловленное наличием в их молекуле аминогруппы:
1) Образованием сложных эфиров; 3) взаимодействие со щелочами;
2) взаимодействие с неорганическими кислотами; 4) способность к отщеплению катиона водорода.
NH2 – CH2 – COOH + HCI → [NH3 – CH2 – COOH]- CI-
Ответ: 2
Слайд 11
Описание слайда:
10. Химическое свойство аминокислот, которое не обусловлено наличием в их молекуле карбоксильной группы:
1) Взаимодействие со спиртами; 3) взаимодействие со щелочами;
2) взаимодействие с неорганическими кислотами; 4) способность к отщеплению катиона водорода.
Ответ: 2
Слайд 12
Описание слайда:
11. Синтетические полиамидные волокна являются производными аминокислот со следующим расположением функциональных групп – аминогруппы – NH2 и карбоксильной группы – СООН:
1) непосредственно связанными друг с другом; 3) разделёнными несколькими атомами углерода;
2) находящимися у одного атома углерода; 4) расположенными на концах углеродной цепи.
O
ξ δ γ β α ||
NH2 – CH2 – CH2 – CH2 – CH2 – CH2 – C – OH → (- NH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CO – )n
ξ – аминокапроновая кислота
Ответ: 4
Слайд 13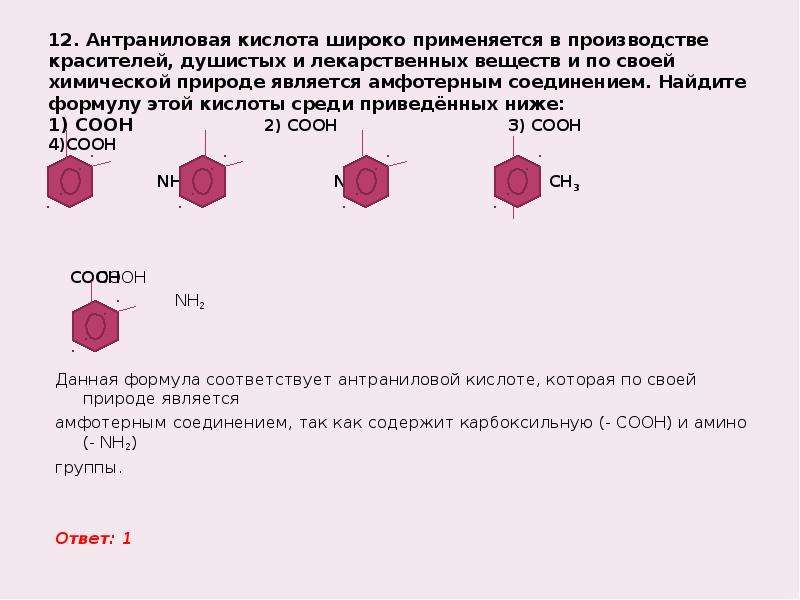
Описание слайда:
12. Антраниловая кислота широко применяется в производстве красителей, душистых и лекарственных веществ и по своей химической природе является амфотерным соединением. Найдите формулу этой кислоты среди приведённых ниже:
1) СООН 2) СООН 3) СООН 4)СООН
NH2 NO2 CH3
СООН
СООН
NH2
Данная формула соответствует антраниловой кислоте, которая по своей природе является
амфотерным соединением, так как содержит карбоксильную (- СООН) и амино (- NH2)
группы.
Ответ: 1
Слайд 14
Описание слайда:
13. Поликонденсация приводит к образованию полипептидов. Обратную реакцию называют:
1) деполиконденсация; 3) гидролиз;
2) деполимеризация; 4) гидратация.
n NH2 – CH – COOH → – NH – CH – CO – и nH2O
| |
R R
Реакция поликонденсации, обратная реакция – деполиконденсация.
Ответ: 1
Слайд 15
Описание слайда:
14. Молекула воды может являться как донором, так и акцептором протона, превращаясь при этом соответственно в ионы:
1) гидроксид-анион и катион гидроксония;
2) катион гидроксония и гидроксид-анион;
3) катион водорода и гидроксид-анион;
4) гидроксид-анион и катион водорода.
NH3 + H2O ↔ NH4+ + OH-
донор протона
HCI + H2O ↔ H3O+ + CI-
акцептор протона
Ответ: 1
Слайд 16![15. Ионное уравнение реакции [Zn(OH)4]2- + 2Н+ = Zn(OH)2 + 2Н2О соответствует взаимодействию между:
1) гидроксидом цинка и соляной кислотой;
2) тетрагидроксоцинкатом натрия и азотистой кислотой;
3) тетрагидроксоцинкатом калия и серной кислотой;
4) оксидом цинка и азотной кислотой. Zn(OH)2 + НСI→ ZnСI2 + 2H2O
Zn(OH)2 + Н+ → Zn2+ + 2H2O
Na[Zn(OH)4] + 2HNO2 → Zn(OH)2 + 2NaNO2 + 2H2O
слабый электролит
[Zn(OH)4]2- + 2HNO2 → Zn(OH)2 + 2NO2- + 2H2O
Na2[Zn(OH)4] + 2H2SO4 → Zn(OH)2 + 2Na2SO4 + 2H2O
[Zn(OH)4]2- + 2H+ → Zn(OH)2 + 2H2O
ZnO + 2HNO3 → Zn(OH3)2 + H2O
ZnO + + 2H+ → Zn2+ + 2H2O
Ответ: 3
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img15.jpg)
Описание слайда:
15. Ионное уравнение реакции [Zn(OH)4]2- + 2Н+ = Zn(OH)2 + 2Н2О соответствует взаимодействию между:
1) гидроксидом цинка и соляной кислотой;
2) тетрагидроксоцинкатом натрия и азотистой кислотой;
3) тетрагидроксоцинкатом калия и серной кислотой;
4) оксидом цинка и азотной кислотой.
Zn(OH)2 + НСI→ ZnСI2 + 2H2O
Zn(OH)2 + Н+ → Zn2+ + 2H2O
Na[Zn(OH)4] + 2HNO2 → Zn(OH)2 + 2NaNO2 + 2H2O
слабый электролит
[Zn(OH)4]2- + 2HNO2 → Zn(OH)2 + 2NO2- + 2H2O
Na2[Zn(OH)4] + 2H2SO4 → Zn(OH)2 + 2Na2SO4 + 2H2O
[Zn(OH)4]2- + 2H+ → Zn(OH)2 + 2H2O
ZnO + 2HNO3 → Zn(OH3)2 + H2O
ZnO + + 2H+ → Zn2+ + 2H2O
Ответ: 3
Слайд 17
Описание слайда:
16. При пропускании постоянного электрического тока через водный раствор (аланина) частицы растворённого вещества:
1) движутся к катоду; 3) движутся и к катоду, и к аноду;
2) движутся к аноду; 4) не движутся ни к катоду, ни к аноду.
+ –
NH2 – CH2 – COOH ↔ NH3 – CH2 – COO
В растворе аминоуксусной кислоты существует биполярный ион.
Ответ: 4
Слайд 18
Описание слайда:
17. Элемент, для которого справедливо утверждение: «С увеличением степени окисления элемента в оксиде его характер изменяется от основного через амфотерный к кислотному»:
1) Хлора; 2) серы; 3) хрома; 4) алюминия.
+2 +3 +6
СrO → Cr2O3 → CrO3
основный амфотерный кислотный
оксид оксид оксид
Ответ: 3
Слайд 19
Описание слайда:
18. Органическое вещество лизин имеет следующую формулу: H2N – СH2 – CH2 – CH2 – CH2 – CH – COOH.
|
NH2
Какое из утверждений верно?
1) Лизин не проявляет амфотерных свойств;
2) лизин проявляет амфотерные свойства с преобладанием основных;
3) лизин проявляет амфотерные свойства с преобладанием кислотных;
4) лизин не является аминокислотой.
Аминокислота лизин, содержит одну карбоксильную группу (кислотные свойства) и две
аминогруппы (основные свойства). Лизин проявляет амфотерные свойства с
преобладанием основных.
Ответ: 2
Слайд 20
Описание слайда:
19. В растворе с рН<7 α-аминопропионовая кислота существует в виде:
1) катиона; 3) биполярного иона;
2) аниона; 4) молекулы.
+
NH2 – CH2 – COOH + H+ ↔ NH3 – CH2 COOH
| |
CH3 CH3
Ответ: 1
Слайд 21![20. При взаимодействии 1 моль гидроксида алюминия с раствором, содержащим 1 моль серной кислоты, образуется:
1) кислая соль; 2) средняя соль; 3) основная соль; 4) комплексная соль. 2AI(OH)3 + H2SO4 → [AI(OH)2]2SO4 + 2H2O
2 моль 1 моль дигидроксосульфат алюминия
Ответ: 3
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img20.jpg)
Описание слайда:
20. При взаимодействии 1 моль гидроксида алюминия с раствором, содержащим 1 моль серной кислоты, образуется:
1) кислая соль; 2) средняя соль; 3) основная соль; 4) комплексная соль.
2AI(OH)3 + H2SO4 → [AI(OH)2]2SO4 + 2H2O
2 моль 1 моль дигидроксосульфат алюминия
Ответ: 3
Слайд 22![21. Минерал, не содержащий амфотерного оксида:
1) корунд; 3) сапфир;
2) рубин; 4) криолит. Криолит - 3NaF∙ AIF3 или Na3[AIF6].
Корунд, рубин, сапфир в качестве основного компонента содержат AI2O3.
Ответ: 4
Какое из приведенных веществ проявляет амфотерные свойства](https://mypresentation.ru/documents/54565b62ce0b97bbdcaf957456a81d28/img21.jpg)
Описание слайда:
21. Минерал, не содержащий амфотерного оксида:
1) корунд; 3) сапфир;
2) рубин; 4) криолит.
Криолит – 3NaF∙ AIF3 или Na3[AIF6].
Корунд, рубин, сапфир в качестве основного компонента содержат AI2O3.
Ответ: 4
Слайд 23
Описание слайда:
22. Амфотерные свойства проявляет вещество, формула которого:
1) H2N – (CH2)6 – NH2; 3) O2N – CH2 – COOH;
2) H2N – CH – COOH; 4) C6H5 – CH2 – NH2.
|
CH2 – C6H5
Вещество, формула которого H2N – CH – COOH, проявляет амфотерные свойства, так как в
|
CH2 – C6H5
его молекуле присутствует карбоксильная группа – СООН (к?
