Какое из веществ не проявляет кислотных свойств

- Главная
- Вопросы & Ответы
- Вопрос 1047027
Онтонио Веселко
более месяца назад
Просмотров : 40
Ответов : 1
Лучший ответ:
Пармезан Черница
1 вроде. Поратартрртрвлартаратуп
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт
Лучшее из галереи за : неделю месяц все время
Другие вопросы:
Зачетный Опарыш
Рассказать историю с Жилиным от лица татарской девочки Дины…(РАССКАЗ КАВКАЗКИЙ ПЛЕННИК)начать с меня зовут Дина я хочу рассказать свою историю……
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Зачетный Опарыш
(2x-1) : 5 Как раскрыть скобки?
более месяца назад
Смотреть ответ
Просмотров : 12
Ответов : 1
Энджелл
составте программу действий и найди значения выражения.71+(360-124)-298 и (193+307)-43-(435-87)
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Таня Масян
дан треугольник CAВ сторона AC=12СМ КОСИНУС УГЛА ACB=0,6 найти сторону BC
более месяца назад
Смотреть ответ
Просмотров : 8
Ответов : 1
Пармезан Черница
значения передвижения у животных
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов : 1
Источник
Кислоты неорганические и органические соединения.
1. Какое из веществ не проявляет кислотных свойств?
1) Теллуроводород;
2) Гидрид кальция;
3) Этанол;
4) Фенол.
2. Какая из перечисленных кислот с точки зрения этимологии их тривиальных названий является лишней?
1) Пальмитиновая;
2) Аспарагиновая;
3) Капроновая;
4) Валериановая.
3. Какое из утверждений неверно?
1) Основность кислоты определяется числом атомов водорода в ее молекуле;
2) Взаимодействие растворов кислоты и щелочи называется реакцией нейтрализации;
3) Существуют неорганические кислоты, не содержащие атома кислорода в молекуле;
4) Существуют органические кислоты, не содержащие карбоксильной группы.
4. С точки зрения основности кислот лишнее соединение из перечисленных – это:
1) Щавелевая кислота;
2) Серная кислота;
3) Борная кислота;
4) Кремниевая кислота.
5. В неорганической химии названия солей образуются от названия кислотообразующего элемента с соответствующим суффиксом, характеризующим степень окисления элемента в кислотном остатке. Если эта степень окисления минимальная, название соли имеет суффикс:
1) –ат;
2) –ид;
3) –ит;
4) –оат.
6. Кислотную реакцию среды имеют не только растворы кислот. Формула соли, водный раствор которой имеет рН 1) К2СО3;
2) Na2SO4;
3) NH4Cl;
4)Ba(NO3)2.
7. Водородный показатель (рН) в растворе первой соли больше, чем в растворе второй соли в случае:
1) K2S и FeCl3;
2) NaNO3 и CaCl2;
3) NaHCO3 и Na2CO3;
4) C6H5ONa и BaCl2.
8. Чтобы предотвратить гидролиз хлорида железа (III), к раствору соли следует добавить:
1) Раствор аммиака;
2) Соляную кислоту;
3) Железные опилки;
4) Дистиллированную воду.
9. В ряду водородных соединений галогенов
HF – HCl – HBr – HI:
1) полярность связи уменьшается, длина связи увеличивается;
2) полярность и длина связи уменьшаются;
3) полярность и длина связи увеличиваются;
4) полярность связи увеличивается, длина связи уменьшается.
10. Какое из веществ, формулы которых приведены ниже, проявляется наиболее сильные кислотные свойства?
1) Н2О;
2) СН3ОН;
3) C6H5ОН;
4) NH2 – СН2 – COOH.
11. Какая из перечисленных кислот имеет наибольшую константу диссоциации?
1) СН2 Br – COOH;
2) CBr3 – COOH;
3) CHBr2 – COOH;
4) СН3 – COOH.
12. Как изменяется сила кислородосодержащих кислот хлора в ряду
HClO4 – HClO3 – HClO – HClO2 ?
1) Увеличивается;
2) Уменьшается;
3) Сначала уменьшается, потом увеличивается;
4) Не изменяется.
13. Какая из указанных органических кислот является наиболее сильной?
1)
2)
3)
4)
14. Какие два оксида при взаимодействии с водой образуют соответствующие им кислоты?
1) SO3 Н2 SO4 , CrO3 Н2Cr2O7 ;
2) N2O3 HNO3 , P2O5 H3 PO4 ;
3) Mn2 O7 HMnO4 , Cl2O5 HClO3 ;
4) SO3 Н2 SO3 , Re2O7 HReO4 .
15. При взаимодействии кислотного оксида с водой может образоваться соответствующая кислота. Какой из оксидов при растворении в воде образует две кислоты?
1) P2O3 ;
2) N2O5 ;
3) NO2 ;
4) SO3 .
16. В растворе какого вещества фенолфталеин будет иметь малиновую окраску?
1) Лимонная кислота;
2) Поваренная соль;
3) Пищевая сода;
4) Аскорбиновая кислота.
17. Какое из высказываний неверно?
1) При взаимодействии азотной кислоты любой концентрации с металлами не выделяется водород;
2) Иодоводородная кислота боле сильная, чем плавиковая;
3) Серная кислота не взаимодействует с металлами, стоящими в ряду напряжений после водорода;
4) Степень диссоциации уксусной кислоты зависит от ее концентрации в растворе.
18. Ионное уравнение реакции
Н+ + ОН- = Н2О
соответствует реакции между:
1) соляной кислотой и гидроксидом меди (II);
2) кремниевой кислотой и раствором гидроксида натрия;
3) раствором азотной кислоты и раствором гидроксида бария;
4) раствором уксусной кислоты и раствором гидроксида калия.
19. Карбоновая кислота, которая дает реакцию «серебряного зеркала» и разлагается концентрированной серной кислотой с образованием оксида углерода (II), называется:
1) щавелевой;
2) бензойной;
3) пропионовой;
4) муравьиной.
20. Несмотря на то что свинец в ряду напряжений металлов расположен до водорода, с раствором серной кислоты он не реагирует. Причина этого в том, что:
1) поверхность свинца покрыта прочной оксидной пленкой;
2) поверхность свинца покрывается пленкой нерастворимого сульфата, препятствующей дальнейшему взаимодействию металла с кислотой;
3) свинец имеет большую плотность;
4) свинец пассивируется серной кислотой.
21. Формула продукта взаимодействия 1 моль масляной кислоты с 1 моль брома:
1) СН2 Br – СН2 – СН2 – COOH;
2) СН3 – СНBr – СН2 – COOH;
3) СН3 – СН2 – СНBr – COOH;
4) СН3 – СНBr – СНBr – COOH.
22. С помощью какого реагента можно различить растворы четырех солей: карбоната калия, сульфита калия, сульфида калия, нитрат серебра?
1) раствор хлорида бария;
2) соляная кислота;
3) раствор гидроксида натрия;
4) раствор иодида калия.
23. Какое из приведенных ниже утверждений неверно?
1) В результате реакции этерификации образуется сложный эфир и вода;
2) реакция этерификации является специфическим свойством карбоновых кислот;
3) двухосновные кислоты образуют два ряда эфиров: полные и кислые;
4) реакция, обратная этерификации, называется гидролизом сложного эфира.
24. Какой из процессов преимущественно определяет кислотность среды в водном растворе дигидрофосфата калия?
1) KН2PO4
· K+ + Н2PO4
· ;
2) Н2PO4
· + Н2О Н3PO4 + OH
· ;
3) Н2PO4
· H+ + НPO4 2
· ;
4) НPO4 2
· H+ + PO4 2+ ;
25. Взаимодействие фосфорной кислоты с известняком в промышленности получают ценное фосфорное удобрение и кормовую добавку, название которой:
1) преципитат;
2) фосфат кальция;
3) простой суперфосфат;
4) двойной суперфосфат.
26. Какое из свойств акриловой кислоты СН2 = СН – СООН обусловлено наличием карбоксильной группы?
1) Способность обесцвечивать бромную воду;
2) способность образовывать сложные эфиры;
3) склонность к полимеризации;
4) присоединение бромводорода по правилу Марковникова.
27. Какой из процессов свидетельствует о том, что угольная кислота проявляет более сильные кислоты свойства, чем фенол?
1) Под действием сильных кислот карбонаты разлагаются с выделением углекислого газа;
2) фенол малорастворим в воде, но легко растворяется в растворах щелочей;
3) углекислый газ поглощается раствором щелочи с образованием карбоната щелочного металла;
4) при пропускании углекислого газа через раствор фенолята щелочного металла образуется фенол.
28. Какие две кислоты способны реагировать друг с другом?
1) Фосфорная и соляная;
2) Азотная и кремниевая;
3) Сероводородная и серная;
4) Уксусная и сернистая.
29. Временная жесткость воды некоторого минерального источника обусловлена присутствием в ней гидрокарбоната кальция. С помощью какого реагента можно умягчить данную жесткую воду:
1) соляная кислота;
2) серная кислота;
3) раствор гидроксида натрия;
4) раствор карбоната натрия.
30. Какая из частиц (в соответствии с теорией Бренстеда – Лоури) не проявляет кислотных свойств:
1) Н2О+ ;
2) НSO4
· ;
3) Н2S ;
4) СН3СОО
·.
15
Приложенные файлы
- 6412843
Размер файла: 48 kB Загрузок: 5
Источник

На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:

- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2H204 и H3BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
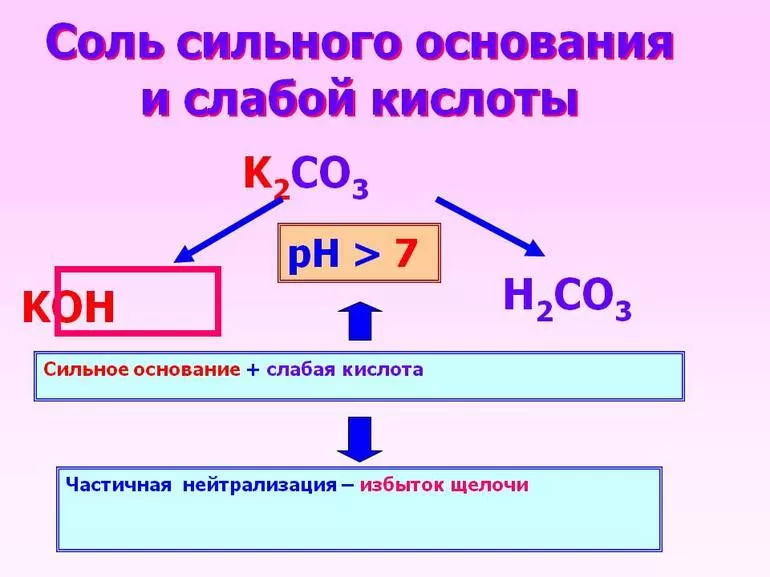
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.

Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.

Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.

При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.

Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.

Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Источник
