Какое количество пептидогликана содержится в клеточной стенке грамположительных бактерий
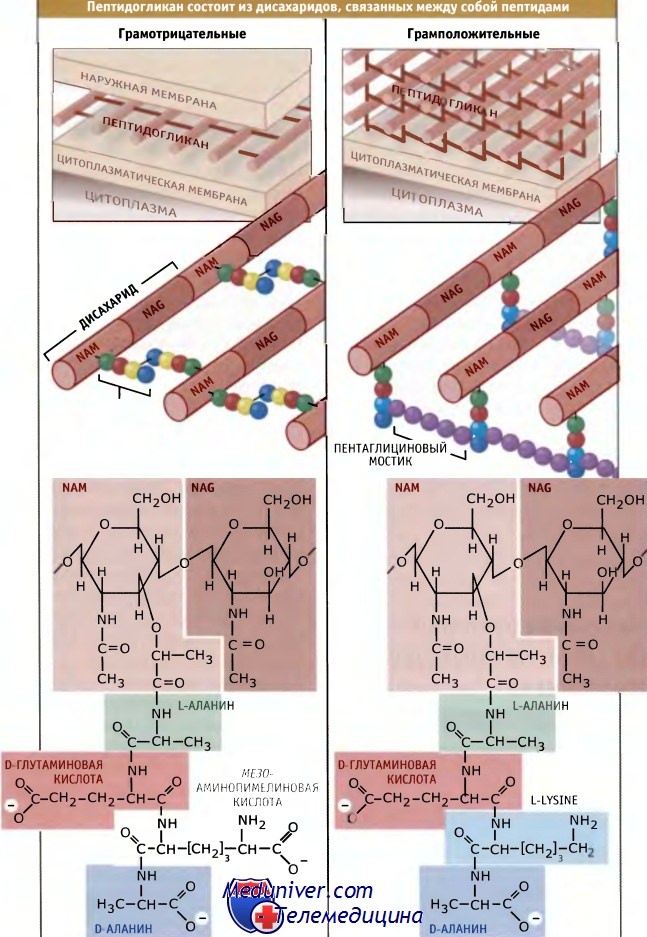
Строение и функции пептидогликана клеточной стенки бактерий• Большинство бактерий содержат пептидогликан, жесткую внешнюю клеточную стенку, образованную полимерной сеткой гликановых нитей, связанных между собой короткими пептидами • Пентапептиды дисахаридной природы, являющиеся предшественниками пептидогликана, образуются в цитоплазме, экспортируются из клетки, и собираются вне цитоплазматической мембраны • Согласно одной из моделей, объясняющей синтез клеточной стенки, мульти белковый комплекс вставляет новый материал, следуя принципу: «прежде чем удалить — сделай» • Перестройка, модификация и репарация клеточной стенки происходят с участием многих автолитических ферментов • У некоторых бактерий пептидогликан клеточной стенки играет важную роль в поддержании формы клетки • Гомолог бактериального актина, MreВ, образует в цитоплазме спиральные филаменты, которые определяют форму клетки, контролируя синтез пептидогликана У большинства бактерий основной компонент клеточной оболочки называется пептидогликан. Он состоит из сетки гликановых нитей, связанных пептидами. Полимер покрывает всю поверхность микроорганизма, образуя жесткую защитную оболочку. Клеточная стенка, состоящая из пептидогликана, играет критическую роль в обеспечении выживаемости бактерий, поскольку она оказывает сопротивление силе, возникающей за счет высокой внутренней осмолярности клетки, которая действует на цитоплазматическую мембрану. Поэтому разрыв стенки имеет для клетки катастрофические последствия. Пептидогликан также играет роль в поддержании формы большинства клеток бактерий. Известные виды бактерий подразеляются на две группы, которые отличаются друг от друга по отношению к прокрашиванию. Различное отношение грамположительных и грамотрицательных бактерий к прокрашиванию по Граму отражает фундаментальные различия в организации их клеточной стенки. У грамотрицательных бактерий присутствует тонкий слой пептидогликана, вероятно, состоящий из одного слоя гликановых нитей. Поэтому он обладает двухмерной структурой и связующие пептидные мостики располагаются в той же плоскости, что и гликановые цепи. Напротив, у грамположительных бактерий слой пептидогликана гораздо толще и включает несколько слоев гликановых нитей. В этом случае поперечные мостики, вероятно, лежат в разных плоскостях и соединяют нити, находящиеся в одной плоскости с нитями расположенного ниже слоя. Неизвестно, почему у грамположительных и грамотрицательных бактерий сборка пептидогликана происходит столь разными путями. Одно из возможных преимуществ более толстой клеточной стенки заключается в том, что она обладает большей прочностью и поэтому может обеспечивать большую степень защиты от физических воздействий, а также от высокого внутреннего осмотического давления, характерного для грамположительных клеток. Как показано на рисунке ниже, гликановые нити обычно состоят из повторяющегося дисахарида, N-ацетилглюкозамин-N-ацетилмурамовая кислота (NAG-NAM). Средний размер нитей составляет порядка 30 дисахаридов, однако он варьирует в широких пределах. К NAM ковалентно присоедияется пептид, который синтезируется вне рибосом и включает несколько небычных аминокислот, D-глутаминовую кислоту, D-аланин и диаминопимелиновую кислоту (БАР). (Аминокислоты, используемые для синтеза белка, обязательно должны находиться в L-форме.) DAP служит источником аминогрупп, которые участвуют в образовании сшивок между гликановыми нитями. Сшивки приводят к высвобождению последнего D-аланина из пептидной цепи. У некоторых бактерий в состав пептидных мостиков входят дополнительные аминокислоты. У грамположительных бактерий нити NAM-NAG. могут соединяться одним или несколькими остатками глицина в пептидных мостиках.
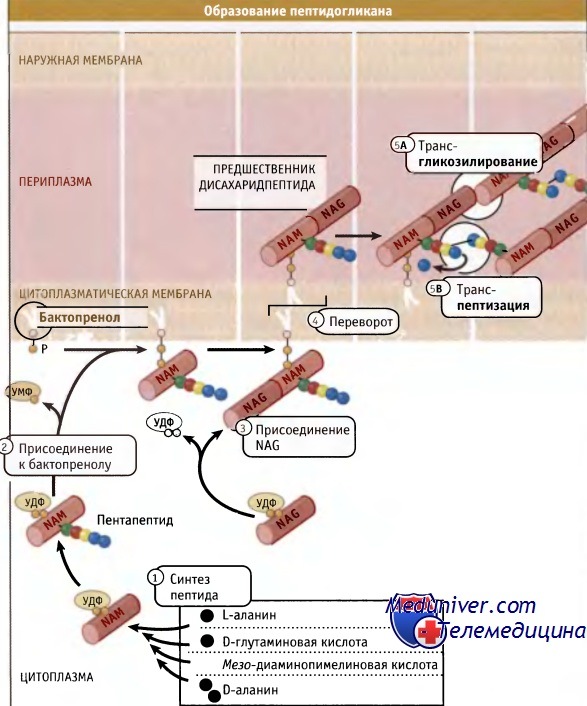
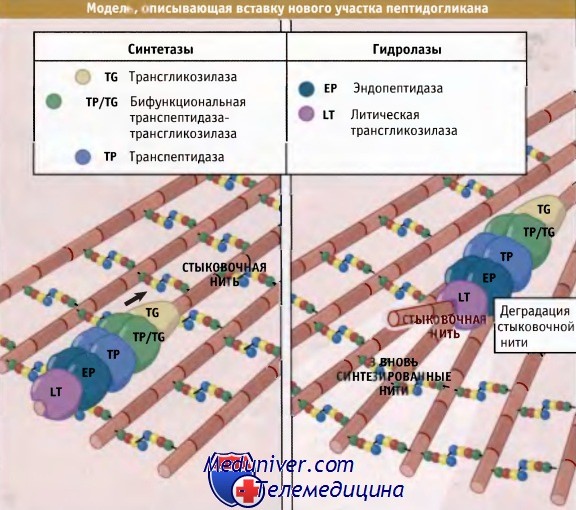
Как показано на рисунке ниже, дисахаридные предшественники образуются в цитозоле, начиная с уридин-5-дифосфата (УДФ)-NAM. Цепь аминокислот формируется последовательно, и в каждм шаге участвует один фермент. Образующийся пентапептид УДФ-NAM присоединяется к специфическому липиду клеточной мембраны (бактопренолу). Добавление NAG завершает построение дисахаридного предшественника, который затем ориентируется по направлению к внешней стороне мембраны для дальнейшей сборки существующего пептидогликана. Для включения дисахаридного предшественника в полимер необходимо протекание двух ферментативных реакций: трансгликозилирования для формирования гликановых цепей и транспептидации для образования сшивок. Ферменты, ответственные за транспептидацию, были обнаружены при изучении связывания пенициллина, токсический эффект которого на клетки бактерий связан с его ингибированием транспептидаз. Поэтому они были названы пенициллин-связывающими белками (РВР) Высокомолекулярные белки, относящиеся к классу А РВР, представляют собой бифункциональные ферменты, которые характеризуются наличием отдельного дополнительного трансгликозилазного домена, а также домена, обладающего транспептидазной активностью. У палочковидных бактерий цилиндрическая часть клетки и полукруглые торцы (образовавшиеся при делении), вероятно, требуют специальных машин синтеза пептидогликана. У Е. coli эти особые транспептидазы представлены белками РВР2 и РВР3 соответственно. Существуют данные, свидетельствующие о том, что эти транспептидазы используют несколько разные субстраты. Так, первая использует боковую цепь пентапептида, а вторая — тетра- или трипептид. Различий в структуре протеогликанов, синтезированных с участием двух этих ферментов, не обнаружено. Для того чтобы клетка могла расти и делиться, ковалентные связи в пептидогликане должны быть разорваны с тем, чтобы обеспечить включение новых его участков. Существует привлекательная точка зрения, которая объясняет, каким образом обеспечивается безопасное включение новых единиц пептидогликана. Она основана на принципе, которвш можно сформулировать так: «прежде чем удалить — сделай». Иными словами, новые нити добавляются в места образования новых участков до разрыва существующих связей. Как показано на рисунке ниже, процесс в целом контролируется мультиферментным комплексом, который содержит РВР, необходимые для добавления новых участков, и ферменты автолиза, которые затем гидролизуют существующие. Согласно модели «3 вместо 1», комплекс, содержащий две бифункциональные транспептидазы-трансгликозилазы и специальную гипотетическую трансгликозилазу, образует «тройную упаковку» новых сшитых между собой нитей. Две монофункциональные транспептидазы комплекса связывают новые внешние нити с существующими. Связывание происходит с любой стороны «матричной» нити. Затем матричная нить гидролизуется ферментом автолиза, который также входит в состав комплекса. Хотя появляются указания на существование ассоциатов, содержащих перечисленные ферменты, остается убедиться в том. что все остальные детали предложенной схемы соответствуют действительной картине. Одна из трудностей, возникающая при попытке проверить эту модель, заключается в том, что для многих бактерий характерна высокая избыточность набора РВР, так что выключение соответствующего гена практически не отражается на фенотипе.
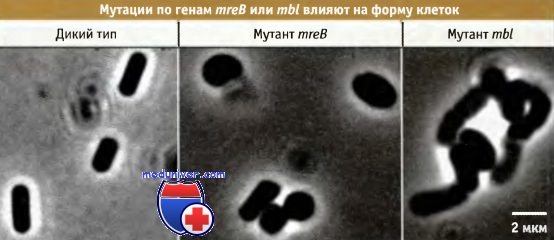
Однако у большинства бактерий в клеточной стенке содержится множество ферментов автолиза. Эти ферменты действуют на разные связи в пептидогликане. По большей части функции автолизинов неизвестны, за исключением их очевидной роли в деградации клеточной стенки, позволяющей разойтись дочерним клеткам, образовавшимся в конце акта деления. Так же как и в случае РВР, нокаут множественных генов, кодирующих аутолизин, обычно практически не влияет на фенотип, за исключением некоторого утолщения клеточной стенки и задержки разделения клеток. Существует несколько групп данных, в пользу точки зрения о том, что пептидогликан клеточной стенки играет ключевую роль в поддержании формы бактериальной клетки. Во-первых, как иллюстрирует рисунок ниже, изолированная саккула сохраняет форму клетки, из которой она была получена. Во-вторых, обработка клетки таким ферментом, как лизоцим, который гидролизует стенку, приводит к утрате клеткой своей формы. В-третьих, мутации, приводящие к изменению клеточной формы, часто затрагивают гены, принимающие участие в синтезе клеточной стенки. На протяжении десятилетий считалось, что бактерии не обладают актиновым цитоскелетом, который определяет форму эукариотических клеток. Однако недавно оказалось, что белок бактерий, MreВ, характеризующийся очень низкой степенью структурной гомологии с актином, фактически является его функциональным гомологом. Действительно, при рентгеноструктурном анализе этого белка обнаружена трехмерная складка, которая совпадает с характерной для актина. Гены mreВ впервые были идентифицированы при исследовании мутантов Е. coli и В. subtilis, у которых отмечалось нарушение клеточных форм. На рисунке ниже показано влияние мутаций в двух отдельных гомологичных генах — mreВ и mbl (близкий к mreВ) на форму клеток В. subtilis. Ген mreВ найден почти во всех бактериях несферической формы, однако отсутствует у кокков (обладающих круглой формой). Если в качестве исходной принять простую сферическую симметрию круглой формы, то белок MreВ может участвовать в функционировании клеточной системы, обеспечивающей образование более сложных форм: палочковидных (Е. coli и В. subtilis), изогнутых (вибрион) и спирализованных (Helicobacter). На рисунке ниже представлены клетки В. subtilis, экспрессирующие конструкцию, представляющую собой конъюгат кодирующей области белка Mbl и зеленого флуоресцирующего белка (GFP). Белки образуют спирализованные филаментарные структуры непосредственно под клеточной мембраной. Сами по себе эти структуры не обладают достаточной жесткостью, чтобы непосредственно определять форму клетки. Если искусственно нарушить цилиндрическую форму клетки, например удалив клеточную стенку и приготовив протопласты, Mbl-филаменты утрачивают спиральную конфигурацию. Вероятно, они функционируют, регулируя синтез материала для новой клеточной стенки таким образом, что во время роста, в целом, поддерживаются форма клетки и ее размеры. Пока окончательно не выяснено, как MreB-филаменты взаимодействуют с клеточной стенкой. Однако гены mreB почти всегда располагаются выше двух других консервативных генов бактерий, mreC и mreD. Оба этих гена также определяют форму клетки и кодируют трансмембранные белки, которые, в принципе, могут сопрягать информацию, получаемую от спирализованных MreB-филаментов внутри клетки, с синтезом клеточной стенки, происходящим вне ее.
– Также рекомендуем “Особенности клеточной оболочки грамположительных бактерий” Оглавление темы “Строение клетки”:
|
Источник
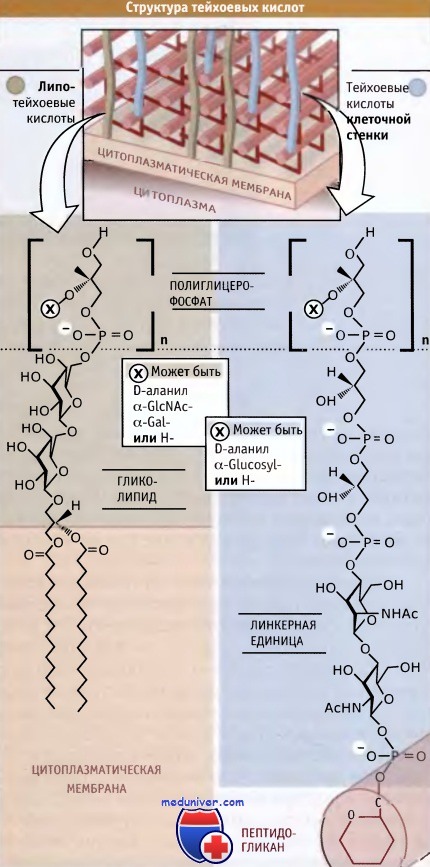
Особенности клеточной оболочки грамположительных бактерий• Грамположительные бактерии обладают толстой клеточной стенкой, содержащей много слоев пептидогликана • Существенным компонентом клеточной стенки грамположительных бактерий являются тейхоевые кислоты, однако точная их функция неизвестна • Многие белки клеточной поверхности грамположительных бактерий ковалентно связаны с мембранными липидами или с пептидогликаном • Mycobacteria характеризуются наличием специфических компонентов клеточной оболочки, богатых липидами Как было отмечено ранее, клеточные оболочки грамотрицательных и грамположительных бактерий представляют собой различные структуры. Основное различие в составе их клеточных стенок состоит в том, что по сравнению с грамотрицательными бактериями грамположительные характеризуются более толстым слоем пептидогликана. Кроме того, наряду с пептидогликаном, в клеточной стенке грамположительных бактерий содержится еще один важный класс макромолекулярных полимеров. Как правило, эти полимеры являются полианионами. К числу хорошо известных и наиболее изученных из них принадлежат тейхоевые кислоты. Рисунок ниже иллюстрирует, что тейхоевые кислоты имеют простую повторяющуюся структуру, состоящую из полимера, содержащего фосфорилированные формы сахаров или остатков глицерина. Связывание полимера с клеткой происходит одним из двух способов. Липотейхоевые кислоты связываются с остатками жирных кислот цитоплазматической мембраны, а тейхоевые кислоты клеточной стенки связываются с пептидогликаном посредством линкерных групп. В разных бактериях и даже в родственных штаммах одного вида обнаружено огромное количество различных повторяющихся единиц. Полимеры имеют общее свойство — все они являются полианионами, что обусловливается наличием в их составе фосфатных групп. Однако фосфат не играет критической роли, и его отсутствие может заменяться другой группой, например глюкоуронатом. При этом образуется тейхоуроновая кислота. Так же как и пептидогликаны, тейхоевые кислоты синтезируются в цитоплазме, через предшественник, связанный с УДФ, и затем транспортируются вне клетки для сборки. Тейхоевые кислоты необходимы для жизнедеятельности клетки. Об этом свидетельствует тот факт, что делеция генов, участвующих в их синтезе, приводит к гибели бактерий. Полностью их функции не выяснены, хотя не исключено, что они каким-то образом связаны с поддержанием на клеточной стенке электрического заряда. Также предполагается, что они участвуют в захвате клеткой двухвалентных катионов, контролируют активность ферментов автолиза, действующих на пептидогликан, или обеспечивают общую проницаемость клеточной стенки.
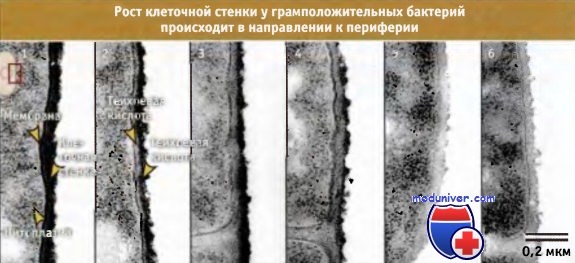
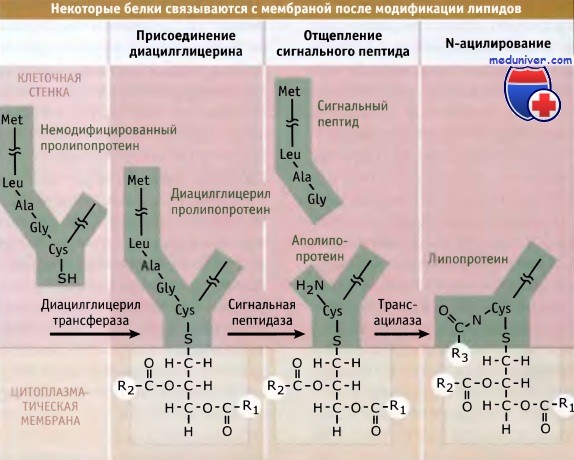
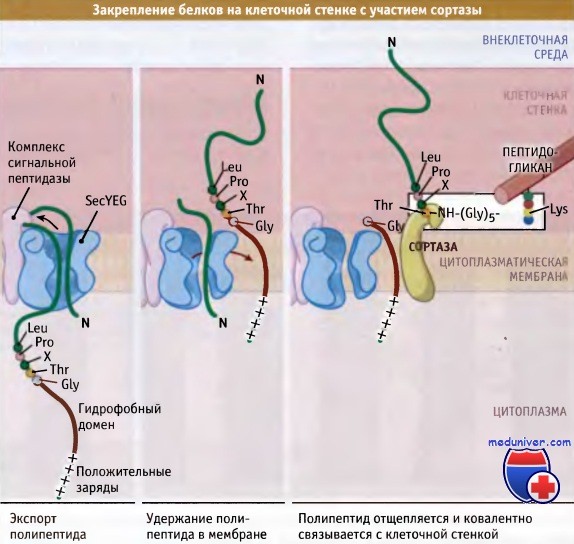
У грамположительных бактерий с отсутствующей наружной мембраной существует два механизма удержания поверхностных белков, с тем чтобы не допустить их потери. Один механизм представлен на рисунке ниже. Набор белков, секретируемых по общему секреторному пути (Sec), подвергается расщеплению специфической сигнальной пептидазой «типа II». До их расщепления фермент фосфатидилг-лицерин: пролипопротеин диацилглицерил трансфераза присоединяет белок к фосфофипидам на наружной стороне цитоплазматической мембраны. Белки, предназначенные для этой «липомодификации», узнаются по наличию сигнала сортинга, который содержит цистеиновый остаток сразу же после сайта расщепления сигнальной пептидазой. Ковалентное связывание белка с наружной поверхностью цитоплазматической мембраны предотвращает его отщепление. У грамположительных бактерий большое количество белков подвергается модификации с участием такого механизма. Например, считается, что у В. subtilis существует более 100 подобных белков. (Хотя у грамположительных бактерий этот механизм чаще используется для поверхностно-связанных белков, липомодифицированные белки также присутствуют у грамотрицательных бактерий.) Второй механизм удержания белков на клеточной поверхности у грамположительных бактерий состоит в связывании белка с пептидогликаном клеточной стенки. Вообще говоря, многие белки, связанные с клеточной стенкой, по-видимому, участвуют во взаимоотношениях между патогеном и организмом хозяина (хотя это предположение может являться следствием систематической ошибки секвенирования генома патогенного микроорганизма). Ключевым ферментом, принимающим участие в этом процессе, является сортаза. Известно большое количество субстратов этого фермента. Наиболее хорошо изучен белок А из Staphylococcus aureus. У белков, прикрепленных к клеточной стенке, на N- и С-концевых участках находятся узнаваемые последовательности. На N-концевом участке присутствует классический расщепляемый сигнальный пептид, необходимый для экспорта белка через цитоплазматическую мембрану. На С-конце, за вторым гидрофобным доменом расположены несколько в основном положительно заряженных аминокислотных остатков. По-видимому, во время работы сортазы этот домен поддерживает С-концевой участок в непосредственной близости от цитоплазматической мембраны. Сайт узнавания сортазой расположен непосредственно перед С-концевым гидрофобным участком и представляет собой короткую последовательность, обычно Leu-Pro-X-Thr-Gly, где X может быть любая аминокислота. В белке расщепляется связь между четвертым и пятым остатками этой последовательности аминокислот, и вероятно, при действии сортазы, он связывается с пептидогликаном амидной связью, хотя пока такой механизм однозначно не продемонстрирован. Как иллюстрирует рисунок ниже, синтез клеточной стенки у грамположительных бактерий сопровождается наращиванием нового материала, которое происходит в направлении изнутри-кнаружи. По мере созревания пептидогликана, он мигрирует к внешней стороне, пока не достигнет поверхности, где высвобождается за счет автолиза. Согласно современным представлениям, пептидогликан в релаксированном состоянии включается в состав стенки и, по мере миграции кнаружи, за счет роста клетки, постепенно растягивается. В конце концов, по мере увеличения растяжения, материал оказывается под нагрузкой, и в этот момент наступает гидролиз, после чего продолжается дальнейшее построение клеточной стенки. Остается неразрешенным важный вопрос, каким образом ферменты автолиза регулируют созревание пептидогликана и рост клетки? Также не ясно, насколько модель синтеза пептидогликана «3 вместо 1», объясняющая наращивание клеточной стенки у грамотрицательных бактерий, приложима к многослойной клеточной стенке грамположительных бактерий. Даже у таких хорошо известных микроорганизмов, как B.subtilis и E.coli, детали строения клеточной стенки исследованы недостаточно. Причем это несмотря на то, что в основе действия наиболее распространенных антибиотиков (особенно р-лактамов и гликопептидов) лежит ингибирование синтеза клеточной стенки бактерий. В основном это связано с тем, что внимание исследователей было сосредоточено на изучении биохимии взаимодействия ингибиторов с препаратами очищенных ферментов. К числу неизученных относится важнейший вопрос, касающийся механизма синтеза пептидо-гликана с участием РВР, учитывая трехмерную структуру клеточной стенки растущей бактерии. Для разных микроорганизмов структура клеточной стенки существенно варьирует. Два крайних случая подобной специализации можно проиллюстрировать микоплазмой, у которой вообще отсутствует клеточная стенка, и микобактериями, для которых характерно присутствие сложных жирных кислот, ковалентно связанных с пептидогликаном.
– Также рекомендуем “Особенности клеточной оболочки грамотрицательных бактерий” Оглавление темы “Строение клетки”:
|
Источник