Какое количество вещества нитрата натрия содержится в растворе объемом 1 л

Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
Какой объем 38 % – го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей H2SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора H2SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М NH4CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % – го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % – го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С – ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С – ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С – ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон – ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 – ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль


 С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
 5 . С 3 = 2,2 моль/0,5л =4,4 М
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 – ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль


 ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р – ра = 146 г/0,38 = 384 г
m р – ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m

 воды = 150 г
воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С – ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С – ? 

 2. m в-ва = 1090 г ∙ 0,1 = 109 г
2. m в-ва = 1090 г ∙ 0,1 = 109 г

3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ

 р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра – ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω

 р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 – ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V

 р-ра = 120 мл = 0,12 л
р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 – ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра – 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
 V р-ра 1 – ?
V р-ра 1 – ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 – ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
 7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
 m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра – ?
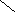
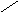 5. 15,7 % 10 м.ч
5. 15,7 % 10 м.ч
 10 %
10 %
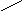

0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г


 7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 – ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
 ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω  – ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
– ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
 4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
 Ответ: 3,65 М
Ответ: 3,65 М 
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
 4. С = 6 моль / 1 л = 6 М
4. С = 6 моль / 1 л = 6 М
О твет: 6 М
твет: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
 4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 – ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
 8.С = 1,21 моль / 0, 0683 л = 17,7 М
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
Источник
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г.)
Задания 8 класс
Задача 1.
Главная роль элемента «А» в организме определяется тем, что оно отвечает за уровень гемоглобина в крови, а также входит в состав сотни ферментов, тем самым выполняя множество важных функций. Дефицит этого элемента в организме может привести к развитию серьезных заболеваний. Если ощущаете хроническую усталость, кожные покровы бледные, есть апатия и сонливость, появились судороги, обязательно проверьте уровень гемоглобина.
В 100 г яблок содержится 2,8 мг элемента «А».
- О каком элементе идет речь?
- Рассчитайте число атомов этого элемента в яблоке массой 200 г.
- Сколько яблок массой 200 г надо съесть человеку, чтобы в организм попало 3,01 · 1020 атомов этого элемента?
Задача 2.
В лаборатории имеются образцы различных металлов. Данные об этих металлах приведены в таблице.
Вещество | Число частиц N | Масса m, г | Молярная масса М г/моль | Количество вещества n, моль | Плотность ρ, г/см3 | Объем V, cм3 |
? | 37,7 · 1023 | ? | ? | ? | 7,9 | 44,24 |
? | ? | 192 | ? | 3 | 9 | ? |
? | 3,01· 1023 | ? | ? | ? | 2,7 | 5 |
- Определите какие это металлы.
- Расположите, образцы этих металлов, по возрастанию числа атомов в них, если предположить, что они взяты одинаковым объемом.
Задача 3.
Говоря на химическом языке, химик должен правильно употреблять и специальные химические понятия. Постарайтесь восстановить абзац текста, вставив вместо каждого пробела одно из предложенных понятий (слово можно изменять, вставляя в нужном падеже и числе). Некоторые слова пригодятся несколько раз, другие, возможно, не потребуются ни разу. Напишите в ответе полученный текст, подчеркните вставленные слова.
Морская вода это…(1) веществ: хлорид магния, хлорид натрия, хлорид калия и другие. Каждое из этих веществ имеет …(2) строение, которые в свою очередь состоят из …(3) разных химических …(4). Так, в составе этих веществ присутствуют …(5) хлора. Также в морской воде есть …(6) – вещество, необходимое для дыхания рыб. Его …(7) состоит из двух …(8). В воздухе этого …(9) содержится 21% по объему. Человеку и животным для дыхания необходим …(10)
Список понятий: вещество, немолекулярное, смесь, ион, простое, атом, молекула, элемент, сложное, чистое, грязное, азот, кислород.
Задача 4.
Определите простое вещество «А» в уравнениях реакций, проставьте коэффициенты.
1) А + О2 = ZnO 2) A + S = ZnS 3) A + HBr = ZnBr2 + H2
4) A + CuSO4 = ZnSO4 + Cu 5) A + NaOH + H2O = Na2 [Zn(OH)4] + H2
Задача 5
Соедините линиями различные названия одного вещества.
| А. Оксид азота (IV) | |
| Б. Оксид водорода | |
| В. Оксид углерода (IV) тв. | |
| Г. Карбонат натрия | |
| Д. Гидрокарбонат натрия | |
| Е. Оксид кремния (IV) | |
| Ж. Оксид алюминия | |
| З. Пероксид водорода | |
| И. Углерод | |
| К. Карбонат кальция |
1.Запишите: номера и буквы соответствующих названий;
2. Выпишите: названия оксидов и составьте их формулы
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г.)
Задания 9 класс
Задание 1
Определите методом электронного баланса коэффициенты в уравнении окислительно – восстановительной реакции. Укажите окислитель и востановитель.
КI + H2SO4(конц) = I2 + S + K2SO4 + H2O
Задание 2
При действии на твердое вещество А соляной кислотой образуется газ Б со специфическим запахом. На воздухе он сгорает образованием нового бесцветного газа В с резким запахом. Если через раствор последнего пропустить газ Б, выпадает осадок простого вещества Г желтого цвета. Последнее может быть получено при неполном сгорании вещества Б. При нагревании смеси вещества Г с порошком двухвалентного металла (в оксиде которого массовая доля кислорода равна 19,75%) образуется исходное вещество А. Определите вещество А. Составьте уравнения всех описанных реакций.
Задача 3
Рассчитайте объем и радиус атома натрия, исходя из предположения, что атомы имеют форму шара. Плотность натрия равна 0,968 г/см3. Объем шаров составляет 72,72% от общего объема.
Задача 4
В четырех склянках без этикеток находятся растворы следующих солей: нитрат бария, нитрат свинца, иодид калия, карбонат натрия. Используя реактивы: гидроксид натрия, серную кислоту, нитрат серебра, определите какое вещество находится в той или иной склянке.
1. Составьте уравнения всех реакций.
2. Укажите признаки каждой реакции.
Задача 5.
Составьте уравнения реакций по схемам.
Назовите вещества А, В. С и Д если известно, что вещество А входит в состав воздух (массовая доля 78%)
А + О2 = В
В + О2 = С
С + Н2О = В + Д
Д + Сu = В + …
С + Сu = В + ….
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г)
Задания 10 класс
Задание 1
Химический элемент состоит из двух изотопов, находящихся в атомном
отношении 16:9. Ядро первого изотопа содержит 38 нейтронов и 31 протон. Ядро второго изотопа содержит на 2 нейтрона больше. Назовите элемент и вычислите его среднюю относительную атомную массу.
(5 баллов)
Задание 2
Напишите уравнения протекающих реакций, соответствующих следующей последовательности превращений (вещества А и С – гомологи).
3 2 1 4 5 6
С2H7NO2 B A CxHy CH3Br C C3H6O





Укажите структурные формулы веществ и условия протекания
реакций (12 баллов)
Задание 3
При добавлении к 1 л бутана (200С, 1 атм) неизвестного газа объем газовой смеси увеличился в 3 раза, а ее плотность составила 1,276 г/л. Определите неизвестный газ. Как изменится плотность газовой смеси при добавлении к ней 2 л хлороводорода.
(8 баллов)
Задание 4
Смесь калия и алюминия массой 15,87 г залили 25 мл воды. В исходной смеси количество калия превышает количество алюминия в 40 раза. Рассчитайте массовые доли металлов в исходной смеси и объем газа (н.у.), который выделится после полного протекания реакций. Какой объем 0,6 М раствора соляной кислоты потребуется добавить к полученному раствору, чтобы масса выпавшего осадка максимальной. Рассчитайте массу осадка.
(10 баллов)
Задание 5
Углеводород «А», подвергаясь одновременному дегидрированию и
циклизации, превращается в соединение «Б», которое способно при нитровании образовывать взрывчатое вещество «В». При окислении вещества «Б» образуется карбоновая кислота «Г», входящая в состав сока брусники и обладающая консервирующими свойствами. Дайте названия и составьте структурные формулы всех веществ. Составьте уравнения соответствующих реакций.
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г)
Задания 11 класс
Задание 1
При частичном термическом разложении хлората калия в присутствии катализатора. в результате чего выделился кислород объемом 6,72 л (в пересчете на н. у.) и образовался твердый остаток. Этот остаток прореагировал с 30 %-ным раствором нитрата серебра. При этом образовалось 170 г раствора с массовой долей нитрата серебра 10 %. Определите массу исходного образца хлората калия. (10баллов)
Задание 2
Приведите уравнения реакций, соответствующих следующей схеме (все известные вещества содержат хлор). Расшифруйте неизвестные вещества, укажите условия протекания реакций.
H2SO4(20%) Fe t0 Na2S H2O
HCl Cl2 CaOCl2 X1 X2 X3 NaClO3





(12 баллов)
Задание 3
Рассчитайте количество теплоты, которое выделится при разложении перманганата калия, если в результате реакции образовалось 64 г кислорода. Теплоты образования КMnO4, K2MnO4 и MnO2 равны 829, 1184, 521 кДж/моль соответственно. (5 баллов)
Задание 4
Металл массой 19,5 г растворили в разбавленной азотной кислоте, при этом кислота восстановилась до оксида азота (II) и было получено 250 мл 1,2 М раствора соли. Определите неизвестный металл и запишите уравнение вышеупомянутой реакции. Напишите уравнение реакции металла с концентрированной серной кислотой.
(8 баллов)
Задание 5
Вычислить концентрацию формиат – ионов в растворе, 1 л которого содержит 0,1 моль муравьиной кислоты и 0,01 моль хлороводородной кислоты, считая диссоциацию последней полной. Кд = 1,8 ·10−4
(15 баллов)
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
Задачи на атомистику – это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Похоже, эти задачи станут дебютантами на ЕГЭ по химии-2020.
На вебинаре от составителей ЕГЭ по химии 28 апреля 2020 года в предложенных презентациях встретились именно такие задачи. Если вы не посещали этот вебинар – очень рекомендую посмотреть запись. Я выложил запись и материалы вебинара в себя в группе по ссылке.
Для решения задач на атомистику используются довольно простые идеи. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц.
Например, в молекуле триоксида серы SO3 на 1 молекулу приходится один атом серы и три атома кислорода:
1 молекула SO3 – 1 атом серы, 3 атома кислорода
Несложно пропорцией определить, что на две молекулы триокиксида серы будет приходиться два атома серы и шесть атомов кислорода:
2 молекулы SO3 – 2 атома S, 6 атомов О
На 20 молекул триоксида:
20 молекул SO3 – 20 атомов S, 60 атомов О
А вот сколько атомов приходится на х молекуле триоксида? Это также легко определить через пропорцию:
х молекул SO3 – х атомов S, 3х атомов О
Иначе говоря, количество атомов кислорода в молекуле SO3 в три раза больше, чем количество молекул. А количество атомов серы равно количеству молекул триоксида серы. Это простая, но не всегда очевидная идея. То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества.
Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях. Потому что 1 моль – это не что иное, как порция, состоящая из одинакового числа данных частиц.
То есть на х моль трикосида серы приходится:
х моль SO3 – х моль атомов S, 3х моль атомов О
Представьте себе, что атомы – это элементы изделия, а молекула состоит из некоторого числа таких деталей. Таким образом, число деталей разного типа всегда больше или равно числа изделий. Получается, в молекуле число атомов всегда больше или равно количества молекул.
И наоборот, число молекуле триоксида серы в 3 раза меньше ,чем число атомов кислорода в составе SO3. И число молекул равно количеству атомов серы.
Например, на х моль атомов серы приходится х моль молекул SO3.
Научиться решать задачи на атомистику не очень сложно. В ЕГЭ по химии атомистика станет, скорее всего, лишь частью более сложной комплексной задачи 34. Но я бы рекомендовал не пытаться сразу решать задачи на атомистику уровня ЕГЭ по химии. Занимаясь в спортзале, вы же не пытаетесь на первой тренировке поднять сразу тяжелую штангу. Точнее, попытаться вы можете, но последствия будут плачевными.
Для начала сделайте разминку возьмите простые задачи, чтобы освоить основные приемы и понять логику решения таких заданий. А после легких задач можно постепенно перейти к более сложным. Именно в таком порядке и расположены задачи в данной подборке “Атомистика”, которые позволяют понять, как именно удобно работать с такими заданиями.
Публикую подборку задач, в которых используются идеи атомистики. Все задачи взяты из сборника С.А. Пузакова, В.А. Попкова «Пособие по химии. Вопросы. Упражнения. Задачи». В скобках я привожу нумерацию этих задач в задачнике.
1. (66) В смеси оксида меди (I) и оксида меди (II) на 4 атома меди приходится 3 атома кислорода. Вычислите массовые доли веществ в такой смеси.
Пусть n (количество вещества) (Cu2O) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди в первом оксиде n1(Cu) = 2х моль, во втором оксиде: n2(Cu) = у моль
количество вещества атомов кислорода в первом оксиде n1(О) = х моль, во втором оксиде: n2(О) = у моль
общее количество вещества атомов меди: n(Cu) = (2x + y) моль, атомов кислорода: n(O) = (x + y) моль.
По условию задачи их отношение равно как 4 : 3, т. е. (2x + y) / (x + y) = 4 / 3.
Преобразуя приведённое выше равенство, получаем y = 2x.
Выразим через х массы соединений:
m(Cu2O) = n(Cu2O) * M(Cu2O) = (144x) г;
m(CuO) = n(CuO) * M(CuO) = 80 * у = 80 * 2x = (160x) г
Масса смеси двух оксидов будет равна:
m(смеси) = (144x + 160x) г = (304x) г
Теперь рассчитываем массовую долю оксидов в смеси:
ω(Cu2O) = m(Cu2O) / m(смеси) = 144x / 304x = 0.4737 (47.37%)
ω(CuO) = m(CuO) / m(смеси) = 160x / 304x = 0.5263 (52.63%)
Ответ: ω(CuO) = 52,6%, ω(Cu2O) = 47,4%
2. (67) В смеси двух хлоридов железа на 5 атомов железа приходится 13 атомов хлора. Вычислите массовые доли веществ в такой смеси.
Железо образует два устойчивых хлорида: FeCl2 и FeCl3.
Пусть n(FeCl2) = х моль, n(FeCl3) = y моль, тогда:
количество вещества атомов железа в первом хлориде n1(Fe) = х моль, во втором хлориде: n2(Fe) = у моль,
количество вещества атомов хлора в первом хлориде n1(Cl) = 2х моль, во втором хлориде: n2(Сl) = 3у моль,
общее количество вещества атомов железа: n(Fe) = (x + y) моль, атомов хлора: n(Cl) = (2x + 3y) моль.
По условию задачи их отношение равно как 5 : 13, т. е. (x + y) / (2x + 3y) = 5 / 13.
Преобразуя приведённое выше равенство, получаем y = 1,5x.
Выразим через х массы соединений:
m(FeCl2) = n(FeCl2) * M(FeCl2) = (127x) г;
m(FeCl3) = n(FeCl3) * M(FeCl3) = 162,5 * у = 162,5 * 1,5x = (243,75x) г
Масса смеси двух хлоридов будет равна:
m(смеси) = (127x + 243,75x) г = (370,75x) г
Теперь рассчитываем массовую долю хлоридов в смеси:
ω(FeCl2) = m(FeCl2) / m(смеси) = 127x / 370,75x = 0,343 (34,3%)
ω(FeCl3) = m(FeCl3) / m(смеси) = 243,75x / 370,75x = 0,657 (65,7%)
Ответ: ω(FeCl2) = 34,3%, ω(FeCl3) = 65,7%
3. (70) В каком молярном соотношении были смешаны карбид кальция и карбонат кальция, если массовая доля углерода в полученной смеси равна 25%?
Формулы карбида и карбоната кальция: CaC2 и CaCO3.
Пусть n(CaC2) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов углерода в карбиде кальция n1(С) = 2х моль, в карбонате: n2(С) = у моль,
общее количество вещества атомов углерода: n(С) = (2x + y) моль.
масса атомов углерода: m(С) = 12(2x + y) г.
Выразим через х массы соединений:
m(CaC2) = n(CaC2) * M(CaC2) = (64x) г;
m(CaCO3) = n(CaCO3) * M(CaCO3) = 100у г
Масса смеси двух веществ будет равна:
m(смеси) = (64x + 100у) г
Теперь записываем выражение для массовой доли атомов углерода в смеси:
ω(C) = m(C) / m(смеси)
0,25 = 12(2x + y) / (64x + 100у)
Преобразуем выражение, выражаем х через у:
х = 1,625у
Это и есть искомое молярное соотношение карбида кальция и карбоната кальция:
n(CaC2)/ n(CaCO3) = х/у = 1,625
Ответ: n(CaC2)/ n(CaCO3) = 1,625
Ответ: n(CaC2)/ n(CaCO3) = 1,625
4. (71) В каком молярном соотношении были смешаны гидросульфит натрия и гидросульфид натрия, если массовая доля серы в полученной смеси равна 45%?
Ответ: n(NaHS)/ n(NaHSO3) = 2,18
5. (72) Какую массу сульфата калия следует добавить к 5,5г сульфида калия, чтобы в полученной смеси массовая доля серы стала равной 20%?
Ответ: 31,3 г
6. (73) В смеси нитрата аммония и нитрата свинца (II) массовая доля азота равна 25%. Вычислите массовую долю свинца в этой смеси.
Ответ: 23,6%
7. (74) В смеси нитрата аммония и нитрата бария массовая доля азота равна 30%. Вычислите массовую долю нитрат-ионов в смеси.
Ответ: 71,3%
8. (75) В смеси двух оксидов углерода на 5 атомов углерода приходится 7 атомов кислорода. Вычислите объемную долю более тяжелого оксида в этой смеси
Ответ: φ(СO2) = 40%
9. (619) Через 13,1 г смеси бромида калия и иодида калия, в которой массовая доля брома равна 24,5%, пропустили смесь хлора и брома, в результате чего получилась смесь двух солей, в которой массовая доля брома равна 57%. Вычислите массу смеси галогенов, вступившую в реакцию.
Решение:
Масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 13,1·0,245 = 3,21 г
Количество вещества атомов брома:
n(Br) = m/M = 3,21 г/80 г/моль = 0,04 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,04 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0.04 моль·119 г/моль = 4,77 г
Масса йодида калия:
m(KI) = m(смеси) – m(KBr) =13,1 – 4,77 = 8,33 г
Количество вещества йодида калия:
n(KI) = m/M = 8,33 г/166 г/моль = 0,05 моль
По условию задачи, смесь йодида калия и бромида калия вступила в реакцию не полностью, но в конечной смеси осталось только две соли. При этом йодид калия, скорее всего, вступил в реакцию полностью, так как иначе конечная смесь будет содержать более двух солей.
Предположим, что сначала прореагируют наиболее активные окислитель и восстановитель – йодид калия и хлор:
2KI + Cl2 = 2KCl + I2
Если весь йодид калия вступил в эту реакцию, то в конечной смеси присутствуют только исходный бромид калия и образовавшийся хлорид калия. Количество хлорида калия:
n(KCl) = n(KI) = 0,05 моль
m(KI) = n·M = 0,05 моль·166 г/моль = 8,3 г
Массовая доля брома в такой смеси:
ω(Br) = m(Br) / m(смеси) = 3,21 г / (8,3 г + 4,77) = 0,2469 или 24,69%, что не соответствует условию задачи.
Следовательно, йодид калия реагирует не только с хлором, но и с бромом:
2KI + Cl2 = 2KCl + I2
2KI + Br2 = 2KBr + I2
Пусть с хлором прореагировало х моль йодида калия, тогда с бромом 0,05-х моль
Тогда образуется х моль хлорида калия и 0,05-х моль бромида калия.
Масса образовавшегося хлорида калия:
m(KCl) = n·M = x моль·74,5 г/моль = 74,5x г
Бромида калия:
m2(KBr) = n·M = (0,05-х) моль·119 г/моль = (5,95 – 119x) г
Масса конечной смеси солей:
mсмеси = mисх(KBr) + m2(KBr) + m(KCl) = 4,77 г + (5,95 – 119x) г + 74.5х = (10,72 – 44,5х) г
Количество атомов брома в конечной смеси:
n(Br) = 0,04 моль + (0,05 – х) моль = (0,09 – х) моль
Масса атомов брома:
m(Br) = n·M = (0,09 – х) моль·80 г/моль = (7,2 – 80х) г
Массовая доля брома в конечной смеси:
ω(Br) = (7,2 – 80х) / (10,72 – 44,5х) = 0,57
Решаем полученное уравнение, находим х:
х = 0,02 моль
Количество вещества и масса хлора, который вступил в первую реакцию:
n(Cl2) = 0,5х = 0,5·0,02 = 0,01 моль
m(Cl2) = n·M = 0,01·71 г/моль = 0,71 г
Количество вещества брома, который вступил во вторую реакцию:
n(Br2) = n·M = 0,5(0,05 – 0,02) моль = 0,015 моль
Масса брома:
m(Br2) = n·M =0,015 моль·160 г/моль = 2,4 г
Масса смеси галогенов, которые прореагировали с йодидом калия:
m(смеси) = m(Cl2) + m(Br2) = 0,71 г + 2,4 г = 3,11 г
Ответ: 3,11 г
10. (620) Через смесь натрия и бромида калия, в которой массовая доля брома равна 60%, пропустили хлор, в результате чего масса брома в смеси солей оказалась в 2 раза меньше, чем в исходной смеси. Вычислите массовую долю брома в полученной смеси солей.
Решение:
Примем массу исходной смеси за 100 г, тогда масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 100·0,6 = 60 г
Количество вещества атомов брома:
n(Br) = m/M = 60 г/80 г/моль = 0,75 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,75
