Какое количество вещества содержится в воде массой 200 грамм

- Главная
- Вопросы & Ответы
- Вопрос 6458889
более месяца назад
Просмотров : 47
Ответов : 1
Лучший ответ:

comment
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи:































Другие вопросы:
Рулон, в котором 42 м ткани, стоит 1302 грн. Сколько стоит рулон, в котором 36 м такой же ткани? Рулон, в котором 42 м ткани, стоит 1302 грн. Сколько стоит рулон, в котором
36 м такой же ткани?
более месяца назад
Смотреть ответ
Просмотров : 9
Ответов : 1
Из 100 кг семян льна получают 37 кг масла. Сколько масла получат из 250 кг таких же семян? Из 100 кг семян льна получают 37 кг масла. Сколько масла получат из
250 кг таких же семян?
более месяца назад
Смотреть ответ
Просмотров : 27
Ответов : 1
Стальной шарик объемом 5 см3 имеет массу 39 г. Какова масса шарика объемом 2,5 см3, изготовленного из той же стали? Стальной шарик объемом 5 см3 имеет массу 39 г. Какова масса шарика
объемом 2,5 см3, изготовленного из той же стали?
более месяца назад
Смотреть ответ
Просмотров : 23
Ответов : 1
Масса 4 одинаковых деталей равна 21,6 кг Какова масса 15 таких же деталей? Масса 4 одинаковых деталей равна 21,6 кг Какова масса 15 таких же деталей?
более месяца назад
Смотреть ответ
Просмотров : 12
Ответов : 1
Первый рабочий за 8 мин изготовил 3 детали, а второй за 10 мин — 4 таких же детали. У какого из рабочих производительность труда выше? Первый рабочий за 8 мин изготовил 3 детали, а второй за 10 мин — 4 таких
же детали. У какого из рабочих производительность труда выше?
более месяца назад
Смотреть ответ
Просмотров : 11
Ответов : 1
Источник
1. В каком случае применяют физическую величину «количество вещества» и в каких единицах ее измеряют? Ответ поясните примерами.
Количество вещества применяют в случаях, когда интересует отношение количества частиц, вступающих и/или образующихся в процессе химической реакции.
При горении водорода 2 молекулы водорода соединяются с 1 молекулой кислорода и образуют 2 молекулы воды:
2H2 + O2 = 2H2O
При горении метана 1 молекула метана вступает в химическое взаимодействие с 2 молекулами кислорода и образованием 2 молекул воды и 1 молекулы углекислого газа:
CH4 + 2O2 = CO2 + 2H2O
2. Что означает величина «молярная масса» и чем она отличается от физических величин «относительная молекулярная масса» и «относительная атомная масса»?
Молярная масса — масса одного моля вещества. А один моль это количество вещества, содержащее столько же частиц, сколько их содержится в 12 г углерода, масса которого равна 12 а. е. м.
Или, другими словами: молярная масса — это масса вещества, содержащего столько же частиц, сколько их содержится в 12 г углерода, масса которого равна 12 а. е. м.
Количество частиц, содержащихся в 1 моле вещества это постоянная величина, называемая числом или постоянной Авогадро, и равная 6,02 * 1023.
Поэтому можно сказать, что молярная масса — это масса 6,02 * 1023 частиц (атомов, молекул, ионов) данного вещества.
Относительная атомная (молекулярная) масса — значение массы атома (молекулы), выраженное в атомных единицах массы. Определяется как отношение массы атома данного элемента к 1/12 массы нейтрального атома изотопа углерода 12C.
§ 11 Относительная атомная масса химических элементов
3. Рассчитайте молярные массы воды H2O, углекислого газа CO2, серной кислоты H2SO4, сероводорода H2S.
Молярная масса численно совпадает с относительной молекулярной массой вещества:
M (H2O) = 2*1 + 16 = 18 г/моль
M (CO2) = 12 + 2*16 = 44 г/моль
M (H2SO4) = 2*1 + 32 + 4*16 = 98 г/моль
M (H2S) = 2*1 + 32 = 34 г/моль
4. Дано уравнение реакции 2Mg + O2 = 2MgO. Согласно этому уравнению по аналогии с таблицей 6 составьте таблицу, показывающую соотношения между массой реагирующих веществ в граммах, числом атомов и количеством вещества.
| Масса (m) | Число атомов | Количество вещества (n) | |||
|---|---|---|---|---|---|
| Mg | O | Mg | O | Mg | O |
| 48 г | 32 г | 12,04 * 1023 | 6,02 * 1023 | 2 моль | 1 моль |
| 24 г | 16 г | 6,02 * 1023 | 3,01 * 1023 | 1 моль | 0,5 моль |
| 12 г | 8 г | 3,01 * 1023 | 1,505 * 1023 | 0,5 моль | 0,25 моль |
5. Составьте 2-3 уравнения известных вам химических реакций и поясните, в каких массовых и количественных соотношениях реагируют вещества.
Ca + 2H2O = Ca(OH)2 + H2
Количественное соотношение кальция и воды 1 к 2.
Чтобы найти массовое соотношение, нудно найти молярную массу вещества, а затем выразить ее через количественное соотношение:
M (Ca) = 40 г/моль
M (H2O) = 18 г/моль
Так как 1 атом кальция вступает во взаимодействие сразу с 2-мя молекулами воды, то соотношение масс будет:
m (Ca) : m (H2O) = 40 : 2*18 = 40 : 36
Для реакции
2Na + 2H2O = 2NaOH + H2
Количественное отношение 1:1, массовое отношение 23:18.
Для реакции
Fe + S = FeS
Количественное отношение 1:1, массовое отношение 56:32.
Тестовые задания
1. Медь, взятая количеством вещества 6 моль, имеет массу
1) 60 г 2) 192 г 3) 384 г 4) 400 г
Ar (Cu) = 64 а. е. м.
Поэтому
m (Cu) = 6 * Ar (Cu) = 6 * 64 = 384 г
Ответ: 3.
2. Масса 0,1 моль алюминия равна
1) 0,1 г 2) 2,7 г 3) 260 г 4) 540 г
Ответ: 2.
3. Количество вещества, соответствующее 32 кг оксида железа (III), — это
1) 10 моль 2) 20 моль 3) 100 моль 4) 200 моль
n = m / Mr = 32 000 / 160 = 200 моль
Ответ: 4
3. Количество вещества, соответствующее 560 г карбоната кальция CaCO3, — это
1) 0,56 моль 2) 5,6 моль 3) 6,5 моль 4) 10 моль
n = m / Mr = 560 / 100 = 5,6 моль
Ответ: 2.
Источник
Задача 427.
Вычислить мольные доли спирта и воды в 96%-ном (по массе) растворе этилового спирта.
Решение:
Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех
веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна
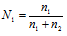 , а мольная доля спирта
, а мольная доля спирта  , где n1 – количество спирта; n2 – количество воды.
, где n1 – количество спирта; n2 – количество воды.
Рассчитаем массу спирта и воды, содержащихся в 1 литре раствора, при условии, что их плотности равны единице из пропорций:
а) масса спирта:

б) масса воды:

Находим количество веществ по формуле: 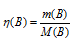 , где m(В) и М(В) – масса и количество вещества.
, где m(В) и М(В) – масса и количество вещества.
Тогда

Теперь рассчитаем мольные доли веществ:

Ответ: 0,904; 0,096.
Задача 428.
В 1кг воды растворено 666г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
Решение:
а) Массовая доля – процентное отношение массы растворённого вещества к общей массе раствора определяется по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
m(р-ра) = m(H2O) + m(KOH) = 1000 + 666 = 1666 г.
Тогда

б) Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Найдём массу КОН, приходящуюся на 100 мл раствора по формуле: формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(KOH) = 1,395 .1000 = 1395 г.
Отсюда

Теперь рассчитаем молярность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

г) Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна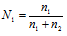 а мольная доля спирта
а мольная доля спирта  , где n1 – количество щёлочи; n2 – количество воды.
, где n1 – количество щёлочи; n2 – количество воды.
В 100г данного раствора содержится 40г КОН 60г Н2О.
Откуда

Тогда

Ответ: а) 40%; б) 9,95 моль/л; в) 11,88 моль/кг; г) 0,176; 0,824.
Задача 429.
Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
Решение:
Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(H2SO4) = 1,105 . 1000 = 1105 г.
Массу H2SO4, содержащуюся в 1000 мл раствора, находим из пропорции:

Определим молярную массу эквивалента H2SO4 из соотношения:
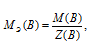
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H2SO4 → 2.
Отсюда

а) Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащегося в 1 литре раствора.
Тогда

б) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Теперь рассчитаем моляльность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов H2SO4 содержится в 1000г воды, составив пропорцию:

а) Массу , содержащуюся в растворе, вычислим по формуле:
Теперь рассчитаем моляльность раствора:

Ответ: а) 3,38н; б) 1,69 моль/л; 1,80 моль/кг.
Задача 430.
Плотность 9%-ного (по массе) раствора сахарозы С12Н22О11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
Решение:
М(С12Н22О11) = 342г/моль. Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(С12Н22О11) =1,035 . 1000 = 1035 г.
а) Массу С12Н22О11, содержащуюся в растворе, вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда

Концентрация вещества в г/л показывает число граммов (единиц массы), содержащихся в 1л раствора. Следовательно, концентрация сахарозы составляет 93,15г/л.
б) Молярная(объёмно-молярная) концентрация (СМ) показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Тогда

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов С12Н22О11 содержится в 1000 г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

Ответ: а) 93,15 г/л; б) 0,27 моль/л; в) 0,29 моль/кг.
Источник

Весовая процентная концентрация показывает, какой процент от общего веса раствора составляет растворенное вещество.
■ 18. Сколько нитрата калия нужно взять для приготовления 300 г 2% раствора соли?
19? Сколько воды и сахара требуется для приготовления 250 г 10% раствора?
20. Сколько хлорида бария потребуется для приготовления 50 г 0,5% раствора? (См. Ответ)
В лабораторной практике часто приходится иметь дело с кристаллогидратами — солями, содержащими кристаллизационную воду, например CuSО4 ·5H2O, FeSО4 · 7H2О и т. д. В этом случае следует уметь учитывать кристаллизационную воду.
Пример 1. Сколько соли нужно для приготовления 500 г 3% ее раствора? | |
Дано: 500 г. 3% раствора соли | Решение: Если сказано, что имеется 3% раствор, это значит, что в любом количестве этого раствора содержится 3% соли. Чтобы рассчитать, сколько нужно соли для приготовления 500 г такого раствора, следует найти 3% от 500 г: (500 · 3) : 100 = 15г Следовательно, соли нужно 15 г, а воды 500— 15 = 485 г. |
Пример 2. Сколько кристаллогидрата медного купороса нужно взвесить, чтобы получить 200 г 5% раствора сульфата меди? Сколько воды нужно для этого взять? | |
Решение: Сначала требуется определить, сколько сульфата меди CuSО4 нужно для приготовления заданного количества раствора: (200 · 5) :100 = 10 г. CuSO4. Далее делаем пересчет на кристаллогидрат: грамм-молекула CuSO4 весит 160 г, а грамм-молекула CuSO4 · 5H2О весит 250 г. Следовательно, мы можем составить пропорцию: 160 г CuSO4— в 250 г CuSO4 · 5H2О 10» CuSО4 — » х » CuSO4· 5Н2О X=(250 · 10) : 160 = 15,625 г. Воды для приготовления раствора требуется 200— 16,6 15= 184,375 г. | |
■ 21. Сколько кристаллогидрата Na2SO4 · 10H2O понадобится для приготовления 2 кг 34 раствора Na2SО4?
22. Сколько кристаллогидрата железного купороса FeSO4·7H2O потребуется для приготовления 30 кг 0,5% раствора FeSO4?
23. Сколько кристаллогидрата CaCl2 · 6H2O потребуется для приготовления 500 г 10% раствора СаСl2?
24. Сколько кристаллогидрата ZnSO4· 7H2O потребуется для приготовления 400 г 0,1 % раствора ZuSО4? (См. Ответ)
Иногда приходится приготовлять растворы определенной процентной концентрации, пользуясь для этого другими, более концентрированными растворами. Особенно часто с этим приходится сталкиваться в лаборатории при получении растворов кислот разной концентрации.
Пример 3. Сколько требуется 80% серной кислоты для приготовления 200 г 10% раствора этой кислоты?. Обозначим массу первого раствора m1, массу второго — m2, концентрацию первого раствора С1, концентрацию второго раствора C2. | |
Дано: m1 = 200г C1 = 10% C2 = 80% | Прежде всего нужно выяснить, сколько чистой безводной серной кислоты потребуется для приготовления 200 г. 10% раствора: (200 · 10) : 100 = 20 г. Определяем, в каком количестве 80% серной кислоты содержится 20 г чистой кислоты, рассуждая так: в 100 г 80% H2SО4 — 80 г чистой H2SО4 » х » 80% H2SО4 —20 » »H2SО4. Отсюда х = (100 · 20) : 80 = 25 г 80% раствора. Следовательно, для нашей цели нужно 25 г 80% раствора H2SО4 и 200—25 = 175 г воды. |
■ 25. Сколько потребуется 80% фосфорной кислоты для приготовления 2 кг 5% раствора?
26. Сколько потребуется 20% щелочи для приготовления 5 кг. 1 % раствора?
27. Сколько потребуется 15% азотной кислоты для приготовления 700 г 5% раствора?
28. Сколько потребуется 40% серной кислоты для приготовления 4 кг 2% раствора?
29. Сколько потребуется 10% соляной кислоты для приготовления 500 г 0,5% раствора? (См. Ответ)
Однако произвести правильный расчет — это для лаборанта еще не все. Нужно уметь не только рассчитать, но и приготовить раствор кислоты. Но кислоты нельзя взвешивать на весах, их можно только отмерять при помощи мерной посуды. Мерная же посуда предназначена для измерений объема, а не веса. Поэтому нужно суметь вычислить объем найденного количества раствора. Этого нельзя сделать, не зная удельного веса (плотности) раствора.
Обратимся снова к примеру 3, приведен ному на стр 67. Из таблицы (приложение III, п. 3, стр. 394) видно, что 80% серная кислота имеет плотность d=1,7, а масса раствора Р =25 г. Следовательно, по формуле
V = P : d находим: V = 25 : 1,7 = 14,7 мл.
Плотность воды практически считаем равной единице. Следовательно, 175 г воды займут объем 175 мл. Таким образом, чтобы приготовить 200 г 10% раствора из 80% серной кислоты, следует взять 175 мл воды и налить в нее 14,7 мл 80% серной кислоты. Смешивание можно производить в любой химической посуде.
■ 30. Сколько миллилитров 50% серной кислоты следует взять для приготовления 2 кг 10% раствора этой кислоты?
31. Сколько миллилитров 40% серной кислоты следует взять для приготовления 5 л 4% серной кислоты?
32. Сколько миллилитров 34% едкого кали потребуется для приготовления 10 л 10% раствора?
33. Сколько миллилитров 30% соляной кислоты потребуется для приготовления 500 мл 2% соляной кислоты? (См. Ответ)
Примеры расчетов, которые мы разбирали до сих пор, были посвящены определению веса или объема раствора, а также количества вещества, содержащегося в нем. Однако бывают случаи, когда нужно определить концентрацию раствора. Рассмотрим простейший случай.
Пример 4, Рассчитайте, какова процентная концентрация раствора, если смешано 45 г воды и 5 г соли. | |
Дано: mH2O = 45г mсоли = 5г | Решение: Сначала определяем общее количество раствора: 45 г + 5 г = 50 г. Затем определяем процентную концентрацию: (5 : 50) · 100 = 10% Следовательно раствор 10%. |
■ 34 Смешано 25 г соли и 35 г воды. Какова процентная концентрация раствора?
35. Смешано 5 г кислоты и 75 г воды. Какова процентная концентрация раствора? (См. Ответ)
Довольно часто приходится разбавлять, упаривать и смешивать растворы, после чего определять их концентрацию.
Пример 5. К 250 г 10% раствора добавили 150 г воды Какой стала концентрация раствора? | |
Дано: m1 = 250г C1 = 10% mH2O = 150г | Решение: Сначала рассчитываем содержи ние вещества в 250 г раствора: (250 · 10) : 100 = 25 г. Определяем общее количество получившегося раствора: 250 + 150 = 400 г. Поскольку мы к раствору приливали только воду, а растворенное вещество не добавляли, то его количество осталось, очевидно, таким же. Следовательно, в 400 г полученного раствора содержится 25 г вещества, а его процентная концентрация (25 : 400) · 100 = 6,25% |
■ 36. К 2 кг 20% раствора прилили 500 г воды. Какой стала концентрация раствора?
37. К 5 а 36% соляной кислоты прилили 1 л воды. Какой стала концентрация раствора?
38. Смешали 40 кг 2% и 10 кг 3% растворов одного и того же вещества. Какой стала концентрация полученного раствора?
39. Смешали 4 л 28% серной кислоты и 500 мл 60% серной кислоты. Какова концентрация полученного раствора?
40. 3 кг 20% раствора едкого натра упарили до 2 кг. Какова концентрация полученного раствора?
41. Сколько воды нужно прибавить к 500 мл 30% раствора (плотность 1,224 г/см3), чтобы получить 5% раствор? (См. Ответ)
Для определения, в каком соотношении следует смешать растворы разных концентраций, чтобы получить раствор искомой концентрации, можно применять так называемое «правило смешивания», или «диагональную
схему»
Пример 6. В каком весовом соотношении следует смешать 40% и 15% растворы, чтобы получить 35% раствор? |
Решение. Для решения составляют диагональную схему: 40→20 / 35 / 15→5 В центре пишут искомую концентрацию. У левого конца каждой диагонали пишут данные концентрации. Затем по диагонали производят вычитание: 35—15 = 20 40 — 35 = 5 (вычитают всегда из большей величины меньшую). Результат вычитания проставляют у правого конца соответствующей диагонали. Получилось, что смешать требуется 5 в. ч. 15% и 20 в. ч. 40% раствора, т. е. в соотношении 1:4. Если в смешивании участвует вода, ее концентрация берется равной 0%. |
■ 42. Рассчитайте по диагональной схеме, в каком соотношении следует смешать растворы:
а) 20% и 3% для получения 10%;
б) 70% и 17% для получения 25%;
в) 25% и воду для получения 6% (См. Ответ)
Объемная концентрация растворов. Молярная концентрация
При определении объемной концентрации растворов расчеты производят применительно к 1 л раствора. Молярная концентрация, например, показывает сколько грамм-молекул (молей) растворенного вещества содержится в 1 л раствора.
Если вы не помните, что такое грамм-молекула, обратитесь к приложению на стр. 374.
Например, если в 1л раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1 М), если 2 моля, то двумолярным(2 М), если 0,1 моля, тo раствор децимолярный (0,1 М), если 0,01 моля, то раствор сантимолярный (0,01 М) и т. д. Для приготовления растворов молярной концентрации необходимо знать формулу вещества.
Пример 7. Сколько нужно взять едкого натра, чтобы приготовить 200 мл 0,1 М раствора едкого натра NaOH. | |
Дано: V = 200 мл С = 0,1 М | Решение: Прежде; всего вычислим вес грамм-молекулы едкого натра NaOH. 23 + 16 + 1 = 40 г. Так как раствор 0,1 М, то в 1 л раствора содержится 0,1 грамм-молекулы NaOH, т. е. 4 г, а в 200 мл или в 0,2 л, раствора будет содержаться неизвестное количество NaOH. Составляем пропорцию: в 1 л 0,1 М раствора — 4 г NaOH » 0.2 » » — х » NaOH Отсюда 1 : 0,2 = 4 : x x = (4 · 0,2) : 1 = 0,8 г. т. е. для приготовления 200 мл 0,1 М раствора нужно 0,8 г NaOH. |
Молярная концентрация очень удобна тем, что в равных объемах растворов с одинаковой молярностью содержится одинаковое количество молекул, так как в грамм-молекуле любого вещества содержится одно и то же число молекул.
Готовят раствор молярной концентрации в мерных колбах определенного объема. На шейке такой колбы имеется отметка, точно ограничивающая нужный объем, а надпись на колбе указывает, на какой объем рассчитана данная мерная колба.
■ 43. Рассчитайте, какое количество вещества требуется для приготовления следующих растворов:
а) 5 л 0,1 М раствора серной кислоты;
б) 20 мл 2 М раствора соляной кислоты;
в) 500 мл 0,25 М раствора сульфата алюминия;
г) 250 мл 0,5 М раствора хлорида кальция. (См. Ответ)
Растворы кислот молярной концентрации нередко приходится готовить из процентных растворов.
Пример 8. Сколько требуется 98 % серной кислоты для приготовления 5 л 0,1 М раствора. | |
Дано: V1= 5 л С1= 0,1 М С2 = 98% | Решение: Определяем содержание чистой серной кислоты в 5 л 0,1 М раствора. 1 моль H2SО4 = 98 г; 0,1 моля H2SО4 = 9,8 г. Для приготовления 5 л 0,1 М раствора H2SО4 необходимо 9,8 · 5 = 49 г чистой H2SО4. Далее найдем, сколько 98% раствора серной кислоты потребуется для приготовления 5 л 0,1 М раствора. Составим пропорцию: в 100 г раствора содержится 98 г H2SО4 » х » » » 49 » H2SO4. Отсюда х = (49 · 100) : 98 = 50 г. |
■ 44. Сколько потребуется 50% азотной кислоты для приготовления 500 мл 0,5 М раствора.
45. Какой объем 98% серной кислоты необходим для приготовления 10 л 3 М раствора?
46. Вычислите молярность следующих растворов:
а) 20% серной кислоты;
б) 4% едкого натра;
в) 10% азотной кислоты;
г) 50% едкого кали. (См. Ответ)
Нормальная концентрация растворов
Нормальная концентрация растворов выражается количеством грамм-эквивалентов растворенного вещества в 1 л раствора. Для того чтобы произвести расчет для Приготовления раствора нормальной концентрации, нужно знать, что такое эквивалент. Слово «эквивалентный» означает «равноценный».
Эквивалентом называется весовое количество элемента, которое может соединяться с 1 весовой частью водорода или замещать ее в соединениях.
Если в молекуле воды Н2О содержится два атома водорода, весящих в сумме 2 у. е., и один атом кислорода, весящий 16 у. е., то на 1 у. е. водорода приходится 8 у. е. кислорода, что и будет эквивалентом кислорода. Если мы возьмем какой-нибудь окисел, например закись железа FeO, то в нем водорода нет, но зато есть кислород, а мы нашли из предыдущего расчета, что 8 у. е. кислорода эквивалентны 1 у. е. водорода. Следовательно, достаточно найти количество железа, способное соединиться с 8 у. е. кислорода, и это также будет его эквивалентом. Атомный вес железа 56. В окисле 56 у. е. Fe приходится на 16 у. е. кислорода, а на 8 у. е. кислорода железа придется вдвое меньше.
Можно найти эквивалент и для сложных веществ, например для серной кислоты H2SО4. В серной кислоте на 1 у. е. водорода приходится половина молекулы кислоты (включая, конечно, и водород), так как кислота двухосновная, т. е. эквивалент серной кислоты равен ее молекулярному весу (98 у. е.), деленному на 2, т. е. 49 у. е.
Эквивалент для основания можно найти, разделив его молекулярный вес на валентность металла Например, эквивалент NaOH равен молекулярному весу (40 у. е.), деленному на 1, т. е. на валентность натрия. Эквивалент NaOH равен 40 у. е. Эквивалент гидроокиси кальция Са(ОН)2 равен молекулярному весу (74 у. е.), деленному на валентность кальция, а именно на 2, т. е. 37 у, е.
Для того чтобы найти эквивалент для какой-нибудь соли, нужно молекулярный вес ее разделить на валентность металла и количество его атомов. Так, молекулярный вес сульфата алюминия Al2(SO4)3 равен 342 у. е. Эквивалент его равен: 342 : (3 · 2) = 57 у.е. где 3 — валентность алюминия, а 2 — количество атомов алюминия.
■ 47. Рассчитайте эквиваленты следующих соединений; а) фосфорной кислоты; б) гидроокиси бария; в) сульфата натрия;г) нитрата алюминия. (См. Ответ)
Грамм-эквивалентом называется количество граммов вещества, численно равное эквиваленту.
Если в 1 л раствора содержится 1 грамм-эквивалент (г-экв) растворенного вещества, то раствор является одно-нормальным (1 н.), если 0,1 грамм-эквивалента, то деци-нормальным (0,1 н.), если 0,01 грамм-эквивалента, то сантинормальным (0,01 н.) и т. д. Для расчета нормальной концентрации растворов также необходимо знать формулу вещества.
Пример 9. Приготовить 300 мл 0,1 н. раствора серной кислоты H2SО4. | |
Дано: V = 300 мл С = 0,1 н. | Решение: Молекулярный вес H2SО4 равен 98 у. е., эквивалент H2SО4 равен 98 : 2 = 49 у. е., грамм-эквивалент равен 49 г. Так как раствор 0,1 н., то в 1 л его содержится 0,1 г-экв т. е. 4,9 г, нужно же приготовить 300 мл или 0,3 л этого раствора. Поэтому составим пропорцию: 1 : 0,3 = 4,9 : x x = (4,9 · 0,3) : 5 = 1,47 г. т. е. на приготовление 300 мл 0,1 н. раствора серной кислоты пойдет 1,47 г H2SО4. |
Растворы нормальной концентрации, как и молярные, готовят в мерных колбах.
■ 48. Сколько серной к?
