Какое соединение хлора проявляет только окислительные свойства

Кислородсодержащие
соединения хлора
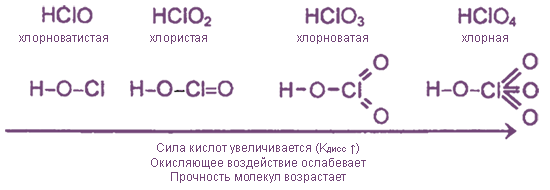
HClO – хлорноватистая кислота. Ей
соответствует кислотный оксид Cl2O. Соли называются
гипохлоритами.
HClO2 – хлористая кислота.
Кислотный оксид Cl2O3 не получен. Соли – хлориты.
HClO3 – хлорноватая кислота. Кислотный
оксид Cl2O5 не получен. Соли – хлораты.
HClO4– хлорная кислота. Кислотный оксид –
Cl2O7. Соли – перхлораты.
1) HClO – желтоватая жидкость.
Существует только в растворах. Получается при взаимодействии хлора с водой (без
нагревания):
Cl2 + H2O
= HCl + HClO
Соли этой кислоты получаются при
действии на щелочь хлора:
2KOH + Cl2 =холод=
KClO + KCl + H2O
используется как отбеливатель в
текстильной промышленности.
2) HClO2, HClO3 –
не имеют ангидридов (кислотных оксидов). Соли этих кислот применяют в
пиротехнике и взрывных работах. Наибольшее значение имеет KClO3 – хлорат
калия (бертолетова соль), получаемая насыщением горячей щелочи хлором:
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
Хлораты – сильнейшие окислители.
При ударе или нагревании взрываются.
3) Известен оксид ClO2,
который можно получить по реакции:
2KClO3 +
H2C2O4 = K2CO3 +
CO2
+ H2O + 2ClO2
ClO2 –
зелено-желтый газ, при растворении в воде дает смесь кислот:
2ClO2 + H2O
= HClO2 + HClO3
4) Осторожным нагреванием хлораты
можно перевести в перхлораты, из которых можно получить хлорную кислоту:
KClO4 + H2SO4 =
HClO4 + KHSO4
Хлорная кислота HClO4 – подвижная
жидкость, очень взрывоопасная, самая сильная из всех известных кислот. Почти
все ее соли хорошо растворимы в воде.
5) В ряду: HClO → HClO2 →
HClO3 → HClO4 сила кислот растет, а
окислительная способность падает.
Кислородные
соединения галогенов
Галогены с кислородом
непосредственно не реагируют. Но кислородсодержащие кислоты галогенов (кроме
фтора) могут быть получены как продукты реакций диспропорционирования хлора,
брома и йода с водой и щелочами. При
взаимодействии хлора с водой часть растворенного хлора переходит в кислоту НСlO, называемую хлорноватистой
кислотой. В этой молекуле хлор в степени окисления + 1 связан с
кислородом:

Хлорноватистая кислота известна
только в водном растворе. Это неустойчивое вещество претерпевает различные
превращения. На свету кислород отщепляется от хлора:
HClO
-hν→ HCl + O
В момент образования кислород в
виде отдельных атомов очень активен, вследствие чего раствор проявляет сильное
окислительное действие. При отнятии воды, например, действием безводного
хлорида кальция, из сильно охлажденного раствора выделяется оксид хлора (I), Сl2O, в виде красно-бурой жидкости с
температурой кипения +3,8°С. Это тоже неустойчивое вещество, способное
взрываться. Растворяясь в воде, он снова образует хлорноватистую кислоту. При
нагревании раствора НСlO
происходит более глубокое диспропорционирование хлора с переходом в степень
окисления +5:
3HClO = 2HCl + HClO3
Образующееся кислородсодержащее
соединение называется хлорноватой кислотой. Это более
устойчивое соединение, сильная кислота, образующая растворы с массовой долей до
40%. Под действием серной кислоты хлорноватая кислота диспропорционирует,
образуя еще два новых соединения хлора:
3HCl+5O3
= HCl+7O4 + 2Cl+4O2 + H2O
Хлорная кислота НСlO4 содержит хлор в высшей
степени окисления +7. Второй продукт реакции оксид хлора (IV) содержит хлор в необычной для
него степени окисления +4. Хлор в этом состоянии имеет неспаренный электрон.
Это также неустойчивое, взрывчатое соединение хлора. В водном растворе СlO2 диспропорционирует на две
кислоты — хлорноватую и хлористую. В последней степень
окисления хлора +3:
2ClO2+H2O = HClO3 + HClO2
Таким образом, в рассмотренных
реакциях показано образование четырех кислородсодержащих кислот хлора,
образующих ряд с возрастающими нечетными степенями окисления и валентностями
хлора от +1 до +7 (табл.). В этом ряду наблюдается последовательное и резкое
возрастание силы кислот от очень слабой хлорноватистой до одной из самых
сильных хлорной. Усиление кислот в этом ряду связано с увеличением числа атомов
кислорода, соединенных с хлором двойными связями. Это способствует
делокализации заряда аниона, что затрудняет присоединение к нему иона водорода
с образованием молекулы кислоты.
Таблица.
Кислородсодержащие
кислоты хлора
Свойство | Формула | |||
HClO | НСlO2 | НСlO3 | НСlO4 | |
| ||||
Степень окисления хлора | + 1 | +3 | +5 | +7 |
Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
Название солей | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Все четыре кислоты являются
сильными окислителями, по силе превосходящими хлор. Вместе с тем, как очевидно
из протекания многочисленных реакций, окислительная активность резко падает в
ряду от HClO
к НСlO4. Например, хлорноватистая кислота
моментально выделяет йод из раствора йодида калия, а разбавленная хлорная
кислота с раствором КI
практически не реагирует. Хлорноватистая кислота и ее соли обесцвечивают
органические красители, в то время как хлорная кислота окисляющего действия на
них не оказывает. Таким образом, увеличение числа атомов кислорода, окружающих
атом хлора, способствует стабилизации как молекул кислот, так и анионов их
солей. Повышение устойчивости проявляется и в том, что из четырех кислот только
хлорная может быть получена в безводном состоянии.
Находящие практическое применение
соли хлорноватистой и хлорноватой кислот получаются взаимодействием хлора с
растворами щелочей. Гипохлорит калия КСlO служит отбеливающим средством. Он
получается пропусканием хлора в раствор гидроксида калия. Одновременно
образуется хлорид калия:
Cl2+2KOH
=холод=KClO+KCl+H2O
Этот раствор называется жавелевой
водой (Javel — местечко около Парижа, где впервые стали
изготовлять эту воду в 1792 году — раствор солей калия
хлорноватистой и соляной кислот KOCl + KCl). Кислота НСlO настолько слабая, что вытесняется
из соли под действием углекислого газа:
KClO
+ CO2 + H2O = KHCO3 + HClO
Эта кислота и обесцвечивает
красители.
Как активные окислители гипохлориты
нашли применение в медицине. Они проявляют дезинфицирующее, антисептическое,
противомикробное действие. Гипохлорит натрия NаСlO применяется в растворе с массовой
долей 0,06% для промывания ран, при операциях па грудной клетке, брюшной или
плевральной полостях. Выпускается раствор гипохлорита натрия и для инъекций.
Взаимодействием хлора с другой
щелочью — гидроксидом кальция в отсутствие воды получается практически важный
продукт хлорная известь. Это белый порошок, иногда серый или
желтоватый от присутствия примесей, пахнущий хлором. В составе хлорной извести
имеются СаС2, Са(СlO)2,
Са(ОН)2 и вода. Часто хлорную известь представляют, как
смешанную соль с двумя разными анионами: СаСl(СlO). Хлорная известь реагирует даже
со слабыми кислотами с выделением хлора:
СаСl(СlO) + CO2
=H2O= CaCO3 + Cl2↑
Выделяющийся хлор реагирует с
органическими веществами, в результате чего, в частности, гибнут
микроорганизмы. Поэтому хлорная известь широко применяется в санитарных целях.
Она применяется также для отбеливания бумаги и тканей и для лабораторного
получения хлора.
Пропусканием хлора в горячий
раствор гидроксида калия получают смесь двух солей — хлорида калия КCl и хлората калия КСlO3.
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
При охлаждении раствора хлорат
калия начинает кристаллизоваться. При 20°С его растворимость составляет 7,4 г
на 100 г воды, в то время как растворимость хлорида калия равна 34 г. Хлорат
калия называют бертолетовой солью, так как он был впервые получен
К. Бертолле. Бертолетову соль предполагалось использовать в составе пороха
взамен селитры, но при испытаниях быстрая детонация такого пороха приводила к
разрыву пушечных стволов. Вместо этого бертолетова соль нашла широкое
применение в качестве окислителя в составах для фейерверков. Она является также
окисляющей составной частью спичечной головки. Кислород, отщепляющийся от хлора
в хлорате калия, в твердых смесях окисляет уголь, серу, фосфор, органические
вещества. Реакции сопровождаются яркими вспышками. Напишем реакцию сгорания
сахарозы:
C12H22O11+8KClO3
= 12CO2 +11H2O + 8KCl + 5647 кДж/моль
При нагревании хлорат калия и
другие соли кислородсодержащих кислот хлора разлагаются с выделением кислорода.
Разложение хлората калия ускоряется в присутствии оксида марганца(IV):
2KClO3
=MnO2= 3O2 + 2KCl
При нагревании бертолетовой соли
без катализатора происходит диспропорционирование хлора с образованием
перхлората калия:
4KClO3
=t=400C= 3KClO4 + KCl
При еще более сильном нагревании до
~520°С перхлорат калия тоже разлагается, выделяя кислород. Относительно высокая
термическая устойчивость перхлоратов и устойчивость их в растворах характерна и
для других солей с анионами, в которых центральный атом окружен четырьмя
атомами кислорода. Такие анионы имеют тетраэдрическое строение, а π-связи в них
полностью делокализованы.

Рисунок. Строение анионов кислородсодержащих кислот хлора
Кислородные соединения брома менее
устойчивы по сравнению с кислородными соединениями хлора. Оксид брома Вг2O разлагается уже при температуре
плавления -17°С. Свободный бром реагирует со щелочью при нагревании аналогично
хлору:
3Br2 +
6KOH =t= KBrO3 + 5KBr + 3H2O
Бромат натрия NaВrO3 применяется как окислитель в
аналитической химии. Например, по реакции с броматом калия определяют оксид
мышьяка (III):
3As2O3
+ 2KBrO3 + 9H2O = 6H3AsO4 +
2KBr
Бром трудно окислить до степени
окисления +7. До 1970 г. соли бромной кислоты НВrO4 не были получены, и в
учебниках иногда давались объяснения, почему они не существуют. Впервые
пербромат натрия был получен по реакции
NaBrO3
+ F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Кислородные соединения йода более
устойчивы по сравнению с другими галогенами. В щелочном растворе йод диспропорционирует
аналогично брому. При пропускании хлора в водную суспензию йода образуется
йодноватая кислота:
I2
+ 5Cl2 + 6H2O = 2HIO3 + 10HCl
Из раствора йодноватая кислота
выделяется в виде устойчивого кристаллического вещества. При ее обезвоживании
получается оксид 12О5, устойчивый при обычных условиях. Он нашел применение для
анализа воздуха на присутствие оксида углерода(И). Анализ основан на реакции, сопровождающейся
выделением йода: 5СO
+ I2O5 = I2 + 5CO2
Известна также йодная кислота НIO4, которая может быть получена
действием хлорной кислоты на йод:
2HClO4 + I2 = 2HIO4 + Cl2
После испарения воды из раствора
йодной кислоты получаются бесцветные кристаллы НIO4*2Н2O. Из химических свойств этого
вещества следует, что все атомы кислорода связаны непосредственно с йодом, и
вещество представляет собой ортойодную кислоту Н5IO6.
Как известно, в группах (главных
подгруппах) усиливается металличность при переходе в группе сверху вниз. В
группе галогенов находятся элементы, наиболее далекие по свойствам от металлов.
И все же у тяжелого элемента йода проявляются признаки металличности. Черные
кристаллы йода имеют слабый металлический блеск, а электрическое сопротивление
значительно ниже, чем у такого типичного неметалла, как сера. Йод, подобно
металлам, может входить в состав вещества в качестве катиона. Неустойчивый
катион I+ может быть стабилизирован
образованием комплексного иона с органическими молекулами. При реакции йода с
нитратом серебра в присутствии пиридина С5Н5N образуется комплексный ион такого
типа:
I2+AgNO3+2С5Н5N
= [I(С5Н5N)2]NO3
+ AgI↓
Кислородные соединения фтора
интересны тем, что фтор является единственным элементом, по
электроотрицательности превосходящим кислород. Поэтому простейшее из этих
соединений ОF2 следует называть не оксидом
фтора, а фторидом кислорода. Это газообразное вещество получается при действии
фтора на 2%-ный раствор гидроксида натрия:
2F2 + 2NaOH = 2NaF + OF2↑+H2O
Своим угловым строением молекула
фторида кислорода напоминает молекулу воды, но их дипольные моменты µ направлены противоположно:

Фторид кислорода термодинамически
неустойчив, при t
> 200°С распадается
на кислород и фтор. Есть и более сложные по составу фториды кислорода.
Фтор, так же, как и кислород, не
проявляет высокой валентности, соответствующей номеру группы, так как не имеет
энергетически доступных свободных орбиталей для перехода в возбужденное
состояние.
Источник
Основаны на процессе окисления анионов Cl-
2Cl– 2e- = Cl20
Электролиз водных растворов хлоридов, чаще – NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 – гипохлориты; КClO3 – хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl – хлорид водорода. При об. Т – бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl– 2e- = Cl20
Уравнения реакция см. “Получение хлора”. Особое значение имеет ОВР между соляной и азотной кислотами:

Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора – чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.

гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
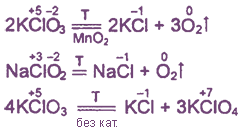
Хлорная известь
Хлорная (белильная) известь – смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Источник
При температуре, соответ. твующей химическому равновесию данной реакционной смеси, окислительные свойства хлора будут равны окислительным свойствам кислорода. [c.82]
Что является более сильным окислителем — хлор или кислород — в системе, состоящей из газообразных Ог, С 2, НС и НгО Ответ дайте для комнатной температуры и 1000 К, а также вычислите температуру, при которой в данной системе окислительные свойства хлора и кислорода одинаковы. [c.66]
П р и мер 87. Что является более сильным окислителем хлор или кислород в смеси, состоящей из газообразных Oj, I2, H l л Н2О при стандартных условиях. Ответ дать для комнатной температуры и 1000°К, а также вычислить температуру, при которой в данной смеси окислительные свойства хлора и кислорода одинаковы. [c.80]
Чем объясняются окислительные свойства хлора и хлорной извести [c.254]
Окислительные свойства хлора [c.60]
Окислительные свойства хлора. Опыты проводить под тягой ) [c.302]
Сильные окислительные свойства хлор проявляет при взаимодействии с металлами. При этом атомы металла отдают электроны, а молекулы хлора их принимают. Например [c.168]
Хлор, обладающий токсическими и стерилизующими свойствами, применяется для обеззараживания технической и питьевой воды и сточных вод, для дезинфекции и т. п. На окислительных свойствах хлора основано его применение в текстильной и целлюлозно-бумажной про.мышленности в качестве отбеливающего средства. Широкое применение как активные окислители имеют хлорокислородные соединения — гипохлориты, хлораты, перхлораты, двуокись хлора, белильная известь. Соляная кислота (водный раствор хлористого водорода) является одной из наиболее распространенных минеральных кислот и находит разнообразное применение в различных отраслях народного хозяйства. Хлор используется также для получения трех- и пятихлористого фосфора, хлорокиси фосфора, хлористого алюминия, хлорного железа и др. [c.328]
ЛАБОРАТОРНЫЕ РАБОТЫ Работа №22, ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА ХЛОРА [c.187]
Написать уравнение реакции, учтя сильные окислительные свойства хлора. [c.169]
Сильные окислительные свойства- хлор проявляет при взаимодействии с металлами. При этом атомы металла отдают электроны, а мо- [c.201]
Окислительные свойства хлора и еще в большей мере его свойство отнимать связанный водород тканей ведут к нарушению их жизненных функций, что и лежит в основе действия хлора на организм человека. При взаимодействии хлора с водой получается соляная кислота, поэтому вдыхание хлора вызывает воспаление дыхательных путей и разъедание легочных тканей. Первая помощь при отравлении хлором свежий воздух и покой теплые щелочные полоскания, внутрь теплое молоко с содой или боржомом при кашле — дионин, кодеин, вдыхание паров смеси спирта с эфиром или паров нашатырного спирта. [c.201]
Окислительные свойства хлора и еще в большей мере его свойство отнимать связанный водород тканей ведут к нарушению их жизненных функций, что и лежит в основе действия хлора на организм человека. При взаимодействии хлора с водой получается соляная кислота, поэтому вдыхание хлора вызывает воспаление дыхательных путей и разъедание легочных тканей. [c.243]
Нужно использовать окислительные свойства хлора, которыми не обладает СО2. Например пропустив газы через раствор иодида калия. [c.248]
Окислительные свойства хлора, брома и иода [c.140]
Окислительные свойства хлора. (Опыты проводить под тягой ), а) В один из цилиндров опустить полоску медной фольги, предварительно слегка нагретой над пламенем горелки (при отсутствии фольги можно воспользоваться многожильным электрическим проводом, расщепленным на отдельные проволочки). Что происходит [c.274]
Окислительные свойства хлор- [c.302]
НС1-С1а—НСЮ-НСЮа—НСЮз—НСЮ (2> увеличение окислительных свойств хлора [c.410]
Сильные окислительные свойства хлор проявляет при взаимодейст вии с металлами. При )том атомы меп-атла отдают электроны, а молекулы хлора их принимают. Папример [c.202]
Кислородные соединения галогенов получаются лишь косвенным путем. Это сравнительно малоустойчивые вещества, обладающие окислительными свойствами. Хлор и иод в них проявляют степень окисления от +1 до +7, а бром — от + 1 до +5. При взаимодействии галогенов с водой устанавливается равновесие Hal24-HOH HHalO-l-HHal. В случае иода равновесие сильно сдвинуто влево. Раствор хлора в воде (хлорная вода) содержит наряду с молекулами хлора две кислоты, образующиеся в результате реакции диспропорцио-нирования [c.144]
Карл Грин нашёл, что ослабление окислительных свойств хлора при псиользованпи хлораминов приводит к тому, что запахи, обусловленные образованием хлорфзнолов и других органических содержащих хлор соединений, большей частью не устраняются вследствие того, что хлораминами эти вещества не разрушаются. [c.75]
Окислительные свойства хлора. В один из цилиндров опустить полоску медной фольги, предварительно слегка нагретой над пламенем горелки (при отсутствии фольги можно восполь-зсваться многожильным электрическим проводом, расщепленным на отдельные проволочки). Что происходит Стеклянной лопаточкой взять немного порошкообразной сурьмы (свежерастертой) и стряхнуть ее в другой цилиндр с хлором. Что происходит В третий цилиндр опустить железную ложечку с положенным в нее кусочком металлического натрия. Что происходит Составить уравнения реакций. [c.257]
Смотреть страницы где упоминается термин Окислительные свойства хлора:
[c.52]
[c.410]
[c.94]
Источник

