Какое соединение с кислотными свойствами образует элемент

Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?

Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
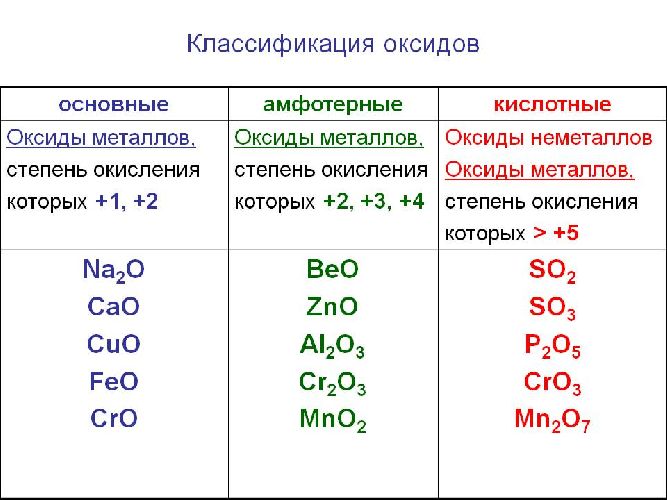
Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
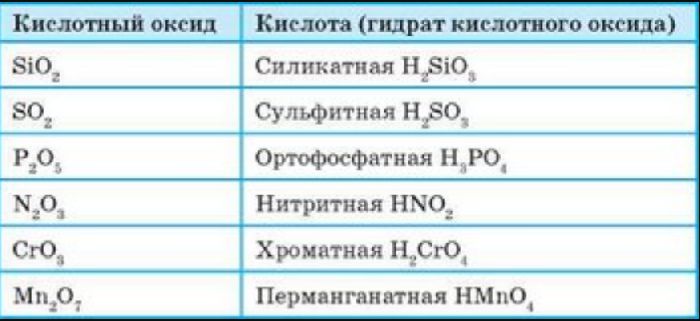
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Владимир Мартынов
7/10
Polina Malchikova
9/10
Дима Кулагин
10/10
Сергей Ефремов
9/10
Артём Макушенко
10/10
Наталия Григорьева
10/10
Данила Волков
9/10
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 988.
Источник
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в “строки и столбцы” – периоды и группы.
Период – ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 – называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая
говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов (“→” слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде “←” справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер – сверху вниз “↓”. Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается – снизу вверх “↑”. Это связано с уменьшением количества электронных орбиталей вокруг
атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия – тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует – там нужно считать электроны
“вручную”, располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть
то самое “сходство”:
- B5 – 1s22s22p1
- Al13 – 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия – 3s23p1, галия – 4s24p1,
индия – 5s25p1 и таллия – 6s26p1. За “n” мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы,
то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода – и вот быстро получена
конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных – только “вручную”.
Длина связи
Длина связи – расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех
веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические – усиливаются (слева направо “→”). В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические – ослабевают (сверху вниз “↓”).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны – у него самые слабые неметаллические свойства. Сера
обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера – самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную
линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева – металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные – возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные – ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются,
вторые – убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных
кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF – самая слабая из этих кислот, а
HI – самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные – усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные – ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные – с неметаллическими и кислотными. Так гораздо проще
запомнить 😉

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность – способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны).
Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает
к себе электроны и уходит в отрицательную степень окисления со знаком минус “-“.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева – это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий
расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе
выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на
себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости “синонимичны” также понятия сродства к электрону – энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации –
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды,
ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру,
для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы – R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми “высшими” оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим,
что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене.
Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в “-” отрицательную СО.
Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы – 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко
найдете формулы других ЛВС VI группы: серы – H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Определение
Оксиды – бинарные соединения, в состав которых входит кислород в степени окисления -2.
Номенклатура оксидов
Названия оксидов строятся по следующим правилам систематической номенклатуры:
Сначала указывают слово оксид, после него, в родительном падеже, – название второго элемента.
Если элемент, образующий оксид, имеет единственную валентность, то её в названии оксида можно не указывать. Если же элемент имеет переменную валентность и образует несколько оксидов, то валентность элемента обязательно указывается римскими цифрами в скобках в конце записи названия оксида.
При записи химической формулы оксида кислород записывается на последнем месте.
Примеры:
В настоящее время при формировании названий оксидов пользуются правилами систематической номенклатуры. Однако до её появления, пока число известных соединений было не столь велико, широко использовалась тривиальная номенклатура, в которой названия веществ основаны не на особенностях их строения, а на внешнем виде или каких-то специфических свойствах именуемых объектов. Многие тривиальные названия распространены и в наше время.
На смену тривиальной номенклатуре пришла полусистематическая номенклатура. В полусистематических названиях веществ с помощью использования морфем пытались отразить особенности химического строения соединений. Применительно к оксидам вводились следующие названия: закись – для оксидов элементов в низких степенях окисления, окись – для более высоких степеней окисления. Кислотные оксиды часто рассматривали как продукты дегидратации соответствующих кислот и отражали это в виде названия ангидрид: – фосфорный ангидрид, – серный ангидрид и т.д.
Таблица 1
Формулы и названия некоторых оксидов в соответствии с тривиальной, полусистематической и систематической номенклатурой
| Формула | Тривиальное название | Устаревшее название | Систематическое название |
| веселящий газ | закись азота | оксид азота (I) | |
| окись азота | оксид азота (II) | ||
| трёхокись азота, азотистый ангидрид | оксид азота (III) | ||
| бурый газ | двуокись азота | оксид азота (IV) | |
| пятиокись азота, азотный ангидрид | оксид азота (V) | ||
| сернистый газ | двуокись серы, сернистый ангидрид | оксид серы (IV) | |
| трёхокись серы, серный ангидрид | оксид серы (VI) | ||
| угарный газ | окись углерода | оксид углерода (II) | |
| углекислый газ | двуокись углерода | оксид углерода (IV) | |
| натр | окись натрия | оксид натрия | |
| жжёная магнезия | окись магния | оксид магния | |
| жжёная известь, негашёная известь | окись кальция | оксид кальция | |
| глинозём | окись алюминия | оксид алюминия | |
| кремнезём | двуокись кремния | оксид кремния (IV) | |
| железная окалина | закись-окись железа | оксид железа (II, III) | |
| вода | окись водорода | оксид водорода |
КЛАССИФИКАЦИЯ ОКСИДОВ
Оксиды делятся на две большие группы: солеобразующие и несолеобразующие. Последние, как вытекает из названия, не образуют солей.
Несолеобразующими называют оксиды, которые не вступают во взаимодействие ни с щелочами, ни с кислотами и не образуют солей. Эти оксиды образованы неметаллами.
Несолеобразующих оксидов немного, их необходимо запомнить: , , , .
Солеобразующими называют оксиды, способные взаимодействовать с кислотами или с основаниями с образованием солей.
Солеобразующие оксиды делятся на основные, кислотные и амфотерные оксиды.
Основные оксиды – оксиды, которым соответствуют основные гидроксиды (основания).
Основные оксиды образованы типичными металлами (щелочными, щелочноземельными, магнием), а также переходными металлами в низких степенях окисления (кроме ).
Примеры основных оксидов: , , , , , , , , , , и др.
Кислотные оксиды – оксиды, которым соответствуют кислотные гидроксиды (кислоты).
Кислотные оксиды образованы неметаллами (за исключением несолеобразующих оксидов , , , ), а также переходными металлами в высоких степенях окисления.
Примеры кислотных оксидов: , , , , , , , , , , , , и др.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Им соответствуют амфотерные гидроксиды.
К амфотерным оксидам относятся оксид бериллия , оксид алюминия , оксид цинка , а также оксиды переходных металлов в промежуточных степенях окисления.
Примеры амфотерных оксидов: , , , , , , , , и др.

Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Это оксиды металлов (кроме некоторых переходных металлов в высших степенях окисления), твердые вещества.
Основным оксидам соответствуют основания, в которых металл имеет такую же степень окисления, как в оксиде, при этом степень окисления равна числу гидроксильных групп.
Например, оксиду натрия соответствует гидроксид натрия ;
оксиду кальция соответствует гидроксид кальция ;
оксиду железа (II) соответствует гидроксид железа (II) .
Кислотные оксиды взаимодействуют с щелочами с образованием соли и воды, им соответствуют кислоты. Это оксиды неметаллов () или переходных металлов в высших степенях окисления ().
Оксиду соответствует кислота в случае, если степень окисления элемента в обоих соединениях одинакова, при этом степень окисления кислотного остатка равна количеству атомов водорода.
Например, оксиду углерода (IV) соответствует угольная кислота ;
оксиду серы (IV) соответствует сернистая кислота ;
оксиду серы (VI) соответствует серная кислота ;
оксиду азота (V) соответствует азотистая кислота ;
оксиду азота (V) соответствует азотная кислота ;
оксиду азота (IV) соответствует сразу две кислоты: азотная — и азотистая — ;
оксиду хлора (IV) соответствует хлорноватая и хлористая кислоты.
Обратите внимание: если элемент в оксиде проявляет степень окисления, отличную от той, которую он проявляет в кислоте, такой оксид является несолеобразующим!
Например: углерод в угарном газе проявляет степень окисления +2, в то время как в единственной кислоте, содержащей углерод, его степень окисления равна +4. Поэтому оксид углерода (II) относится к несолеобразующим оксидам.
Амфотерные оксиды проявляют в зависимости от условий свойства основных или кислотных оксидов.
Им соответствуют амфотерные основания.
Например, оксиду железа (III) соответствует гидроксид железа (III)
оксиду алюминия соответствует гидроксид алюминия
оксиду хрома (III) соответствует гидроксид хрома (III)
В таблице представлены основные свойства кислотных, основных и амфотерных оксидов.
| основные | амфотерные | кислотные |
|---|---|---|
Взаимодействуют с кислотами с образованием соли и воды. Это оксиды металлов (кроме некоторых переходных металлов в высших степенях окисления), твердые вещества CaO, FeO, CuO | оксиды, проявляющие в зависимости от условий свойства основных или кислотных оксидов. Им соответствуют амфотерные основания Это твердые вещества. AlO, ZnO, FeO, , BeO | взаимодействуют с щелочами с образованием соли и воды, им соответствуют кислоты. Это оксиды неметаллов (CO, SO, SO, NO) или переходных металлов в высших степенях окисления (CrO, MnO) Газы, жидкости, твердые тела Прим. Некоторые (NO, ClO) образуют сразу две кислоты |
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Основные и амфотерные оксиды при комнатной температуре – твердые вещества (, и др.); кислотные оксиды – твёрдые вещества (, ), жидкости (, СО и др.) или газы (, и др.). Все несолеообразующие оксиды являются газами, кроме , который является твердым веществом. Однако, нужно помнить, что кремниевую кислоту нельзя получить непосредственно из оксида кремния, добавляя воду! Эту кислоту можно получить косвенным путем из солей кремния – силикатов.
Оксиды металлов могут быть окрашены в разные цвета: оксиды щелочных и щелочно-земельных металлов обычно белого цвета, оксиды переходных металлов – зеленый; – красно-оранжевый; – черный, а – красный.
Оксид кремния – самое распространенное твердое вещество на Земле. Он входит в состав почвы (песок), горных пород и минералов. Драгоценные камни, такие как изумруд, сапфир, горный хрусталь имеют в своей структуре молекулы оксида кремния, при этом атомы кремния и кислорода образуют атомную кристаллическую решетку, и, поэтому представляют собой тугоплавкие, твердые, но хрупкие кристаллы правильной формы:



Бурый газ (оксид азота(IV)) Оксид железа (III) Оксид кремния
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
| Исходное вещество | Реагент | Продукты реакции | Уравнение реакции |
|---|---|---|---|
| вода | растворимое основание (щелочь)* | ||
| MgO | кислота | соль и вода | |
| CaO | кислотный оксид | соль | |
| амфотерный оксид | соль |
* Взаимодействие основного оксида с водой протекает только в случае, если образуется растворимое основание, т.е. щелочь. В случае возможного образования нерастворимого основания реакция не идет, например:
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
| Исходное вещество | Реагент | Продукты реакции | Уравнение реакции |
|---|---|---|---|
| вода | соответствующая растворимая* кислота | ||
| щелочь | соль и вода | ||
| основный оксид | соль | ||
| амфотерный оксид | соль |
*Реакция не протекает в случае,если образуется нерастворимая кислота, например:
Кислотные оксиды образуют соли, соответствующие определенной кислоте. Если у элемента может быть две или более кислот, то следует ориентироваться на степень окисления этого элемента в оксиде и кислоте: она должна быть одинаковой. Для лучшего понимания превращений кислотных оксидов в соли советуем воспользоваться следующим алгоритмом (на примере взаимодействия оксида азота(V) с гидроксидом кальция):
1) Определим степень окисления азота в оксиде: X=10/2=+5
2) Вспомним, какие кислоты образует азот и определим в каждой его степень окисления:
Значит оксиду азота (V) соответствует азотная кислота, и при взаимодействии с щелочами образует ее соли – нитраты ():
Воспользовавшись этим алгоритмом, можно составить следующие логические ряды:
ст.ок=+5 образует соли нитраты
ст.ок=+3 образует соли нитриты
ст.ок=+5 образует соли нитраты
Для наглядного запоминания этого принципа можно воспользоваться таблицей, приведенной ниже.
Таблица. Формулы и названия кислот, кислотных остатков и соответствующих кислотных оксидов
| Формула кислоты | Название кислоты | Формула кислотного остатка | Название кислотного остатка | Соответствующий кислотный оксид |
|---|---|---|---|---|
| HF | Фтороводород, плавиковая | Фторид | ||
| HCl | Хлороводород, соляная | Хлорид | ||
| HBr | Бромоводород | Бромид | ||
| HI | Йодоводород | Йодид | ||
| Сероводород | Сульфид | |||
| HCN | Циановодородная | Цианид | ||
| Азотистая | Нитрит | |||
| Азотная | Нитрат | |||
| Ортофосфорная | Фосфат | |||
| Мышьяковая | Арсенат | |||
| Сернистая | Сульфит | |||
| Серная | Сульфат | |||
| Угольная | Карбонат | |||
| Кремниевая | Силикат | |||
| Хромовая | Хромат | |||
| Дихромовая | Дихромат | |||
| Марганцовая | Перманганат | |||
| Хлорноватистая | Гипохлорит | |||
| Хлористая | Хлорит | |||
| Хлорноватая | Хлорат | |||
| Хлорная | Перхлорат | |||
| Метановая, муравьиная | Формиат | |||
| Этановая, уксусная | Ацетат | |||
| Этандиовая, щавелевая | Оксалат |
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
| Исходное вещество | Реагент | Продукты реакции | Уравнение реакции |
|---|---|---|---|
| вода | не взаимодействуют | ||
| кислотный оксид | соль | ||
| основный оксид | соль | ||
| кислота | соль | ||
| щелочь | щелочь в расплаве — соль+вода | т | |
| щелочь в растворе — комплексная соль |
СПОСОБЫ ПОЛУЧЕНИЯ ОКСИДОВ
1) взаимодействие простых веществ с кислородом
2) взаимодействие сложных веществ с кислородом
3) разложение некоторых солей при нагревании
Примечание: соли натрия и калия обычно не разлагаются с образованием оксидов. Подробнее смотрите тему “Разложение солей”
4) дегидратация кислот и нерастворимых оснований
(точнее: )
5) окисление одних оксидов и восстановление других
(алюмотермия)
При этом более активный металл вытесняет менее активный из его оксида. Для сравнения активности металлов следует использовать электрохимический ряд напряжения металлов.
6) вытеснение летучих оксидов из солей менее летучими
Источник
