Какое свойство характерно для щелочных металлов

Щелочными металлами называются химические элементы-металлы (IA) группы Периодической системы Д. И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы (IA) характерна степень окисления (+1).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия (NaCl)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 (·) 10H2O,
- сильвин — хлорид калия (KCl),
- сильвинит — двойной хлорид калия-натрия (KCL) (·)(NaCl) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами (IA) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2H2O=2NaOH+H2↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод ((–)): 2Na++2e=2Na,
анод ((+)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
Источник
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за
их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционной способности. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li – 2s1
- Na – 3s1
- K – 4s1
- Rb – 5s1
- Cs – 6s1
- Fr – 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl – галит (каменная соль)
- KCl – сильвит
- NaCl*KCl – сильвинит

Получение
Получить такие активные металлы электролизом водного раствора – невозможно. Для их получения применяют электролиз расплавов при
высоких температурах (естественно – безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Реакции с неметаллами
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид,
натрий – пероксид, калий, рубидий и цезий – супероксиды.
Li + O2 → Li2O (оксид лития)
Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления
+1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда – взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH – натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: “… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет”.
Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий – в желтый, калий – в фиолетовый, рубидий – синевато-красный,
цезий – синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
Li + O2 → Li2O (оксид лития)
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из
пероксида, так и из супероксида, при желании можно получить оксид:
Na2O2 + Na → Na2O
KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание – реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание – мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам – растворимым основаниям. Наиболее известные представители: NaOH – едкий натр, KOH – едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции
щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде – хлор)
Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
K + H2O → KOH + H2↑
Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется
газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке – получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке – получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 – получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 – получается средняя соль)
NaOH + MgBr2 → NaBr + Mg(OH)2↓
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием оксиелов –
смешанных оксидов (при высоких температурах – прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется оксиел – смесь двух оксидов: Al2O3
и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
Подобная схема универсальная для брома и для йода. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO + NaI + H2O (без нагревания)
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам – и азотной,
и азотистой.
LiOH + NO2 → LiNO2 + LiNO3 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Щелочные металлы.
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Далее таблица свойств щелочных металлов:
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов: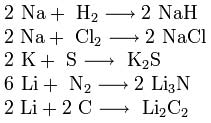
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li+ + e → Li
анод: 2Cl- — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na+ + e → Na
анод: 4OH- — 4e → 2H2O + O2
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Источник
Щелочные металлы.
К щелочным металлам относятся литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
Щелочные металлы
Строение атомов щелочных металлов
Физические свойства щелочных металлов
Химические свойства щелочных металлов
Щелочные металлы:
Щелочные металлы – это химические элементы 1-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации – элементы главной подгруппы I группы):
– литий Li,
– натрий Na,
– калий K,
– рубидий Rb,
– цезий Cs,
– франций Fr.
При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
Строение атомов щелочных металлов:
Особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Щелочные металлы относятся к элементам s-семейства.
Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия – самый низкий) и электроотрицательности. Как следствие, в большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.
Так, электронная конфигурация атома лития 1s2 2s1. атом лития состоит из положительно заряженного ядра (+3), вокруг которого по атомным оболочкам (двум s-орбиталям) движутся три электрона. Поскольку литий расположен во втором периоде, оболочки всего две, одна из которых является внешней. При этом 2 электрона находятся на внутреннем уровне, а 1 электрон – на внешнем. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома цезия на 2s-орбитали находятся один неспаренный электрон. Электроны, расположенные на внешней оболочке, называются валентными и участвуют в образовании химических связей. В свою очередь ядро атома лития состоит из трех протонов и четырех нейтронов.
Радиус атома лития составляет 145 пм. Потенциал ионизации (первый электрон) атома лития равен 5,39 эВ (519,9 кДж/моль). Электроотрицательность атома лития равна 0,98 (шкала Полинга).
Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1. Атом натрия состоит из положительно заряженного ядра (+11), вокруг которого по трем оболочкам движутся 11 электронов. При этом 10 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку натрий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома натрия – на 3s-орбитали находится один неспаренный электрон. В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов.
Радиус атома натрия составляет 190 пм. Потенциал ионизации атома натрия равен 5,14 эВ (495,6 кДж/моль). Электроотрицательность атома натрия равна 0,93 (шкала Полинга).
Электронная конфигурация атома калия 1s2 2s2 2p6 3s2 3p6 4s1. Атом калия состоит из положительно заряженного ядра (+19), вокруг которого по четырем оболочкам движутся 19 электронов. При этом 18 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку калий расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома калия – на 4s-орбитали находится один неспаренный электрон. В свою очередь ядро атома калия состоит из 19 протонов и 20 нейтронов.
Радиус атома калия составляет 235 пм. Потенциал ионизации атома калия равен 4,34 эВ (418,5 кДж/моль). Электроотрицательность атома калия равна 0,82 (шкала Полинга).
Электронная конфигурация атома рубидия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1. Атом рубидия состоит из положительно заряженного ядра (+37), вокруг которого по пяти оболочкам движутся 37 электронов. При этом 36 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку рубидий расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома рубидия на 5s-орбитали находится один неспаренный электрон. В свою очередь ядро атома рубидия состоит из 37 протонов и 48 нейтронов.
Радиус атома рубидия составляет 248 пм. Потенциал ионизации атома рубидия равен 4,17 эВ (402,8 кДж/моль). Электроотрицательность атома рубидия равна 0,82 (шкала Полинга).
Электронная конфигурация атома цезия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s1. Атом цезия состоит из положительно заряженного ядра (+55), вокруг которого по шести оболочкам движутся 55 электронов. При этом 54 электрона находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку цезий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и пятая – внутренние оболочки представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома цезия на 6s-орбитали находятся один неспаренный электрон. В свою очередь ядро атома цезия состоит из 55 протонов и 78 нейтронов.
Радиус атома цезия составляет 267 пм. Потенциал ионизации атома цезия равен 3,89 эВ (375,5 кДж/моль). Электроотрицательность атома цезия равна 0,79 (шкала Полинга).
С увеличением порядкового номера у щелочных металлов увеличиваются радиус атома, способность отдавать валентные электроны и восстановительная активность, уменьшается электроотрицательность и энергия ионизации.
Физические свойства щелочных металлов:
Все щелочные металлы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень легкие, мягкие и пластичные, их можно резать скальпелем и ножом. Щелочные металлы имеют небольшую плотность. Так, литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. Щелочные металлы обладают высокой тепло- и электропроводностью. Они имеют низкую температуру плавления и кипения.
С увеличением порядкового номера у щелочных металлов уменьшаются плотность, температура плавления, температура кипения, твердость.
Химические свойства щелочных металлов:
Все щелочные металлы обладают высокой химической активностью. Они проявляют высокую химическую активность при взаимодействии с водой, кислородом, галогенами и другими соединениями. Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. В соединениях щелочные металлы проявляют единственную степень окисления +1. Все соединения щелочных металлов носят ионный характер. Почти все соединения растворимы в воде.
С увеличением порядкового номера у щелочных металлов усиливаются металлические свойства и ослабевают неметаллические свойства, увеличивается восстановительная способность, возрастает химическая активность их щелочей.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
504
Источник
