Какое свойство вещества медь

 Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.

2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.

Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды – это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.

Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Источник

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
СТРУКТУРА
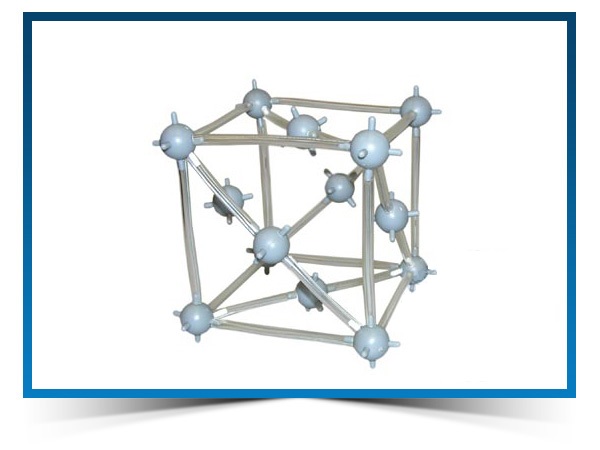
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура — кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ

Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Медь (англ. Copper) — Cu
| Молекулярный вес | 63.55 г/моль |
| Происхождение названия | От греческого «Kyprium», то есть «кипрский металл», по названию острова Кипр |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.1
| Strunz (8-ое издание) | 1/A.01-10 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.1.3 |
| Dana (8-ое издание) | 1.1.1.3 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | медно-красный, тускнеющий в черный или зеленый на воздухе |
| Цвет черты | медно-красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2,5-3 |
| Прочность | ковкий |
| Излом | зазубренный |
| Плотность (измеренная) | 8.94 — 8.95 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Цвет в отраженном свете | розовато-белый |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — гексоктаэдрический |
| Пространственная группа | Fm3m (F4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 3.615Å |
| Морфология | кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные |
| Двойникование | Двойники по {111} по шпинелевому закону |
mineralpro.ru
28.07.2016
Источник
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения. Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Медный слиток
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь. Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет. Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Халькопирит
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Самородная медь
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения. Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
Оттенки медных сплавов
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа. В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Бухты медной проволоки
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами. Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
Шина электротехническая медная
Оценка статьи:
Загрузка…
Источник
