Какое свойство водорода отражено в его названии

ВикиЧтение
Новейшая книга фактов. Том 3 [Физика, химия и техника. История и археология. Разное]
Кондрашов Анатолий Павлович
Какие свойства водорода и кислорода отражены в их названиях?
Что водород (Н) является химическим элементом, установил французский химик Антуан Лоран Лавуазье (1743–1794). Он же дал этому элементу современное название «гидроген», что в переводе с греческого означает «рождающий воду». Современное русское наименование «водород» предложил в 1824 году М. Ф. Соловьев. Название кислороду (O) дал тоже Лавуазье. Поскольку кислород входит в состав кислот, Лавуазье назвал его «оксиген», то есть «образующий кислоты»; отсюда и русское название «кислород».
Данный текст является ознакомительным фрагментом.
Читайте также
Какие свойства водорода и кислорода отражены в их названиях?
Какие свойства водорода и кислорода отражены в их названиях?
Что водород (Н) является химическим элементом, установил французский химик Антуан Лоран Лавуазье (1743–1794). Он же дал этому элементу современное название «гидроген», что в переводе с греческого означает
ОТКРЫТИЕ КИСЛОРОДА
ОТКРЫТИЕ КИСЛОРОДА
Удивительно, но кислород был открыт несколько раз. Первые сведения о нем встречаются уже в VIII веке в трактате китайского алхимика Мао Хоа. Китайцы представляли себе, что этот газ («йын») — составная часть воздуха, и называли его «деятельным началом»!
Как в названиях московских церквей отразилась их история?
Как в названиях московских церквей отразилась их история?
Обычно название церкви указывает на особенность места, где она находится, и на имя святого, которому она посвящена. В городах это название урочищ и улиц, а в деревнях – особенность места. Например, церковь Спаса
Почему в земной атмосфере так мало водорода и гелия?
Почему в земной атмосфере так мало водорода и гелия?
Атомы и молекулы в воздухе пребывают в постоянном движении. Средняя скорость молекул кислорода в воздухе при комнатной температуре составляет около 0,5 километра в секунду. Молекула водорода, которая в 16 раз легче,
Подача увлажненного кислорода
Подача увлажненного кислорода
Подачу кислорода для вдыхания с лечебной целью осуществляют с помощью маски или носового катетера. В стационарах для подачи кислорода используют централизованные системы. При оказании неотложной помощи выполняют подачу кислорода из
Средства, повышающие доставку кислорода к миокарду
Средства, повышающие доставку кислорода к миокарду
Дипиридамол (Dipyridamolum)Синонимы: Курантил, Персантин, Anginal, Antistenocardin, Apricor, Cardioflux, Coribon, Corosan, Coroxin, Curantyl, Dilcor, Dipiridamole, Dirinol, Novodil, Padicor, Peridamol, Persantin, Stenocardil, Trancocard, Vadinar, Viscor и др.В основном применяют как антиагрегационное средство для
Средства, понижающие потребность и повышающие доставку кислорода к миокарду
Средства, понижающие потребность и повышающие доставку кислорода к миокарду
Нитраты и нитриты
Нитроглицерин (Nitroglycerinum)Синонимы: Angibid, Angiolingual, Angised, Angorin, Glyceryl trinitrate, Myoglycerin, Nitrangin, Nitrocardiol, Nitroglycerol, Nitroglyn, Nitromint, Nitrostat, Nitrozell, Trinitrin, Trinitroglycerol, Trinitrol и др.Для применения в медицинской
Подача кислорода при помощи кислородной подушки
Подача кислорода при помощи кислородной подушки
Последовательность выполнения процедуры:1) взять заполненную кислородную подушку, мундштук, влажную марлевую салфетку;2) психологически подготовить пациента к манипуляции, помочь пациенту принять удобное полусидячее
Подача кислорода при помощи кислородной подушки
Подача кислорода при помощи кислородной подушки
Последовательность выполнения процедуры:
1) взять заполненную кислородную подушку, мундштук, влажную марлевую салфетку;
2) психологически подготовить пациента к манипуляции, помочь пациенту принять удобное полусидячее
К чему приводит недостаток кислорода в водоеме
К чему приводит недостаток кислорода в водоеме
Основная проблема, которая больше всего беспокоит рыбоводов-любителей зимой, – это недостаток кислорода в воде. Именно это является причиной гибели ценных пород рыбы. Следует отметить, что уменьшение содержания кислорода
Немного о названиях планет и других тел солнечной системы. Мифология
Немного о названиях планет и других тел солнечной системы. Мифология
Меркурий
А знаете ли вы, что Меркурий – это бог-покровитель в древнеримской мифологии. Его атрибуты – это жезл кадуцей, крылатый шлем, сандалии и, конечно, денежный мешочек. Культ Меркурия стал
Источник
Водород — это самый лёгкий и самый распространённый химический элемент. В наше время каждый слышал о нём, а ведь совсем недавно он представлял из себя великую тайну даже для лучших учёных. Согласитесь, этого достаточно, чтобы узнать побольше о химическом элементе водород.
Водород: распространение в природе
Как мы уже сказали выше, водород — это самый распространенный элемент. Причем не только на Земле, но и во всей Вселенной! Солнце почти наполовину состоит из этого химического элемента, да и большинство звёзд имеют в своей основе водород. В межзвездных пространствах водород также является самым распространенным элементом. На Земле водород находится в виде соединений. Он входит в состав нефти, газов, даже живых организмов. Мировой Океан содержит около 11% водорода по массе. В атмосфере его совсем немного, всего около 5 десятитысячных процента.
История открытия водорода
О существовании водорода догадывались ещё средневековые алхимики. Так, Парацельс в своих трудах указывал, что при действии кислоты и железа выделяются пузырьки «воздуха». Но что это за «воздух» он понять не мог. В те времена учёные думали, что в каждом горючем веществе есть какая-то мистическая огненная составляющая, которая поддерживает горение. Эта догадка получила название теории «флогистона». Алхимики считали, например, что дерево состоит из пепла, который остается после сжигания, и флогистона, который освобождается при горении.
Впервые же свойства водорода изучили английские химики Генри Кавендиш и Джозеф Пристли в XVIII веке. Но и они полностью не осознали сути своего открытия. Они думали, что легкий газ (а водород легче воздуха в 14 раз) есть ни что иное как мистический флогистон.
И только Антуан Лавуазье доказал, что водород это никакой не флогистон, а самый настоящий химический элемент. Во время своих опытов он сумел получить водород из воды и затем доказал, что обратно вода получается при горении водорода. Поэтому этот химический элемент и получил такое название — «рождающий воду».
Химические свойства водорода
Водород самый первый химический элемент, в таблице Менделеева обозначается символом H. Представляет собой легкий газ без запаха и цвета. Твердый водород – самое легкое твердое вещество, а жидкий — самая лёгкая жидкость. К тому же жидкий водород при попадании на кожу может вызвать сильнейшее обморожение. Атомы и молекулы водорода – самые маленькие. Поэтому то воздушный шарик, надутый этим газом, очень быстро сдувается — водород просачивается через резину. При смешении водорода с кислородом воздуха образуется очень взрывоопасная смесь. Она называется «гремучий газ».
При вдыхании газа частота голоса становится намного выше обычной. Например, мужской грубый бас будет похож на голоса Чипа и Дейла. Однако, подобные химические опыты проводить не стоит, по причине указанной выше. Водород и кислород образуют гремучий газ, который при выдохе может легко взорваться!
Применение водорода
Несмотря на свою горючесть, водород широко используется во многих отраслях промышленности. В основном его используют при производства аммиака для минеральных удобрений и при производстве спирта и пластмассы. Когда-то водородом наполняли дирижабли и воздушные шары, этот легкий газ поднимал их в воздух совершенно без труда. Но сейчас в авиации и космической технике он используется только в качестве топлива для космических ракет. Созданы двигатели для автомобилей, работающие на водороде. Они самые экологически чистые, ведь при сгорании выделяется только вода. Однако на данный момент водородные двигатели имеют ряд существенных недостатков, не отвечаю в полной мере требованиям безопасности, поэтому их применение пока совершенно ничтожно. В пищевой промышленности водород используется при производстве маргарина, а также для упаковки продуктов. Он даже зарегистрирован в качестве пищевой добавки E949. В энергетике водород применяется для охлаждения генераторов и для выработки электроэнергии в водородно-кислородных топливных элементах.
Водород как источник энергии
Ресурс https://www.alto-lab.ru.
Спасибо за просмотр ставьте лайк и подписывайтесь!
Источник
Если кислород является самым распространенным химическим элементом на Земле, то водород – самый распространенный элемент во всей Вселенной. Наше Солнце (и другие звезды) примерно на половину состоит из водорода, а что касается межзвездного газа, то он на 90% состоит из атомов водорода. Немалое место этот химический элемент занимает и на Земле, ведь вместе с кислородом он входит в состав воды, а само его название «водород» происходит от двух древнегреческих слов: «вода» и «рожаю». Помимо воды водород присутствует в большинстве органических веществ и клеток, без него, как и без кислорода, была бы немыслима сама Жизнь.
История открытия водорода
Первым среди ученых водород заметил еще великий алхимик и лекарь средневековья Теофраст Парацельс. В своих алхимических опытах, в надежде отыскать «философский камень» смешивая металлы с кислотами Парацельс получил некий неизвестный до того горючий газ. Правда отделить этот газ от воздуха так и не удалось.
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.
В 1766 году Кавендишу удалось получить чистый водород, который он называл «горючим воздухом». Еще через 20 лет талантливый французский химик Антуан Лавуазье смог синтезировать воду и выделить из нее этот самый «горючий воздух» – водород. И к слову именно Лавуазье предложил водороду его название – «Hydrogenium», он же «водород».

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Водород в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы водорода
Водород это газ, молекула его состоит из двух атомов.
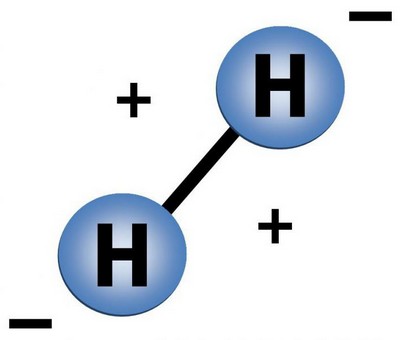
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства водорода
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства водорода
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить водород?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Применение водорода
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Водород, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Химические свойства
водорода
При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами.
Водород вступает в реакции с простыми и сложными веществами:

– Взаимодействие водорода с металлами приводит к образованию сложных веществ – гидридов, в химических формулах которых атом металла всегда стоит на первом месте:

При высокой температуре Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя белые кристаллические вещества – гидриды металлов (LiН, NaН, КН, СаН2 и др.):
Н2 + 2Li = 2LiH
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
– При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ (см. табличку в слайде):

1). С кислородом
Водород образует воду:
Видео “Горение водорода”
2Н2 + О2 = 2Н2О + Q
При обычных температурах реакция протекает крайне
медленно, выше 550°С – со взрывом (смесь
2 объемов Н2 и 1 объема О2 называется гремучим газом).
Видео “Взрыв гремучего газа”
Видео “Приготовление и взрыв гремучей смеси”
2). С галогенами
Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl
При этом с фтором Водород взрывается (даже в темноте и
при – 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а
с йодом только при нагревании.
3). С азотом
Водород взаимодействует с образованием аммиака:
ЗН2 + N2 = 2NН3
лишь на катализаторе и при повышенных температуpax и
давлениях.
4). При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород),
значительно труднее с селеном и теллуром.
5). С чистым
углеродом Водород может реагировать без катализатора только при высоких
температуpax:
2Н2 + С (аморфный) = СН4 (метан)
– Водород вступает в реакцию замещения с оксидами металлов, при этом образуются в продуктах вода и восстанавливается металл. Водород – проявляет свойства восстановителя:

Водород используется для восстановления многих металлов, так как отнимает кислород у их
оксидов:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe +
4Н2О, и т. д.
Применение
водорода
Видео “Применение водорода”
В настоящее время водород получают в огромных
количествах. Очень большую часть его используют при синтезе аммиака,
гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме
того, водород применяют для синтеза соляной кислоты, метилового спирта,
синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп
накаливания и драгоценных камней. В продажу водород поступает в баллонах под
давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной
надписью “Водород”.
Водород используется для
превращения жидких жиров в твердые (гидрогенизация), производства жидкого
топлива гидрогенизацией углей и мазута. В металлургии водород используют как
восстановитель оксидов или хлоридов для получения металлов и неметаллов
(германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода
многообразно: им обычно заполняют шары-зонды, в химической промышленности он
служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в
пищевой – для выработки из растительных масел твёрдых жиров и т. д. Высокая
температура (до 2600 °С), получающаяся при горении водорода в кислороде,
используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород
является одним из наиболее эффективных реактивных топлив. Ежегодное мировое
потребление водорода превышает 1 млн. т.
ТРЕНАЖЕРЫ
№1. Химические свойства водорода
№2. Водород
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Составьте уравнения реакций взаимодействия водорода со следующими веществами: F2, Ca, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций.
Задание №2
Осуществите превращения по схеме:
H2O -> H2 -> H2S -> SO2
Задание №3.
Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
Источник
