Какое свойство воды использует человек при получение соли

Слайд 1
Влияние соли на свойства воды.
Слайд 2
При растворении соли в воде свойства жидкости изменяются в зависимости от количества растворённого вещества. Гипотеза.
Слайд 3
Опытным путём выяснить , каким образом разное количество соли изменяет свойства воды. Цель работы.
Слайд 4
1.Изучив литературу ,получить информацию о веществах «соль» и «вода», узнать о физических свойствах воды. 2.Познакомиться с понятием «растворы». 3.Подготовить и провести опыты по растворению разного количества соли в воде. 4.Провести наблюдения за изменением свойств воды в зависимости от количества растворённой в ней соли. 5.Обобщить результаты опытов и сделать выводы. Задачи.
Слайд 5
Наблюдение Сравнение Опыт Анализ Индукция Обобщение Методика.
Слайд 6
2 стеклянные трёхлитровые банки; мерные ёмкости для жидкости и для сыпучих продуктов. ложка и деревянная лопатка для соли перемешивания раствора. 2 одинаковые картофелины секундомер жаростойкая посуда термометр для кухни э малированная кружка д еревянная дощечка т ри одинаковых пластиковых стаканчика м орозильная камера г азовая горелка Оборудование.
Слайд 7
Соль и вода . В повседневной жизни мы часто сталкиваемся с этими веществами . Без них человек прожить не может. А как они взаимодействуют друг с другом . Как соль влияет на воду , и можно ли это использовать в быту . Этому и посвящена исследовательская работа. Введение.
Слайд 8
Поваренная соль (хлорид натрия, NaCl ; употребляются также названия «хлористый натрий», «столовая соль», «каменная соль», «пищевая соль» или просто «соль») — пищевой продукт. В молотом виде представляет собой мелкие кристаллы белого цвета. Растворима в воде. Соль. Подробнее о привычном.
Слайд 9
Вода-оксид водорода – одно из распространенных и важных веществ. Все химические превращения на Земле происходят с участием воды или в растворах. Чистая вода существует в трех агрегатных состояниях: твердом , жидком, газообразном . Чистая вода прозрачна, не имеет запаха и вкуса. Вода плохо проводит теплоту и очень плохо проводит электричество . Вода – хороший растворитель. Вода – важнейшее вещество на земле.
Слайд 10
Соль + вода =раствор Раствор — однородная смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. Концентрированный раствор — раствор с высоким содержанием растворённого вещества . Разбавленный раствор — раствор с низким содержанием растворённого вещества. Взаимодействие соли и воды ( о растворе и виды растворов ).
Слайд 11
Наблюдение за растворением разного количества соли в воде и за поведением тела, погруженного в раствор. Брали две трёхлитровые банки, наливали в них по 2 л воды. Погружали в обе картофель. В банку № 2 насыпали соль . Наблюдали. Количество соли, г Изменения , происходящие с жидкостью и телом в банке № 2. 10 Соль растворяется в воде, жидкость мутнеет , картофель на дне. 20 Жидкость мутнеет ещё больше, картофель на дне. 30 – 150 Изменений нет. 160 Картофель оторвался от дна и стал подниматься наверх.
Слайд 12
Брали 3 пластиковых стаканчика с 50 г воды. Растворяли в стакане №2 10 г соли , в стакане №3 20 г соли ; в стакане №1 вода пресная. Выносили стаканы на улицу и помещали в морозильную камеру и наблюдали. Исследование замерзания воды с разным количеством соли. Температура воздуха Стакан № 1 (пресная вода) Стакан № 2(10г соли на 100 мл воды) Стакан № 3 (20 г соли на 100 мл воды) – 4 ° С замёрзла не замёрзла не замёрзла – 8 ° С замёрзла замёрзла не замёрзла – 16 ° С замёрзла замёрзла замёрзла
Слайд 13
Нагревали в жаропрочной посуде по 1 л пресной воды, с 20 г соли , с 100 г соли по очереди. Замеряли время секундомером и сравнивали. Влияние соли на нагревание воды. Показания термометра, градусы С Время нагревания пресной воды, с Время нагревания соленой воды ( 20 г соли на литр воды),с Время нагревания соленой воды (100 г соли на литр воды),с 100 772 806 758
Слайд 14
Брали литровую эмалированную кружку, накладывали снег (половину объёма кружки). Растворяли соль в снегу (начинали с 10 г) и наблюдали. Как с помощью соли можно приморозить кружку к столу. Количество соли, г Описание наблюдений. 10 Снег начинает таять, кружка чуть прилипает к доске. 20 Снег тает ещё больше, кружка прилипла к доске. 30 Вокруг кружки начинает образовываться лёд. 40 Снег почти растаял, лёд стал ещё больше . 50 Снег растаял, лёд ещё больше. 60 Поверхность льда увеличилась.
Слайд 15
Соль, растворяясь в воде, изменяет свойства жидкости. Тело, погружённое в растворы соли разной концентрации ведёт себя по–разному. Соль, растворенная в воде в больших количествах, не дает телу, погруженному в раствор, утонуть. Количество соли, растворённое в воде, влияет на температуру замерзания воды. Чем больше соли, тем ниже температура, при которой вода замерзает. Соль , растворяясь в воде, влияет на нагревание жидкости, но не значительно. Раствор соли ( 20 г соли на литр воды) нагревался до 100 ̊С на 24 секунды медленнее пресной воды, а раствор соли более концентрированный (100 г соли на литр воды) нагрелся до указанной температуры на 14 секунд быстрее воды без соли. Определенное количество соли (более 20 г) при растворении в кружке со снегом вызывает замерзание воды под кружкой при комнатной температуре. Соль, растворяя снег, охлаждает раствор. Это вызывает понижение температуры воды вокруг кружки и приводит к её замерзанию. Выводы о влиянии соли на воду в зависимости от количества растворенного вещества .
Источник
Вопрос 1. Какие вещества называют неорганическими?
Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим).
Вопрос 2. Какие известные вам организмы содержат много воды?
Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др.
Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему?
Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д.
Вопрос 4. Какие неорганические вещества содержатся в живых организмах?
Вода, соли минеральных кислот и соответствующие катионы и анионы.
Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи?
Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода.
Вопрос 6. Какие химические связи называют водородными?
Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях?
Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя.
Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны?
Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле.
Вопрос 9. Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.


Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах.
При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке.
Сахар — это интересно, экологично, но скорее всего дорого.
Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду.
1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала.
2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов.
Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ?
Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
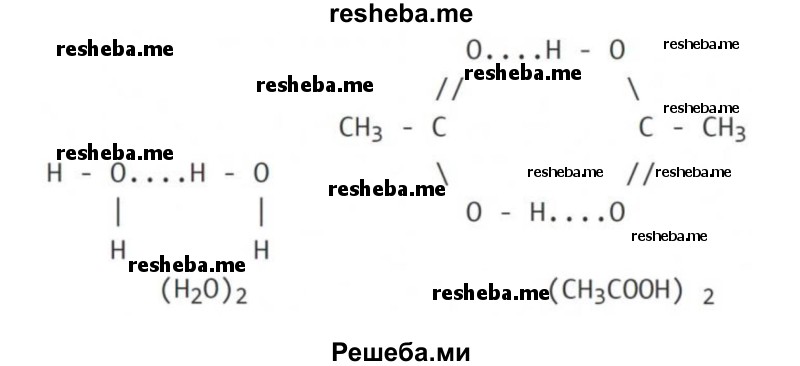
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её?
От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки. Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (H2S) — газ.
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом:
Атмосферное давление 101325 Па = 760 мм рт. ст.
Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта).
Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины.
Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Вода (Н20) — это жидкость, а сероводород (H2S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода. Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Источник
