Какое свойство железа не связано с его применением
Железо – химический элемент четвертого периода и побочной подгруппы VIII группы периодической системы. Атом железа содержит восемь валентных электронов, однако в соединениях железо обычно проявляет степени окисления (+2) и (+3), редко – (+6). Имеются сообщения о получении соединений восьмивалентного железа.
Степень окисления +3 для железа является наиболее устойчивой. Соединения железа(III) могут быть восстановлены только под действием сильных восстановителей, таких как водород в момент выделения, сероводород. Эти реакции проводят в кислой среде:
$Fe_2(SO_4)_3 + H_2S = 2FeSO_4 + S + H_2SO_4$
Железо широко распространено в природе – это самый распространенный металл, после алюминия. Существует гипотеза о том, что внутреннее ядро Земли – целиком состоит из железа с примесью никеля и серы, а возможно и других элементов.
В природе железо встречается в виде руд – оксидов Fe$_2$O$_3$ (гематит, красный железняк) и Fe$_3$O$_4$ (магнетит, магнитный железняк), гидратированного оксида Fe$_2$O$_3 cdot$H$_2$O (лимонит, бурый железняк), карбоната FeCO$_3$ (сидерит), дисульфида FeS2 (пирит), редко встречается в виде самородков, попадающих на землю с метеоритами. Такое метеоритное железо было известно людям издревле. Освоение получения железа из железной руды послужило началом железного века.
Получение железа
В настоящее время железную руду восстанавливают коксом в доменных печах, при этом расплавленное железо частично реагирует с углеродом, образуя карбид железа Fe3C (цементит), а частично растворяет его. При затвердевании расплава образуется чугун. Чугун, используемый для получения стали, называют передельным.
Запомнить! Сталь, в отличие от чугуна, содержит меньшее количество углерода.
При получении стали, лишний углерод, содержащийся в чугуне, необходимо выжечь. Этого добиваются, пропуская над расплавленным чугуном воздух, обогащенный кислородом. Существует и прямой метод получения железа, основанный на восстановлении окатышей магнитного железняка природным газом:
Fe$_3$O$_4$ + CH$_4$ = 3Fe + CO$_2$ + 2H$_2$O
Физические свойства
Железо – серебристо-белый, ковкий и пластичный тугоплавкий (т. пл. 1535°C, т. кип. 2870°C) металл, при температурах ниже 769°C притягивается магнитом, то есть обладает ферромагнетизмом. Ферромагнитные свойства вызваны наличием в структуре металла отдельных зон – доменов, магнитные моменты которых под действием внешнего магнитного поля ориентируются в одну и ту же сторону. Железо существует в форме нескольких полиморфных (аллотропных) модификаций. При температурах ниже $910^0C$ устойчиво железо с объемно-центрированной кристаллической решеткой ($alpha$-Fe, немагнитное α-железо существующее при $769 – 910^0C$ называют β-Fe), в интервале температур $910 – 1400^0C$ – более плотная модификация с кубической гранецентрированной ($gamma$-Fe), а выше этой температуры и вплоть до температуры плавления вновь становится устойчивой структура с объемно-центрированной ячейкой (δ-Fe).
Химические свойства железа
Запомнить!
Степень окисления +2 железо проявляет при взаимодействии со слабыми окислителями: серой, йодом, соляной кислотой, растворами солей.
Степень окисления +3 железо проявляет при взаимодействии с сильными окислителями: хлором, бромом.
Смешанную степень окисления железо проявляет при взаимодействии с кислородом, водяным паром.
1) с кислотами. На влажном воздухе окисляется, покрываясь коричневой коркой гидратированного оксида Fe$_2$O$_3 cdot $H$_2$O, ржавчины. Железо легко растворяется в разбавленных кислотах:
Fe + 2HCl = FeCl$_2$ + H$_2$
но пассивируется в холодных концентрированных растворах кислот-окислителях – серной и азотной.
2) с солями.Будучи металлом средней химической активности, железо вытесняет другие, менее активные металлы из растворов их солей:
Fe + CuSO$_4$ = FeSO$_4$ + Cu
При этом, как и при растворении в кислотах, образуются соли двухвалентного железа.
3) с парами воды.При температуре белого каления железо реагирует с водой. Пропуская перегретый водяной пар через раскаленный на жаровне чугунный пушечный ствол, Лавуазье получил водород:
3Fe + 4H$_2$O = Fe$_3$O$_4$ + 4H$_2$.
4) с кислородом.В кислороде железо сгорает с образованием черyого порошка железной окалины – оксида железа(II, III) Fe$_3$O$_4$,имеющей тот же состав, что и природный минерал магнитный железняк^
3Fe + 2O$_2$ = Fe$_3$O$_4$
Искры, вырывающиеся при заточке стальных ножей или при резке стальных листов ацетилено-кислородным пламенем , также представляют собой раскаленные куски железной окалины.
5) с неметаллами. Степень окисления железа в образующихся соединениях зависит от силы окислителя – неметалла. Так, при взаимодействии с хлором образуется хлорид FeCl$_3$:
2Fe + 3Cl$_2$ = 2FeCl$_3$,
с серой – сульфид FeS:
Fe + S = FeS.
Соединения железа(II)
Запомнить! Оксид и гидроксид железа(II) обладают основными свойствами.
Соединения железа(II) являются сильными восстановителями и на воздухе легко окисляются до соединений трехвалентного железа:
4FeSO$_4$ + O$_2$ + 2H$_2$O = 4Fe(OH)SO$_4$.
Белый осадок гидроксида железа(II) Fe(OH)2, образующийся при действии на соли железа(II) растворов щелочей, на воздухе мгновенно зеленеет, образуя «зеленую ржавчину» – смешанный гидроксид железа(II) и железа(III), который лишь через некоторое время приобретает характерный для Fe$_2$O$_3 cdot$H$_2$O ржавый цвет.
Соединения железа(III)
Гидроксид железа(III) выпадает в виде коричневого осадка при действии растворов щелочей, сульфидов, карбонатов на соли железа(III):
2FeCl$_3$ + 3Na$_2$CO$_3$ + 6H$_2$O = 2Fe(OH)$_3^-$ +3CO$_2$+ 6NaCl
Запомнить! Оксид и гидроксид железа(III) являются слабо амфотерными, с преобладанием основных свойств.
Так, при растворении гидроксида железа(III) в кислотах образуются соли железа(III), а при сплавлении оксида с оксидами активных металлов – ферриты (ферраты(+3)):
2Fe(OH)$_3$ + 2H$_2$SO$_4$ = Fe$_2$(SO$_4$)$_3$ + 3H$_2$O,
Fe$_2$O$_3$ + CaO = CaFe$_2$O$_4$.
В концентрированных щелочах Fe(OH)$_3$ медленно растворяется, образуя гидроксоферраты, например, Na$_3$[Fe(OH)$_6$]:
$Fe(OH)_3 + 3NaOH_{textrm{водн.}} =Na_3[Fe(OH)_6]$
При действии недостатка кислот они разлагаются в образованием осадка гидроксида железа(III):
$Na_3[Fe(OH)_6] + 3HCl_{textrm{нед.}} =3NaCl + Fe(OH)_3downarrow +3H_2O$
$Na_3[Fe(OH)_6] + 6HCl_{textrm{изб.}} =3NaCl + FeCl_3 +6H_2O$
При пропускании углекислого газа они разлагаются на гидроксид железа(III) и карбонат натрия:
$2Na_3[Fe(OH)_6] + 3CO_2uparrow=3Na_2CO_3 + 2Fe(OH)_3downarrow +3H_2O$
Запомнить! Соли железа(III) и некоторых слабых кислот, например, сернистой и угольной не могут быть выделены из водных растворов по причине полного необратимого гидролиза
$2FeCl_3 + 3Na_2CO_3 + 3H_2O = 2Fe(OH)_3 +3CO_2uparrow + 6NaCl$
О протекании реакции судят по выделению газа и образованию коричневого осадка гидроксида железа(III).
Окисление Fe(OH)3 бромом в щелочной среде приводит к образованию вишневых растворов ферратов (+6):
2Fe(OH)$_3$ + 3Br$_2$ + 10KOH = 2K$_2$FeO$_4$ + 6KBr + 8H$_2$O.
Запомнить! Ферраты содержат железо в степени окисления (+6), и являются сильными окислителями.
Применение железа
В виде чугуна и стали железо находит широкое применение в народном хозяйстве. Хлорид железа(III) используется при травлении медных плат, а сульфат железа(III) – в качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели применяют в радиоэлектронике, вычислительной технике.
Соли железа(III) образуют желто-коричневые растворы, цвет которых объясняется гидролизом, приводящим к образованию коллоидного раствора гидроксида железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках, отсыревают.
Качественные реакции на катионы железа

На ионы железа существуют удобные качественные реакции. Если к раствору соли железа(III) прибавить разбавленный раствор роданида калия KCNS, то образуется интенсивно-красное окрашивание, вызванное образованием роданида железа(III):
$FeCl_3 + 3KSCN= Fe(SCN)_3 + 3KCl$
Другим реагентом на ионы железа(III) служит комплексное соединение гексацианоферрат(II) калия $K_4[Fe(CN)_6]$, часто называемый также “желтая кровяная соль”. Такое странное на первый взгляд название связано с тем, что раньше эту соль получали нагреванием крови с поташом и железными опилками. С солями железа(III) она дает синий коллоидный раствор «берлинской лазури» или “турнбуллева синь”:
$K_4[Fe(CN)_6] + FeCl_3 = KFe[Fe(CN)_6] downarrow + 3KCl$
.
Аналогичное синие окрашивание осадка того же состава можно получить при взаимодействии ионов железа(II) с раствором “красной кровяной соли” – гексацианоферрат(III) калия $K_3[Fe(CN)_6]$:
$K_3[Fe(CN)_6] + FeCl_2 = KFe[Fe(CN)_6] downarrow + 2KCl$
.
Таким образом, красная кровяная соль служит реактивом на соли двухвалентного железа. При более высоких концентрациях растворов выделяется нерастворимая в воде форма «берлинской лазури» состава $Fe_4[Fe(CN)_6]_3$. Именно это вещество долгое время использовали при крашении тканей. При работе с кровяными солями следует помнить об их токсичности.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 9433735
Таня Масян
более месяца назад
Просмотров : 8
Ответов : 1
Лучший ответ:
Пармезан Черница
Б. серебристый цвет
////////////////////////////////////
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи за : неделю месяц все время
















Другие вопросы:
Суррикат Мими
Помогите!!! Укажите название государств,с которыми граничила Россия до 1533 года .а)Швеция,б) Астраханское ханство , в)Казанское ханство , г)Крымское ханство , д) Белоруссия , е)Украина, ж)Великое княжество Литовское , з) Ливонский орден. 2 вопрос. среди приведённых лиц укажите современников цар…
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Таня Масян
какие это страны помогите, напишите.
более месяца назад
Смотреть ответ
Просмотров : 1
Ответов :
Мари Умняшка
Из 1 т глинозёма, содержащего 95% оксида алюминия, получили 0,436 т алюминия. Каков процент выхода?
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Энджелл
Решите уравнение за 4 класс 234*4-y=458
более месяца назад
Смотреть ответ
Просмотров : 2
Ответов : 1
Энджелл
в коробке было 12карандашей, лена взяла 3 карандаша, за тем ещё 2. сколько осталось в каробке. реши двумя способами.
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
Источник
“Век девятнадцатый, железный,
Воистину жестокий век!
Тобою в мрак ночной, беззвездный
Беспечный брошен человек!”
Цели урока:
- сформировать представление о физических и
химических свойствах железа в зависимости от
проявляемой им степени окисления и природы
окислителя; - развивать теоретическое мышление учащихся и их
умения прогнозировать свойства вещества,
опираясь на знания о его строении; - развивать понятийное мышление таких операций,
как анализ, сравнение, обобщение, систематизация; - развивать такие качества мышления, как
объективность, лаконизм и ясность, самоконтроль
и активность.
Задачи урока:
- актуализировать знания учащихся по теме:
“Строение атома”; - организовать коллективную работу учащихся от
постановки учебной задачи до конечного
результата (составить опорную схему к уроку); - обобщить материал по теме: “Металлы” и
рассмотреть свойства железа и его применение; - организовать самостоятельную
исследовательскую работу в парах по изучению
химических свойств железа; - организовать взаимоконтроль учащихся на уроке.
Тип урока: изучение нового материала.
Реактивы и оборудование:
- железо (порошок, пластина, скрепка),
- сера,
- соляная кислота,
- сульфат меди (II),
- кристаллическая решетка железа,
- плакаты для игры,
- магнит,
- подборка иллюстраций по теме,
- пробирки,
- спиртовка,
- спички,
- ложка для сжигания горючих веществ,
- географические карты.
Структура урока
- Вводная часть.
- Изучение нового материала.
- Сообщение домашнего задания.
- Закрепление изученного материала.
Ход урока
1. Вводная часть
Организационный момент.
Проверка наличия учащихся.
Сообщение темы урока. Запись темы на доске и в
тетрадях учащихся.
2. Изучение нового материала
– Как вы думаете, как будет звучать тема нашего
сегодняшнего урока?
1. Появление железа в человеческой
цивилизации положило начало железному веку.
Откуда же древние люди брали железо в то
время, когда еще не умели добывать его из руды?
Железо в переводе с шумерского языка – это
металл, “капнувший с неба, небесный”. Первое
железо, с которым столкнулось человечество, было
железом из метеоритов. Впервые доказал, что
“железные камни падают с неба”, в 1775 г. русский
ученый П.С. Палас, который привез в Петербург
глыбу самородного железного метеорита весом 600
кг. Самым крупным железным метеоритом является
найденный в 1920 г. в Юго-Западной Африке метеорит
“Гоба” весом около 60 т. Вспомним гробницу
Тутанхамона: золото, золото. Великолепная работа
восхищает, блеск слепит глаза. Но вот что пишет
К.Керрам в книге “Боги, гробницы, ученые” о
маленьком железном амулете Тутанхамона: “Амулет
относится к числу наиболее ранних изделий
Египта, и …в гробнице, наполненной чуть ли не до
отказа золотом, именно эта скромная находка
имела наибольшую с точки зрения истории культуры
ценность”. Всего несколько железных изделий
было найдено в гробнице фараона, среди них
железный амулет бога Гора, небольшой кинжальчик
с железным клинком и золотой рукояткой,
маленькая железная скамеечка “Урс”.
Ученые предполагают, что именно страны Малой
Азии, где проживали племена хеттов, были местом
возникновения черной металлургии. В Европу
железо пришло из Малой Азии уже в I тыс. до н.э.; так
в Европе начался железный век.
Знаменитую булатную сталь (или булат) делали на
Востоке еще во времена Аристотеля (IV в. до н.э.). Но
технология ее изготовления держалась в секрете
много веков.
Мне приснилась иная печаль
Про седую дамасскую сталь.
Я увидел, как сталь закалялась,
Как из юных рабов одного
Выбирали, кормили его,
Чтобы плоть его сил набиралась.
Выжидали положенный срок,
А потом раскаленный клинок
В мускулистую плоть погружали,
Вынимали готовый клинок.
Крепче стали, не видел Восток,
Крепче стали и горше печали.
Поскольку булат – это сталь с очень большой
твердостью и упругостью, изготовленные из нее
изделия обладают способностью не тупиться,
будучи остро заточенными. Раскрыл секрет булата
русский металлург П.П. Аносов. Он очень медленно
охлаждал раскаленную сталь в специальном
растворе технического масла, подогретого до
определенной температуры; в процессе охлаждения
сталь ковалась.
(Демонстрация рисунков.)
2. Положение железа в ПСХЭМ.
Выясняем положение железа в ПСХЭМ, заряд ядра и
распределение электронов в атоме.
3. Физические свойства железа.
– Какие физические свойства железа вы знаете?
Железо – это серебристо-белый металл с
температурой плавления 1539оС. Очень
пластичный, поэтому легко обрабатывается,
куется, прокатывается, штампуется. Железо
обладает способностью намагничиваться и
размагничиваться, поэтому применяется в
качестве сердечников электромагнитов в
различных электрических машинах и аппаратах. Ему
можно придать большую прочность и твердость
методами термического и механического
воздействия, например, с помощью закалки и
прокатки.
Различают химически чистое и технически чистое
железо. Технически чистое железо, по сути,
представляет собой низкоуглеродистую сталь, оно
содержит 0,02 -0,04% углерода, а кислорода, серы, азота
и фосфора – еще меньше. Химически чистое железо
содержит менее 0,01% примесей. Химически чистое
железо – серебристо-серый, блестящий, по
внешнему виду очень похожий на платину металл.
Химически чистое железо устойчиво к коррозии
(вспомним, что такое коррозия? Демонстрация
коррозионного гвоздя) и хорошо сопротивляется
действию кислот. Однако ничтожные доли примесей
лишают его этих драгоценный свойств.
4. Химические свойства железа.
Исходя из знаний о химических свойствах
металлов, как вы думаете, какими химическими
свойствами будет обладать железо?
| +2 | +3 |
| Взаимодействие с неметаллами | |
| Fe + S= FeS | 2Fe +3CL2 = 2FeCL3 |
| С кислотами | |
| Fe + 2HCL= FeCL2 + H2 | |
| С солями | |
| Fe + CuSO4 = FeSO4 + Cu | |
| С водой | |
| 3 Fe + 4H2O (пары) = Fe3O4 + 4H2 | При температуре 700-900оС |
Демонстрация опытов.
- Взаимодействие железа с серой.
Практическая работа.
- Взаимодействие железа с соляной кислотой.
- Взаимодействие железа с сульфатом меди (II).
5. Применение железа.
Беседа по вопросам:
– Как выдумаете, каково распространение железа
в природе?
Железо – один из самых распространенных
элементов в природе. В земной коре его массовая
доля составляет 5,1%, по этому показателю оно
уступает только кислороду, кремнию и алюминию.
Много железа находится и в небесных телах, что
установлено по данным спектрального анализа. В
образцах лунного грунта, которые доставила
автоматическая станция “Луна”, обнаружено
железо в неокисленном состоянии.
Железные руды довольно широко распространены
на Земле. Названия гор на Урале говорят сами за
себя: Высокая, Магнитная, Железная. Агрохимики в
почвах находят соединения железа.
– В виде, каких соединений железо встречается в
природе?
Железо входит в состав большинства горных
пород. Для получения железа используют железные
руды с содержанием железа 30-70% и более. Основными
железными рудами являются: магнетит – Fe3O4
содержит 72% железа, месторождения встречаются на
Южном Урале, Курской магнитной аномалии; гематит
– Fe2O3 содержит до 65% железа, такие
месторождения встречаются в Криворожском
районе; лимонит – Fe2O3*nH2O
содержит до 60% железа, месторождения встречаются
в Крыму; пирит – FeS2 содержит примерно 47%
железа, месторождения встречаются на Урале.
(Работа с контурными картами).
– Какова роль железа в жизни человека и
растений?
Биохимики открыли важную роль железа в жизни
растений, животных и человека. Входя в состав
чрезвычайно сложно построенного органического
соединения, называемого гемоглобином, железо
обусловливает красную окраску этого вещества, от
которого в свою очередь, зависит цвет крови
человека и животных. В организме взрослого
человека содержится 3 г чистого железа, 75%
которого входит в состав гемоглобина. Основная
роль гемоглобина – перенос кислорода из легких к
тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в
состав цитоплазмы, участвует в процессе
фотосинтеза. Растения, выращенные на субстрате,
не содержащем железа, имеют белые листья.
Маленькая добавка железа к субстрату – и они
приобретают зеленый цвет. Больше того, стоит
белый лист смазать раствором соли, содержащей
железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в
соках и тканях – весело зеленеют листья растений
и ярко румянятся щеки человека.
Примерно 90% используемых человечеством
металлов – это сплавы на основе железа. Железа
выплавляется в мире очень много, примерно в 50 раз
больше, чем алюминия, не говоря уже о прочих
металлах. Сплавы на основе железа универсальны,
технологичны, доступны, дешевы. Железу еще долго
быть фундаментом цивилизации.
3. Сообщение домашнего материала
14, упр. № 6, 8, 9 (по рабочей тетради к учебнику О.С
Габриелян “Химия 9”, 2003 г.).
4. Закрепление изученного материала
- Используя опорную схему,
записанную на доске, сделайте вывод: что же
представляет собой железо и каковы его свойства? - Графический диктант (заранее приготовить
листочки с начерченной прямой, разделенной на 8
отрезков и пронумерованной соответственно
вопросам диктанта. Отметить шалашиком “^” на
отрезке номер положения, которое считается
верным).
Вариант 1.
- Железо – это активный щелочной металл.
- Железо легко куется.
- Железо входит в состав сплава бронзы.
- На внешнем энергетическом уровне атома железа 2
электрона. - Железо взаимодействует с разбавленными
кислотами. - С галогенами образует галогениды со степенью
окисления +2. - Железо не взаимодействует с кислородом.
- Железо можно получить путем электролиза
расплава его соли.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Вариант 2.
- Железо – это металл серебристо-белого цвета.
- Железо не обладает способностью
намагничиваться. - Атомы железа проявляют окислительные свойства.
- На внешнем энергетическом уровне атома железа 1
электрон. - Железо вытесняет медь из растворов ее солей.
- С галогенами образует соединения со степенью
окисления +3. - С раствором серной кислоты образует сульфат
железа (III). - Железо не подвергается коррозии.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
После выполнения задания учащиеся меняются
своими работами и проверяют их (ответы к работам
вывешены на доске, или показать через проектор).
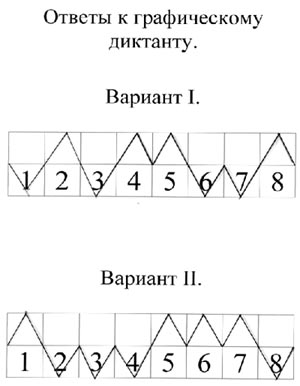
Критерии отметки:
- “5” – 0 ошибок,
- “4” – 1-2 ошибки,
- “3” – 3-4 ошибки,
- “2” – 5 и больше ошибок.
Используемая литература
- Габриелян О.С. Химия 9 класс. – М.: Дрофа, 2001.
- Габриелян О.С. Книга для учителя. – М.: Дрофа, 2002.
- Габриелян О.С. Химия 9 класс. Рабочая тетрадь. –
М.: Дрофа, 2003. - Индустрия образования. Сборник статей. Выпуск 3.
– М.: МГИУ, 2002. - Малышкина В. Занимательная химия. –
Санкт-Петербург, “Тригон”, 2001. - Программно-методические материалы. Химия 8-11
классы. – М.: Дрофа, 2001. - Степин Б.Д., Аликберова Л.Ю. Книга по химии для
домашнего чтения. – М.: Химия, 1995. - Я иду на урок Химии. Книга для учителя. – М.:
“Первое сентября”, 2000.
Приложения
Интересный материал к уроку
Знаете ли вы, что?
Железо – один из важнейших
элементов жизни. Кровь содержит железо, и именно
оно определяет цвет крови, а также ее основное
свойство – способность связывать и отдавать
кислород. Такой способностью обладает
комплексное соединение – гем – составная часть
молекулы гемоглобина. Кроме гемоглобина железо в
нашем организме есть еще в миоглобине – белке,
запасающем кислород в мышцах. Есть также
железосодержащие ферменты.
Близ г. Дели в Индии стоит железная колонна без
малейшего пятнышка ржавчины, хотя ее возраст
почти 2800 лет. Это знаменитая Кутубская колонна
высотой около семи метров и массой 6.5 т. Надпись
на колонне говорит о том, что она была поставлена
в IX в. До н. э. Ржавление железа – образование
метагидроксида железа – связано с
взаимодействием его с влагой и кислородом
воздуха.
Однако эта реакция при отсутствии в железе
различных примесей, и прежде всего углерода,
кремния и серы, не протекает. Колонна была
изготовлена из очень чистого металла: железа в
колонне оказалось 99,72%. Этим и объясняется ее
долговечность и коррозионная устойчивость.
В 1934 г. в “Горном журнале” появилась статья
“Улучшение железа и стали
посредством…ржавления в земле”. Способ
превращения железа в сталь через ржавление в
земле известен людям с глубокой древности.
Например, черкесы на Кавказе закапывали
полосовое железо в землю, а откопав его через 10-15
лет, выковывали из него свои сабли, которые могли
перерубить даже ружейный ствол, щит, кости врага.
Гематит
Гематит, или красный железняк –
основная руда главного металла современности –
железа. Содержание железа достигает в нем 70%.
Гематит известен с давних пор. В Вавилоне и
Древнем Египте он использовался в украшениях,
для изготовления печатей, наряду с халцедоном
служил излюбленным материалом в качестве
резного камня. У Александра Македонского был
перстень с вставкой из гематита, который, как он
полагал, делал его неуязвимым в бою. В древности и
в Средние века гематит слыл лекарством,
останавливающим кровь. Порошок из этого минерала
издревле использовали для золотых и серебряных
изделий.
Название минерала происходит от греческого дета
– кровь, что связано с вишневым или
сургучно-красным цветом порошка этого минерала.
Важной особенностью минерала является
способность стойко хранить цвет и передавать его
другим минералам, в которые попадает хотя бы
небольшая примесь гематита. Розовый цвет
гранитных колонн Исаакиевского собора – это
цвет полевых шпатов, которые в свою очередь
окрашены тонкораспыленным гематитом. Живописные
узоры яшмы, используемой при отделке станций
столичного метро, оранжевые и розовые сердолики
Крыма, кораллово-красные прослойки сильвина и
карналлита в соляных толщах – все обязаны своим
цветом гематиту.
Издавна из гематита делали красную краску. Все
известные фрески, выполненные 15-20 тыс. лет назад,
– замечательные бизоны Альтамирской пещеры и
мамонты из знаменитой Капской пещеры –
выполнены и коричневыми оксидами и гидроксидами
железа.
Магнетит
Камень, чье имя магнит,
залегает в земле троглодитов;
Впрочем, не меньше того им богаты индийские
страны.
Он узнается легко по бурому ржавому цвету
И потому как он тянет к себе железные вещи.
М. Реннский
Магнетит, или магнитный железняк –
минерал, содержащий 72% железа. Это самая богатая
железная руда. Замечательное в этом минерале его
природный магнетизм – свойство, благодаря
которому он был открыт.
Как сообщал римский ученый Плиний, магнетит
назван в честь греческого пастуха Магнеса.
Магнес пас стадо возле холма над р. Хинду в
Фессалии. Неожиданно посох с железным
наконечником и подбитые гвоздями сандалии
притянула к себе гора, сложенная сплошным серым
камнем. Минерал магнетит дал в свою очередь
название магниту, магнитному полю и всему
загадочному явлению магнетизма, которое
пристально изучается со времен Аристотеля и по
сей день.
Магнитные свойства этого минерала и сегодня
используются, прежде всего для поиска
месторождений. Именно так были открыты
уникальные месторождения железа на площади
Курской магнитной аномалии (КМА). Минерал
тяжелый: образец магнетита размером с яблоко
весит 1,5 кг.
В древности магнетит наделяли всевозможными
лечебными свойствами и способностью творить
чудеса. Его использовали для извлечения металла
при ранениях, а Иван Грозный среди своих сокровищ
наравне с другими камнями хранил его
непримечательные кристаллы.
Пирит – минерал, подобный огню
Не все золото, что блестит.
Пословица
Пирит – один из тех минералов,
увидев который хочется воскликнуть: “Неужели
это так и было?” Трудно поверить, что высший
класс огранки и полировки, поражающий нас в
рукотворных изделиях, в кристаллах пирита –
щедрый дар природы.
Пирит получил свое название от греческого
слова “пирос” – огонь, что связано с его
свойством искрить при ударе стальными
предметами. Этот красивый минерал поражает
золотистым цветом, ярким блеском на почти всегда
четких гранях. Благодаря своим свойствам пирит
известен с глубокой древности, а во время
эпидемий золотой лихорадки пиритовые блестки в
кварцевой жиле вскружили не одну горячую голову.
Да и сейчас начинающие любители камня нередко
принимают пирит за золото.
Пирит – минерал вездесущий: он образуется из
магмы, из паров и растворов, и даже из осадков,
каждый раз в специфических формах и сочетаниях.
Известен случай, когда за несколько десятилетий
в пирит превратилось
