Какой из элементов ванадий или мышьяк обладают более выраженными металлическими свойствами
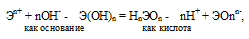
КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ
Задача № 7
Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте исходя из строения атомов данных элементов.
Решение:
Ванадий 23-ий элемент таблицы Менделеева, мышьяк – 33-ий. Они находятся в 5-ой группе первый ваше второго.
Строение атома ванадия:
23V=1s22s22p63s23p63d34s2
Строение атома мышьяка:
33As=1s22s22p63s23p63d104s24p3
Как известно из курса химии, неметаллы имеют высокую электроотрицательность, металлы – низкую. В каждой группе периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху-вниз). То есть мышьяк имеет более выраженные металлические свойства.
Водородное соединение AsH3 (арсин) образует мышьяк. Газ при комнатной температуре, при нагревании разлагается.
Задача № 27
Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 литров аммиака в перерасчете на нормальные условия.
Решение:
Химическая реакция образования хлорида аммония имеет вид:
NH3+HCl=NH4Cl ; ∆H0298=-175,5 кДж/моль,
Поскольку аммиак в газообразном состоянии, а 1 моль газа при нормальных условиях занимает объем 22,4 литра, то 10 литров аммиака составят:
10/22,4=0,45 моля
Масса аммиака составит:
MNH3=17*0,45=7,65 г
Вычислим массу хлорида водорода, вступающего в реакцию по формуле:
mА / mВ = nА MА / nВ MВ, где
- – формула вещества в реакции, значение массы m которого известно; В – формула любого другого вещества (реагента, продукта) в реакции, значение массы mВ которого необходимо найти; nA и nB – количества веществ, численно равные стехиометрическим коэффициентам при формулах соответствующих веществ в уравнении реакции.
mHCl=7,65*36/17=16,2 г
Масса хлорид аммония будет равна сумме масс веществ, вступивших в реакцию:
mNH4Cl=7,65+16,2=23,85 г,
что составляет:
23,85/53=0,45 моль
Следовательно, количество теплоты, которое выделится при данной реакции:
Q=0,45*175,5= 78,97 кДж
Задача № 47
Прямая или обратная реакция будет протекать при стандартных условиях в системе:
2NO(г)+O2(г)=2NO2(г)
Ответ мотивируйте, вычислив ∆G0298 прямой реакции.
Решение:
Для ответа на вопрос следует вычислить изменение энергии Гиббса прямой реакции по формуле:
ΔG˚ = ΔНº – ТΔSº,
где ΔНº – энтальпия, Т – абсолютная температура, ΔSº – энтропия
∆G0 = 2*51,84 – 2*86,69 = -69,7 кДж
При стандартных условиях в системе будет протекать прямая реакция, т.к. ∆G0 < 0.
Задача № 67
Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 600С, если температурный коэффициент скорости данной реакции 2.
Решение:
Для вычисления скорости реакции при изменении температуры воспользуемся следующей формулой:
, где
V2 – скорость реакции при повышенной температуре Т2;
V1 – скорость реакции при исходной температуре Т1;
∆Т – разность температур (Т2 – Т1);
γ – температурный коэффициент скорости химической реакции.
Отсюда:
V2/V1=260/10=64
Скорость реакции возрастет в 64 раза.
Задача № 87
Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2 н раствора HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок?
Решение:
Запишем реакцию:
AgNO3+ HCl=HNO3+ AgCl ↓
0,2 н раствор, означает, что в 1 литре воды растворено 0,2 моля вещества.
MHCl=36/20/5= 0,36 г или 0,01 моля
С одной сотой моля HCl вступит в реакцию 0,01 моля AgNO3.
Следовательно, нормальность раствора AgNO3 составит:
НAgNO3=0,01/0,1= 0,1
Вычислим массу выпавшего AgCl:
MAgCl=0,36* 143/36= 1,43 г
Задача № 107
Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
Cu2++S2-=CuS
SiO32-+2H+=H2SiO3
Cu(NO3)2 + K2S = CuS ↓ + 2KNO3
CuSO4 + H2S = CuS ↓ + H2SO4
CuCl2+H2S=CuS ↓+2HCl
NaSiO3+HCl=H2SiO3+NaCl
H2SO4 + K2SiO3=H2SiO3 + K2SO4
NaHSiO3 + H2O ⇄ H2SiO3 + NaOH
Задача № 127
Реакции выражаются схемами:
HNO3+Ca→NH4NO3+Ca(NO3)+H2O
K2S+KMnO4+H2SO4→S+K2SO4+MnSO4+H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое восстанавливается.
Решение:
10HNO3 + 4Ca = NH4NO3 + 4Ca(NO3)2 + 3H2O
Ca0 – 2e → Ca2+ – восстановитель (окисляется)
N5+ + 8e → N3- – окислитель (восстанавливается)
2K2S + 2KMnO4 + 4H2SO4 = S + 3K2SO4 + 2MnSO4 + 4H2O
S2- – 2e → S0 – восстановитель (окисляется)
S2- – 8e → S6+ – восстановитель (окисляется)
Mn7+ + 5e → Mn2+ – окислитель (восстанавливается)
Задача № 147
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+]=0,8 моль/л, а [Cu2+]=0,01 моль/л.
Решение:
Схема: (-) Сd|Cd2+||Cu2+|Cu (+)
Катод: Cu2+ + 2e = Cu
Анод: Cd – 2e = Cd2+
ЭДС вычисляется по формуле Нернста:
E=E0+(0,059/n)lgC, где
E0 – стандартный электродный потенциал;
n – число электронов в процессе;
С – концентрация, моль/n;
ЭДС = Ек-Еа+0,059*lg(Cu2+/Cd2+)/2 = 0,345+0,403 + 0,059*lg(0,01/0,8)/2 ЭДС = 0,68 В
Задача № 167
На сколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 38 минут 20 секунд? Составьте электронные уравнения процессов, происходящих на электродах.
Решение:
элетролиз AgNO3:
Анод (+): NO3-; H2O 2H2O-4e=O2↑ +4H+
Катод(-): Ag+; Ag+ +e= Ag0
Суммарное уравнение электролиза раствора соли нитрата серебра:
4 AgNO3+2H2O⇒(элетролиз) 4Ag↓+4HNO3+O2↑
По первому закону Фарадея масса вещества m, образующегося при электролизе, прямо пропорциональна количеству прошедшего через раствор электричества Q:
m = kQ,
где k – электрохимический эквивалент, который равен количеству вещества, образующегося при пропускании через электролит количества электричества,
равному одному кулону или одному ампер-часу электричества.
При пропускании через электролит количества электричества, равного
постоянной Фарадея F (96500 Кл или 26,8 А ч), выделяется по одному грамм-эквиваленту продуктов электролиза:
m = mэIt/F,
где mэ – эквивалентная масса.
Электрохимический эквивалент:
k = mэ/F; k = mэ/96500;
k = mэ/26,8.
Эквивалентная масса серебра равна 107,87 г/моль. Электрохимический эквивалент серебра:
k = 107,87/96500 = 0,00112 г/Кл;
k = 107,87/26,8 = 4,02 г/(А ч).
Определяем массу вещества:
m = kIt;
m = 4,02*2*0,63= 4,47 г.
Масса анода уменьшится на 4,47 грамма.
Задача № 187
Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний-никель. Какие продукты коррозии образуются в первом и втором случаях?
Решение:
Магний имеет более электроотрицательный электродный потенциал (-2,36 В), чем никель (-0,24 В), поэтому он является анодом, никель – катодом.
Анодный процесс – окисление металла:
Mе0 – 2e = Mеn+
- процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация).
При коррозии пары Mg — Ni с водородной деполяризацией происходит следующие процессы:
Анодный: Mg0 – 2е = Mg2+
Катодный: в кислой среде: 2Н+ + 2е = Н2↑
Продуктом коррозии будет газообразный водород и соединение магния с кислотным остатком (соль).
При коррозии пары Mg — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление магния:
Анодный процесс: Mg0 – 2е = Mg2+
Катодный процесс: в нейтральной среде: 1/2O2 + H2O + 2е = 2OH-
в нейтральной или в щелочной среде: 1/2O2 + H2O + 2е = 2OH-
Так как ионы Mg2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Mg(OH)2.
Задача № 207
Напишите структурную формулу метакриловой кислоты. Какое соединение получается при взаимодействии ее с метиловым спиртом? Напишите уравнение реакции. Составьте схему полимеризации образующегося продукта.
Решение:
Структурная формула метакриловой кислоты выглядит так:
Взаимодействие с метиловым спиртом:
СН2=С (СН3)СООН + СН3ОН = Н2О + СН2=С (СН3)СО-О-СН3
Образуется метиловый эфир метакриловой кислоты или метилметакрилат.
При полимеризации – полиметилметакрилат.
Схема полимеризации выглядит следующим образом:
Список использованной литературы:
1. Маругин В.А. Неорганическая химия. Теоретическая часть: Учебное пособие. – Киров: Вятская ГСХА, 2014. – 210 с.
2. ХИМИЯ, ЗАДАЧИ И РЕШЕНИЯ, Москва, 2010
3. Справочник Химика. Том 1. / Б. Н. Никольский. – М.: «Химия», 1966
4. Краткий химический справочник. / В. А. Рабинович. – М.: «Химия», 1978
Источник
Задание 47.
Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов?
Решение:
+23V 1s22s22p63s23p63d34s2; +33Аs 1s22s22p63s23p63d104s24p3.
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Мышьяк с водородом образует газообразный гидрид AsH3 – арсин, где мышьяк проявляет отрицательную степень окисления -3, так как атом мышьяка способен присоединять три электрона до полного заполнения внешнего энергетического уровня:
Задание 48.
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Решение:
Марганец в своих соединениях проявляет степень окисления +2, +3, +4, +6, +7.
Формулы оксидов, отвечающих этим степеням окисления:
MnO – оксид марганца (II);
Mn2O3 – оксид марганца(III);
MnO2 – оксид марганца(IV);
MnO3 – ; оксид марганца(VI);
Mn2O7 – оксид марганца(VII).
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Mn(OH)4 + 4HCl = MnCl4 + 4H2O;
Mn(OH)4 + 4NaOH = Na4MnO4 + 4H2O
Задание 49.
У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
Решение:
Электронные формулы хрома и селена:
+24Cr 1s22s22p63s23p63d54s1; +34Se 1s22s22p63s23p63d104s24p4.
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Задание 50.
Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
Решение:
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2p6). Элементы хлор, сера, азот и углерод находятся соответственно в VIIА-, VIА-, VА-, IVА- группах и имеют структуру внешнего энергетического уровня s2p5, s2p4, s2p3, s2p2. Следовательно, низшая степень окисления хлора, серы, азота и углерода равны соответственно -1, -2, -3 и -4.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
Задание 51.
У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
Решение:
Фосфор и сурьма находятся в VА- группе и имеют следующие электронные формулы:
+15Р 1s22s22p63s23p3; +51Sb 1s22s22p63s23p63d104s24p64d105s25p3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Водородное соединение сурьмы (SbH3 – стибин) обладает более сильными восстанови-тельными свойствами, чем водородное соединение фосфора (РН3 – фосфин). Это объясняется тем, что в группах с ростом порядкового номера элемента закономерно возрастают радиусы атомов элементов и, соответственно ионные радиусы. Ион Sb3- имеет больший диаметр, чем ион Р3-, поэтому иону сурьмы значительно легче отдать электроны (из-за большего радиуса иона требуется меньше энергии на отрыв электрона).
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
Прочность связей определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Если прочность связей Э — О и О — Н близки или равны , то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
где Э – элемент (металл или неметалл); n+ – положительная степень окисления элемента.
а) Ва(ОН)2 будет более сильным основанием, чем Mg(OH)2, так как эти элементы стоят во IIА- группе главной подгруппе, а в группе у элементов с увеличением порядкового номера увеличиваются размеры атомов (ионов), что уменьшает прочность связей Ва2+ с ОН-, чем у Mg2+ с ОН-.
б) Ca и Fe – элементы большого ряда четвёртого периода периодической системы химических элементов, поэтому с ростом порядкового номера элемента будет наблюдаться рост эффективного заряда, что приводит к уменьшению размеров атома (радиус атома железа будет намного меньше, чем радиус атома кальция). Из-за чего связь между Са2+ и ОН- будет значительно меньше, чем между Fe2+ с ОН-, значит, Са(ОН)2 будет проявлять сильнее основные свойства, чем Fe(ОН)2.
в) Стронций – типичный р-элемент IIА- группы, а кадмий – d-элемент IIВ- группы и у их атомов на внешнем энергетическом уровне содержатся по два электрона, поэтому они в своих соединения будут проявлять степень окисления +2. У кадмия порядковый номер (48) значительно больше, чем у стронция (38), поэтому радиус иона кадмия (Cd2+) имеет большее численное значение, чем у иона стронция (Sr2+), значит, связь между ионами Cd2+ и ОН- будет прочнее, чем связь между Sr2+ и ОН-, Sr(OH)2 будет проявлять меньше основных свойств чем Cd(ОН)2.
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н < < ЕЭ—О (высокая степень окисления), а по основному типу (I), если ЕО—Н >> ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
где Э – элемент (металл или неметалл); n+ – положительная степень окисления элемента. Таким образом, исходя из степени окисления атомов соответствующих элементов, можно уверенно считать, что, если элемент образует два гидроксида, то более сильным основанием будет тот гидроксид, в котором степень окисления элемента имеет меньшее численное значение.
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.
Источник
