Какой элемент 2 группы обладает большими металлическими свойствами
Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
– постоянная валентность II
– постоянная степень окисления +2
– легкость образования 2-зарядных ионов Me+2
С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
– энергия ионизации Еион уменьшается
– сродство атомов к электрону уменьшается
– электроотрицательность уменьшается
– металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название – щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
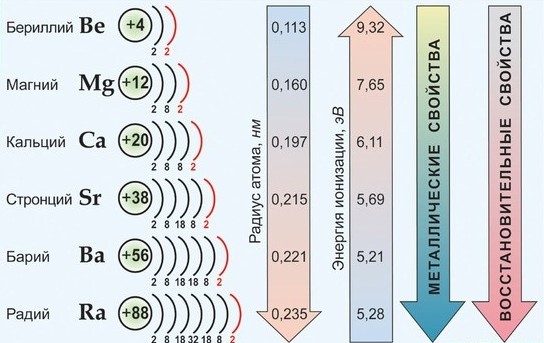
Среди s2-элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство). По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s2-элементы – белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
Оксиды | Гидроксиды | ||||
формула | характер | отношение к воде | формула | характер | отношение к воде |
ВеО | амфотерный | не растворимый, не взаимодействует | Ве(ОН)2 | амфотерный | не растворимый |
МgО | основный | не растворимый, не взаимодействует | Mg(ОН)2 | слабое основание | не растворимый |
СаО | основные | хорошо растворимые, взаимодействуют | Са(ОН)2 | сильные основания | мало растворимый |
SrO | Sr(ОН)2 | растворимый | |||
BaO | Bа(ОН)2 | растворимый | |||
Магний
12Mg [Ne]3s2
Ar 24.305
Изотопы 24Mg (78.60 %)
25Mg (10.11 %)
26Mg (11.29 %)
ЭО 1.2
E° -2,37 В
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов). Основные из них:
– магнезит MgCO3
– доломит СаСО3 • МgСО3
– карналлит КСl • МgСl2 • 6Н2O
– горькая (английская) соль MgS04• 7H2O В виде катионов Mg2+ находится в природных водах (в 1 м3 морской воды содержится около 1 кг Mg2+). Наряду с ионами Са2+обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний – единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
В чистом виде магний – блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
MgCl2 = Mg + Cl2↑
2. Карботермический (t ˃ 2000°C)
MgO + С = Mg↑(пары) + СО ↑
Mg – химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Mg – 2e- → Mg2+.
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
Происходит одновременное образование оксида и нитрида:
2Мg + О2 = 2МgО
ЗМg + N2 = Mg3N2
При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой – нерастворимым в воде Мg(ОН)2
1) Мg активно реагирует с кипящей водой:
Мg+ 2Н2O = Мg(ОН)2 + H2↑
2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой – это может привести к взрыву.
3) Мд легко растворяется в воде в присутствии NH4CI:
Mg + 2Н2O+ 2NH4Cl = MgCl2 + H2↑ + 2NH3•Н2O
Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
См. «Основные способы получения металлов. Магнийтермия».
Мg + С2Н5Сl → С2Н5-Мg-Сl этилмагнийхлорид
Мg + С6Н5Br → С6Н5-Мg-Br фенилмагнийбромид
Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.
Кальций
20Ca [Ar]4s2
Аr 40.08
Основные изотопы:
40Са (96.94 %)
44Са (2.09 %)
422Са (0.667 %)
ЭО 1.0
Е° -2.86 В
Один из основных породообразующих элементов; входит в состав многочисленных минералов в виде соединений:
– СаСО3 (мел, мрамор, известняк)
– СаСО3 • МgСО3 (доломит)
– CaSO4 (ангидрит)
– CaSO4• 2Н2O (гипс)
Кальций – один из самых активных металлов; во всех реакциях участвует как сильный восстановитель:
Са° – 2e- → Са2+
а) при горении на воздухе образуется преимущественно оксид;
2Са + O2 = 2СаО оксид
б) при Т – 500° частично происходит реакция с азотом:
ЗСа + N2 = Ca3N2 нитрид
Са + Cl2 = CaCI2 хлорид
в) взаимодействие с серой, фосфором, углеродом, кремнием:
Са + S = CaS сульфид
ЗСа + 2Р = Са3Р2 фосфид
Са + 2С = СаС2 карбид
Са + 2Si = CaSi 2 силицид
г) нагревание в струе Н2 сопровождается воспламенением:
Са + Н2 = СаН2 гидрид
(кроме HF и Н3РO4, из-за нерастворимости фторида CaF2 и фосфата Са3(РO4)2)
Са +2Н2O = Са(ОН)2 + Н2;
Са + 2HCl = СаСl2 + Н2
Са + 2СН3СООН → (СН3СОО)2Са+ H2;
4Са +10HNO3(разб) = 4Ca(NO3)2 + NH4NO3 + 3H2O
5Са + 12HNO3(конц) = 5Ca(NO3)2 + N2 + 6Н2O
ЗСа + 4H2SO4(конц) = 3CaSO4 + S + 4Н2O
Источник
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
2Mg + O2 = 2MgO
2Ca + O2 = 2CaO
2Ba + O2 = 2BaO
Ba + O2 = BaO2
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
Мg + I2 = MgI2 – иодид магния
Са + Br2 = СаBr2 – бромид кальция
Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
Ве + Н2SO4(разб.) = BeSO4 + H2↑
Mg + 2HBr = MgBr2 + H2↑
Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S↑ + 4H2O
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Источник
| Элемент | Be | Mg | Ca | Sr | Ba | Ra |
|---|---|---|---|---|---|---|
| Порядковый номер | 4 | 12 | 20 | 38 | 56 | 88 |
| Атомная масса (относительная) | 9,01 | 24,30 | 40,08 | 87,62 | 137,33 | 226 |
| Плотность (н.у.), г/см3 | 1,85 | 1,74 | 1,55 | 2,54 | 3,5 | 5,5 |
| tпл, К | 1551 | 923 | 1112 | 1042 | 1022 | 1233 |
| tкип, К | 3243 | 1363 | 1757 | 1657 | 1910 | 2010 |
| Энергия ионизации, кДж/моль | 899,0 | 737,7 | 589,7 | 549,5 | 502,8 | 509,3 (1-й электрон) 979,0 (2-й) |
| Электронная формула | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| Электроотрицательность (по Поллингу) | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,9 |
Электронные формулы инертных газов:
- He – 1s2;
- Ne – 1s22s22p6;
- Ar – 1s22s22p63s23p6;
- Kr – [Ar]3d104s24p6;
- Xe – [Kr]4d105s25p6;
- Rn – [Xe]4f145d106s26p6.
Рис. Строение атома магния.
Во 2 группу (IIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 металлов: бериллий, магний, кальций, стронций, барий, радий (см. таблицу выше). Последние четыре – Ca, Sr, Ba, Ra называют щелочноземельными металлами, поскольку гидроксиды этих металлов обладают щелочными свойствами, а их оксиды по своей тугоплавкости похожи на оксиды тяжелых металлов, называемых ранее “землями”.
Самым распространенным в земной коре элементом 2(IIa) группы является кальций (4,1% по массе), далее идут: магний (2,3%), барий (0,05%), стронций (0,037%), бериллий (0,00026%), радий (6·10-11).
Наиболее важным элементом подгруппы берилия является кальций, который входит в состав костей всех животных и человека, определяя их прочность. Концентрация ионов кальция и магния в воде определяет ее жесткость.
Элементы 2(IIa) группы в свободном виде в природе не встречаются, но входят в состав многих соединений:
- Be:
- 3BeO·Al2O3·SiO2 – минерал берилл;
- берилл с примесью Cr2O3 – изумруд;
- берилл с примесью Fe – аквамарин;
- (BeAl2)O4 – хризоберилл;
- (BeAl2)O4 с примесью Cr – александрит.
- Mg:
- MgCO3·CaCO3 – доломит;
- MgCO3 – магнезит;
- MgO·Al2O3 – шпинель;
- 2MgO·SiO3 – оливин;
- магний содержится в морской воде, а также входит в состав хлорофилла – важнейшей части фотосинтезирующего аппарата растений.
- Ca:
- CaCO3 – кальцит;
- CaSO4·2H2O – гипс;
- CaF2 – флюорит;
- Ca5(PO4)3F – фторапатит;
- Ca3(PO4)2 – фосфат кальция.
- Sr и Ba встречаются в виде карбонатов и сульфатов.
Физические свойства:
- металлы II группы имеют серебристо-белый цвет;
- низкую плотность (плотность увеличивается в подгруппе сверху-вниз);
- низкую температуру плавления (температуры плавления уменьшаются в подгруппе сверху-вниз);
- обладают высокой пластичностью;
- высокой электро- и теплопроводностью.
Все атомы элементов 2(IIa) группы на внешнем энергетическом уровне имеют по два валентных s-электрона (см. Электронная конфигурация атомов), с которыми в химических соединениях достаточно легко “расстаются”, завершая, таким образом, свой внешний энергетический уровень, который становится устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов.
Таким образом, отдавая “ненужные” валентные электроны (см. Валентность), элементы 2(IIa) группы в химических соединениях проявляют степень окисления +2, являясь сильными восстановителями, проявляя при этом высокую реакционную способность.
С ростом порядкового номера химического элемента увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от бериллия к радию. В этом ряду активность металлов и их восстановительные свойства возрастают.
Наибольшее значение из всех шести элементов 2(IIa) группы имеют магний и кальций – металлы серебристо-белого цвета, мягкие и очень легкие, о них и пойдет речь дальше.
Химические свойства Mg, Ca
- при нагревании выше 600°C магний сгорает на воздухе ослепительно ярким белым пламенем (при н. у. магний защищен оксидной пленкой), с образованием оксида и нитрида магния:
O2 + 2Mg = 2MgO; N2 + 3Mg = Mg3N2; - кальций на влажном воздухе быстро реагирует с кислородом покрываясь рыхлой пленкой (смесь оксида и гидроксида кальция), при нагревании в кислороде воспламеняется:
O2 + 2Ca = 2CaO; - при н. у. легко реагируют с галогенами, образуя галогениды:
Ca + Cl2 = CaCl2; Mg + Cl2 = MgCl2; - при нагревании реагируют с неметаллами, образуя гидриды, нитриды, сульфиды, карбиды:
- H2 + Mg = MgH2;
- N2 + 3Ca = Ca3N2;
- S + Mg = MgS;
- 2C + Ca = CaC2.
- при кипячении магний вытесняет из воды водород, образуя гидроксид магния (кальций реагирует с водой при н. у.):
2H2O + Mg = Mg(OH)2 + H2; 2H2O + Ca = Ca(OH)2 + H2; - реагируют с соляной и разбавленной серной кислотой:
Ca + 2HCl = CaCl2 + H; Mg + H2SO4(рзб) = MgSO4 + H2; - реагируют с разбавленной азотной кислотой, образуя нитрат аммония:
4Mg + 10HNO3(рзб) = 4Mg(NO3)2 + NH4NO3 + 3H2O; - с концентрированной азотной кислотой (магний реагирует при нагревании):
4Mg + 10HNO3(кнц) = 4Mg(NO3)2 + N2O + 5H2O; - с концентрированной серной кислотой:
4Mg + 5H2SO4(кнц) = 4CaSO4 + H2S + 4H2O; - поскольку атомы элементов 2(IIa) группы являются сильными восстановителями, магний и кальций используются в реакциях восстановления металлов из их оксидов и галогенов, что находит широкое практическое применение в реакциях метллотермии, когда для получения редкоземельных металлов используют гораздо более распространенные щелочноземельные металлы:
- магнийтермия (в вакууме):
2RbCl + Ca = 2Rb + CaCl2; - кальцийтермия (в вакууме):
2CsCl + Mg = 2Cs + MgCl2.
- магнийтермия (в вакууме):
Оксиды и гидроксиды магния и кальция…
Получение магния и кальция
- электролизом расплавов солей: MgCl2 → Mg + Cl2;
- металлотермией (промышленный способ) при t>1200°C в электропечи в условиях вакуума, восстанавливая металлы из их соединений: 3CaO + 2Al = 3Ca + Al2O3;
- углетермией (восстановлением оксидов углем) в электропечи при t>2000°C: MgO + C = Mg + CO.
Применение
- Be:
- в качестве легирующей добавки к сплавам, придавая им твердость и прочность;
- как замедлитель и отражатель нейтронов в атомной промышленности.
- Mg:
- широко используется в конструкционных сверхлегких сплавах в автомобиле- и авиастроении;
- для получения редкоземельных металлов методом металлотермии;
- в органическом синтезе;
- в фото- и пиротехнике.
- Ca:
- в металлургии для удаления различных примесей при выплавке сталей и других сплавов;
- для получения редкоземельных металлов методом металлотермии;
- для выделения из воздуха инертных газов.
Источник
