Какой элемент имеет более выраженные неметаллические свойства чем фосфор
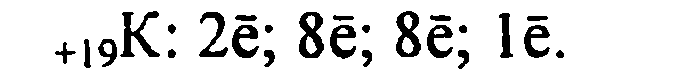
Анонимный вопрос
19 декабря 2017 · < 100
Чему равно число электронов во внешнем слое для элементов главных подгрупп?
Книги, звери и еда – это хобби навсегда.
Число электронов во внешнем слое главных подгрупп периодической таблицы Менделеева равно номеру подгруппы, в которой находится элемент, за исключением водорода, имеющего 1 электрон и относящегося иногда одновременно к 1 и 7 группам, и гелия, имеющего 2 электрона и относящегося к 8 группе.
Сколько неметаллов в периодической системе менделеева?
Водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, германий, мышьяк, селен, бром, криптон, йод, ксенон, астат, радон – всего 22 элемента.
какой элемент имеет более выраженные металлические свойства c (z=6) или o (z=11); P (Z=15) или c1 (z=17); f (z=9) или c1? Почему?
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия. · tele.click/real_italy
Прикладной ответ:
1) Углерод (С; 6) vs Натрий (Na; 11). Тут конечно Натрий имеет более выраженные металлические свойства, так как находиться в левой части таблице.
2)Фосфор (P;15) и Хлор (Cl; 17). Атомы находятся в одном периоде, соответственно Фосфор более левей расположился и потому имеет незначительно больше металлических свойств.
3) Фтор (F; 9) и Хлор (Cl; 17). Тут победитель – хлор, поскольку он находиться ниже относительно фтора.
Теоретический ответ и обоснование:
1) При перемещении вдоль периода, слева на право, металлический свойства уменьшаются. Соответственно неметаллические возрастают.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2) При перемещении сверху вниз по группам
металлические свойства элементов усиливаются. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой “шубой” из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
3) Визуально, для быстрой оценки очень удобно представлять таблицу Менделеева в виде прямоугольника, где оранжевая часть отвечает за металлические элементы, а фиолетовая за неметаллические. А направление стрелок указывают на увеличение металлических свойств. Мне в свое время очень помогло разобраться и запомнить данные тенденции. И да, линия смены металлов и неметаллов условная и именно по этому данная табличка не содержит каких-то границ переходных атомов. Используйте с умом.
Как изменяются восстановительные свойства в таблице менделеева?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Что такое восстановительные свойства? ☘️
Это способность атома отдавать электроны????
????При движении по периоду слева направо восстановительные свойства уменьшаются???? Потому что электроотрицательность (способность отбирать электроны) возрастает, и атомы всё неохотнее отдают электроны????
????При движении по группе сверху вниз восстановительные свойства возрастают???? Потому что увеличиваются радиус атома и заряд ядра, а число электронов на внешнем уровне не меняется
Вот полезная табличка. Она показывает, как меняются свойства элементов в таблице Менделеева. С ней точно не запутаетесь????
Источник
В главной подгруппе пятой группы, наряду с азотом, находится еще и фосфор. Металлом или неметаллом можно считать этот элемент? По сравнению с азотом он имеет более низкую электроотрицательность, однако все же относится к активным неметаллам. В нашей статье мы рассмотрим важнейшие физические и химические свойства фосфора, а также определим области его применения в промышленности.
Положение элемента в периодической системе
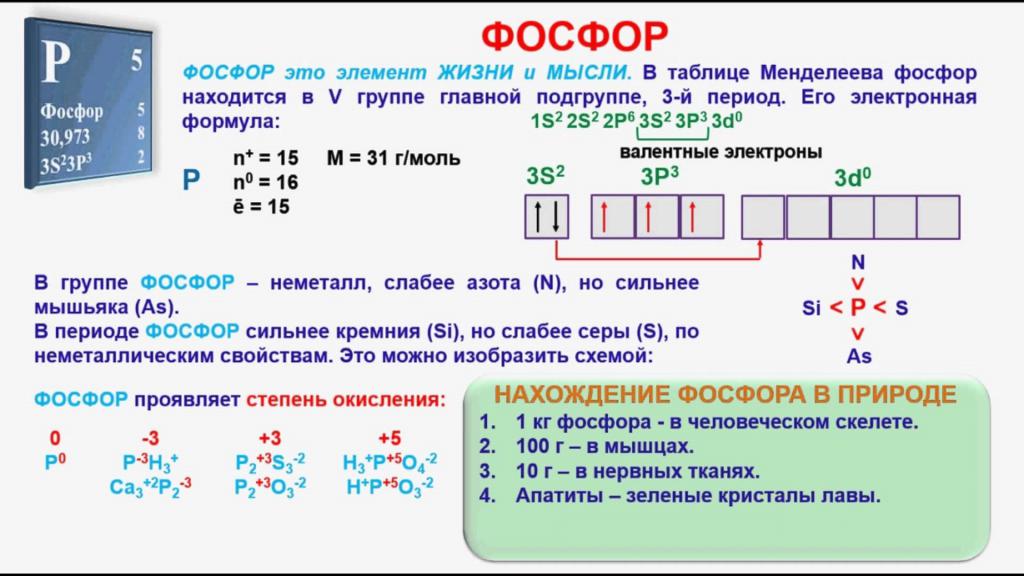
Фосфор относится к p-элементам, его атом имеет три энергетических уровня. На последнем из них расположено пять электронов, три из которых являются неспаренными. В возбужденном состоянии атом P содержит пять свободных электронов. Этот факт объясняет появление соединений фосфора, в которых он не трехвалентен, но имеет валентность, равную пяти, например, P2O5 – пятиокись фосфора. Неметалл, вследствие своей высокой активности, в природе отсутствует в свободном состоянии и встречается только в виде соединений. Природный элемент имеет единственный стабильный изотоп с относительной атомной массой, равной 31. Фосфор входит в состав многих горных пород и минералов, его содержание в составе земной коры составляет 0,08%.

Аллотропные модификации
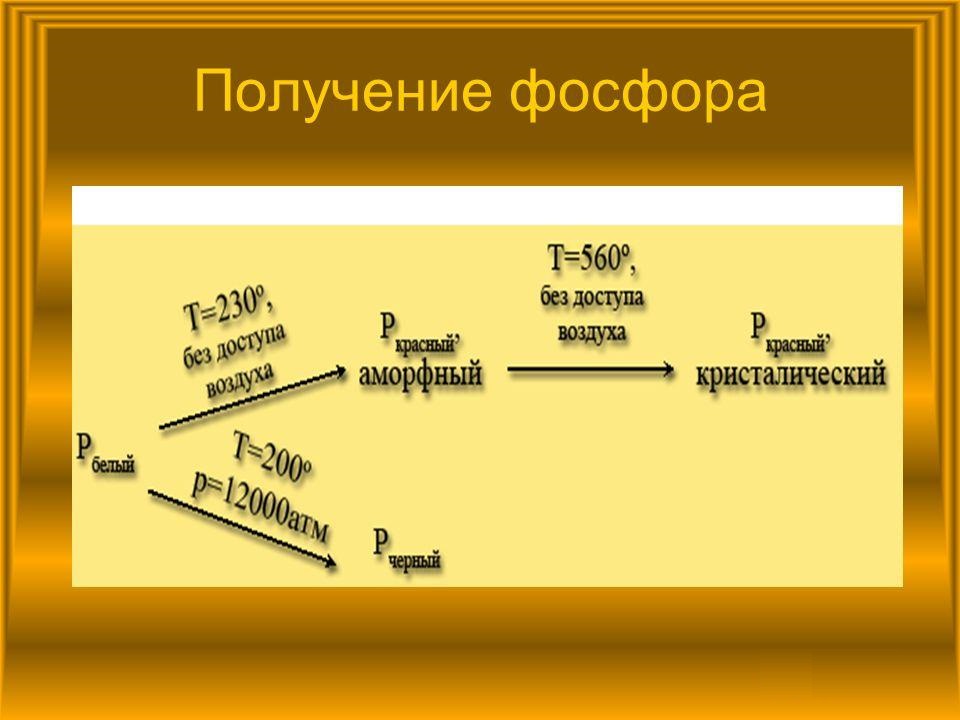
Различное расположение атомов в кристаллических решетках вещества приводит к появлению некоторых видоизменений. Например, черный фосфор очень напоминает графит. Он такой же жирный на ощупь и проявляет полупроводниковые свойства. В промышленности материал получают из белого фосфора, нагревая последний до 200°С и подвергая давлению в 12000 атм.
Красный фосфор – это порошковидное неядовитое вещество. При его детальном изучении было установлено, что соединение представляет собой смесь видоизменений фосфора, которые различаются между собой некоторыми признаками, например, цветом.
Еще одна аллотропная модификация – белый фосфор. Металлом или неметаллом он является? Это вещество проявляет типичные неметаллические свойства, кроме того, оно очень токсично. Получают его, концентрируя пары фосфора. В отличие от красного вида, он может растворяться в сероуглероде. Если белый фосфор длительно подвергать слабому нагреванию, он переходит в модификацию красного фосфора.
Химическая характеристика
В своих соединениях с другими элементами P может проявлять следующие степени окисления: +3, +5, -3. В парообразном состоянии при температуре ниже 800°, а также в жидкой фазе молекула вещества имеет формулу P4.
Различные модификации вещества имеют непохожие химические признаки. Как ответить на вопрос, чем является фосфор – металлом или нет? Нужно обратиться к строению его атома, который в возбужденном состоянии имеет пять валентных электронов. Наиболее активным в химическом плане неметаллом будет белый фосфор, который уже при обычной температуре легко окисляется, в процессе чего начинает светиться, а также может самовоспламеняться. По этим причинам его рекомендуется хранить покрытым водой. Красный фосфор по своим свойствам является менее активным веществом, чем его белая модификация.
Бинарные соединения
Как металл или неметалл, фосфор может реагировать с кислородом:
4P + 3O2 → 2P2O3
Продуктом реакции является газообразный фосфин – очень токсичное вещество, применяемое в качестве химического оружия. Его легко распознаеть по специфическому запаху чеснока. Гидрид фосфора способен присоединять галогеноводороды, например, такие, как йодоводород, образуя соединение – йодид фосфония PH4I. Взаимодействие с металлами приводит к появлению фосфидов:
2P + 3Ca = Ca3P2.
Как металл, фосфор реагирует и с неметаллами, например, с серой, углеродом, хлором:
2P + 3Cl2 = 2PCl3
Фосфиды легко вступают в реакцию с водой, разлагаясь до фосфина:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3(фосфин)
Оксиды
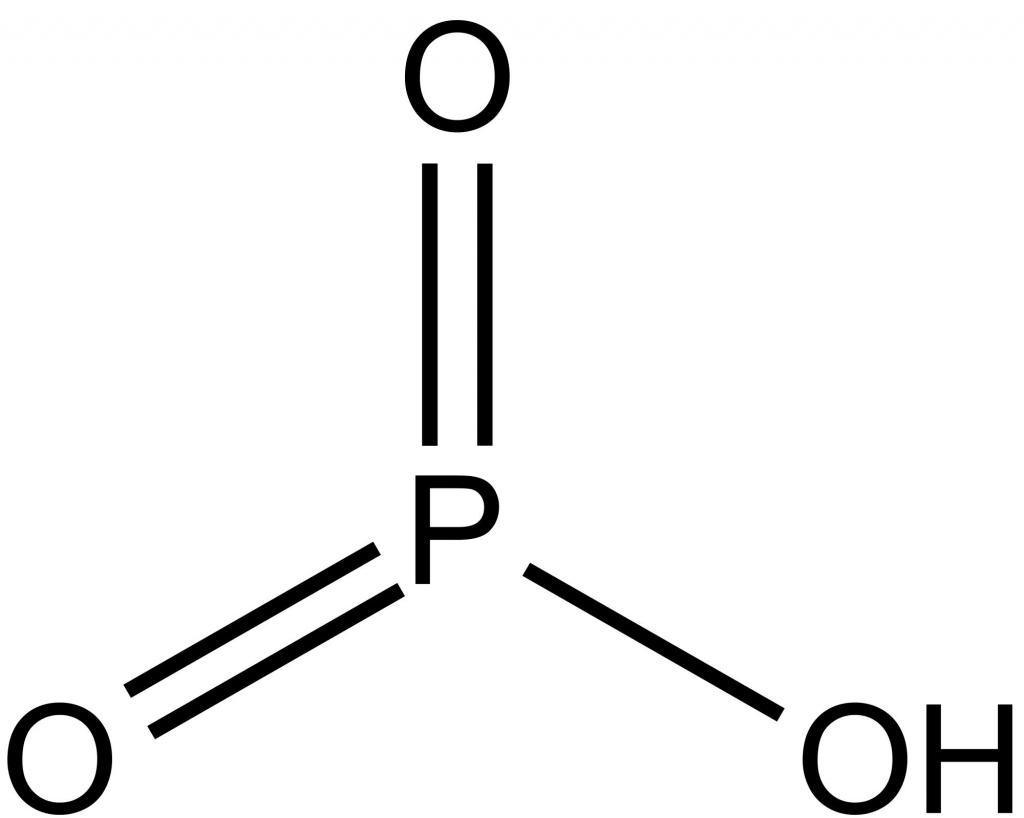
Среди бинарных соединений элемента с кислородом наиболее важными являются его оксиды: P2O5 и P2O3. Триокись фосфора, иначе называемая фосфорным ангидридом, представляет собой кристаллическое соединение, температура плавления которого – 22,5°. В обычных условиях оно имеет вид воскоподобной массы. В лаборатории его получают сжиганием фосфора в атмосфере, бедной кислородом. Хотя этот оксид и проявляет свойства сильного восстановителя, применяется он крайне редко из-за высокой токсичности. Какие же свойства, металла или неметалла, фосфор оксид проявляет в своих реакциях? Он может реагировать с водой, образуя ортофосфорную кислоту и фосфин. Вещество взаимодействует с хлороводородом, в результате получаются фосфатная кислота и хлорид фосфора.
Другое соединение – пятиокись фосфора, имеет признаки типичного кислотного оксида. Его можно получить в результате сжигания порции фосфора в атмосфере с избытком кислорода. В обычных условиях с водой соединение реагирует очень активно и образует метафосфорную, а при нагревании – ортофосфорную кислоту. Кроме того, пятиокись фосфора отнимает влагу, поэтому может применяться в качестве осушителя для жидких веществ и газов.
Фосфорные кислоты
Наиболее известные фосфорные кислоты – это метафосфорная, ортофосфорная и пирофосфорная, формула которой H4P2O7. Последняя из них образуется при нагревании H3PO4. Наибольшее практическое значение имеет ортофосфорная кислота, соли которой применяют в качестве сырья для получения минеральных удобрений. Она представляет собой твердое вещество белого цвета, очень хорошо растворимое в воде. Являясь кислотой средней силы, она не имеет ярко выраженных окислительных свойств. Как электролит, диссоциирует ступенчато, поэтому образует два ряда солей: средние – фосфаты, кислые – гидрофосфаты и дигидрофосфаты. В промышленности фосфатную кислоту получают термическим и экстракционным способом. Так как оксидам фосфора соответствуют кислоты, то на вопрос, чем является фосфор – металлом или неметаллом, ответ будет однозначным: это активный неметаллический элемент.

Распространение в природе
Наиболее важный минерал, содержащий высокую концентрацию фосфора – это апатит. Он имеет много разновидностей, самая распространенная из которых – фторапатит. Еще один вид минерала, состоящий из соединений фосфора – осадочная порода фосфорит.
Элемент входит в группу десяти важнейших для живых организмов химических элементов. Наибольшее его содержание обнаружено в форме фосфолипидов – органических соединений, которые входят в состав клеточных мембран, гормонов и других биологически активных веществ. Высокое содержание элемента (около 0,38%) регистрируется в нервной ткани, образующей центральный и периферический отделы нервной системы человека и других позвоночных животных. Кроме этого, соединения фосфора входят в мышечную и костную ткань. В последней присутствует фосфат кальция – соль, придающая дентину зубов и костям прочность и высокую твердость. В обмене веществ растительных организмов, наряду с магнием и железом, фосфор играет важную роль в качестве регулятора процессов формирования и созревания плодов и семян. Именно поэтому, вместе с азотом и калием, фосфор считается основным питательным элементом растений.

В нашей статье мы рассмотрели свойства фосфора и ответили на вопрос: чем является фосфор – металлом или неметаллом? Это типичный неметаллический элемент, обладающий высокой химической активностью.
Источник
Leonard B.
11 октября 2018 · 11,0 K
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия. · tele.click/real_italy
Прикладной ответ:
1) Углерод (С; 6) vs Натрий (Na; 11). Тут конечно Натрий имеет более выраженные металлические свойства, так как находиться в левой части таблице.
2)Фосфор (P;15) и Хлор (Cl; 17). Атомы находятся в одном периоде, соответственно Фосфор более левей расположился и потому имеет незначительно больше металлических свойств.
3) Фтор (F; 9) и Хлор (Cl; 17). Тут победитель – хлор, поскольку он находиться ниже относительно фтора.
Теоретический ответ и обоснование:
1) При перемещении вдоль периода, слева на право, металлический свойства уменьшаются. Соответственно неметаллические возрастают.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2) При перемещении сверху вниз по группам
металлические свойства элементов усиливаются. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой “шубой” из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
3) Визуально, для быстрой оценки очень удобно представлять таблицу Менделеева в виде прямоугольника, где оранжевая часть отвечает за металлические элементы, а фиолетовая за неметаллические. А направление стрелок указывают на увеличение металлических свойств. Мне в свое время очень помогло разобраться и запомнить данные тенденции. И да, линия смены металлов и неметаллов условная и именно по этому данная табличка не содержит каких-то границ переходных атомов. Используйте с умом.
Как определить валентность и степень окисления веществ Сl2, CO2, C2H6, C2H4?
Валентность(максимальная) определяется согласно номеру группы,так же есть переходные валентности.
Степень окисления зависит от того,кем является тот или иной атом в молекуле(Донором электронов,или акцептором)(отдаёт электроны,или принимает)
Степени окисления:
Cl2 – это молекула с нулевой степенью окисления,т.как не входит в состав соединения,и делит свои электроны между 2мя равноценными атомами.
CO2 – здесь у кислорода его характерная степень окисления = – 2,а у углерода,дабы скомпенсировать 4 минуса( т.как каждый из кислородов дает по -2) степень окисления = +4
C2H6 – это этан, степень окисления каждого водорода = +1 ,степень окисления каждого углерода = -3 (при этом,валентность углерода в органических соединения постоянна равна 4 )
C2H4 – Этен(этилен) ,степень окисления каждого водорода = +1, каждого углерода = -2)
Подведя итог,можно сказать что валентность,зачастую, определяется по периодической системе(таблице Менделеева) и,для упрощения понимания, представьте что валентность,это количество “рук” которые атом может протянуть на образование связи .
Степень окисления – это условный заряд атома,который показывает число полученных(в этом случае пишут – *число*),или отданных (в этом случае пишут +*число*) электронов.
Чтобы легко определять степень окисления,запомните некоторые “основы”
У кислорода почти всегда = -2 , у водорода почти всегда = +1 , у металлов почти всегда + степени окисления, и атомы компенсируют друг друга “разными по знаку” зарядами.
Надеюсь более-менее понятно объяснил,если возникли вопросы,пишите в комментарии или мне в личку.
Какой процессор выбрать? Старый — Amd Phenom ii x6 1090t — сгорел. Мать — Gigabyte Ga-ma770-ud3.
Список поддерживаемых процессоров Вашей материнской платой.
Ничего более современного (линейка процессоров AM3+) материнская плата не поддерживает, поэтому Вы ограничены процессорами только линейки AM3.
Устанавливать стоит что-то из аналогичной серии Phenom II X6 (1035-1100) либо Phenom II X4 (925-980). Двухъядерные решения рассматривать не стоит, у них крайне низкая производительность по современным меркам, часто они даже не справляются с обработкой видео потока с YouTube.
Идеальным вариантом будет смена платформы, базовый двухъядерный процессор от AMD на ядрах Zen – Athlon 200GE, обходит по производительности топовый на свое время Phenom II X6 1090t, при энергопотреблении почти в 4 раза меньше.
Источник
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Напомню, что в одной из предыдущих частей мы ввели такие понятия как металлические и неметаллические свойства, теперь же пришло время научится отличать металлы от неметаллов по таблице Менделеева.
Многие из Вас, столкнувшись с данным вопросом, могут справедливо заметить, дескать: “Ха, вот глупости. Автор не от мира сего, ведь металлы и неметаллы в таблице Менделеева отмечены разным цветом! Как сейчас помню таблицу Менделеева в учебнике, где неметаллы отмечены красным цветом, а металлы – чёрным и зелёным. Шах и мат.”
Не спешите с критикой
Это всё замечательно, отвечу я, да только учащиеся, что приходят на экзамен по химии, получают чёрно-белый вариант таблицы Менделеева и Ваше возможное замечание окажется неуместно.
Тот самый черно-белый вариант
И прежде чем мы всё-таки ответим на поставленный вопрос, нам необходимо освоить несколько базовых химических понятий, касающихся работы с таблицей Менделеева. Дело в том, что помимо довольно однозначно определяемых периодов и групп, в таблице Менделеева есть место так же и для, так называемым, подгрупп.
С сегодняшнего дня мы начнём различать главную подгруппу (или подгруппу А) и побочную подгруппу (или подгруппу В).
Как же определить к какой подгруппе относится тот или иной химический элемент?
На отношение к той или иной подгруппе химического элемента нам могут указать следующие знаки:
Во-первых, нередко в шапочке, где указан номер группы, к которому относится столбец, есть указание и на подгруппы:
Главная подгруппа – А, побочная – В
Во-вторых, само положение химического символа химического элемента в ячейке указывает на отношение к подгруппе. Так, если химический символ химического элемента смещён относительно центра ячейки влево, то мы имеем дело с элементом главной подгруппы (подгруппы А), если же вправо – то побочной подгруппы (подгруппы В)
Например, в совершенно случайной чёрно-белой таблице Менделеева мы видим, что фосфор относительно центра ячейки смещён влево, это значит, что фосфор – элемент главной подгруппы (подгруппы А) пятой группы.
“адрес” фосфора: P – II (период), VА (группа – подгруппа), 15 (порядковый номер).
Как понятие о подгруппах поможет нам отличать металлы от неметаллов?
А вот как: дело в том, что все элементы побочных подгрупп – это металлы!
Красным выделены все элементы побочных подгрупп первых шести периодов. Все они – металлы.
А через элементы главных подгрупп мы можем провести одну особенную диагональ, которая “отсечёт” металлы от неметаллов.
Данная диагональ проходит через такие неметаллы, как бор (B) – кремний (Si) – мышьяк (As) – теллур (Te) – астат (As).
Зелёным цветом выделены все неметаллы в таблице Менделеева
Таким образом все элементы главных подгрупп, что лежат ниже и левее данной диагонали являются металлами, а все, что лежат выше и правее – неметаллами.
Однако нельзя не заметить, что деление на металлы (Ме) и неметаллы (неМе) всё же несколько условно, а некоторые таблицы, Менделеева, которые Вы можете найти в сети, игнорируют указанные мной правила работы с подгруппами.
В следующей части мы выделим закономерности, согласно которым металлические и неметаллические свойства изменяются в пределах рассматриваемой Периодической системы Менделеева и разберёмся, какое отношение к этому имеет атомный радиус. А на этом у меня всё. Спасибо. Пока.
Источник
