Какой элемент имеет более выраженные неметаллические свойства фосфор или хлор

А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Leonard B.
11 октября 2018 · 9,9 K
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия. · tele.click/real_italy
Прикладной ответ:
1) Углерод (С; 6) vs Натрий (Na; 11). Тут конечно Натрий имеет более выраженные металлические свойства, так как находиться в левой части таблице.
2)Фосфор (P;15) и Хлор (Cl; 17). Атомы находятся в одном периоде, соответственно Фосфор более левей расположился и потому имеет незначительно больше металлических свойств.
3) Фтор (F; 9) и Хлор (Cl; 17). Тут победитель – хлор, поскольку он находиться ниже относительно фтора.
Теоретический ответ и обоснование:
1) При перемещении вдоль периода, слева на право, металлический свойства уменьшаются. Соответственно неметаллические возрастают.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2) При перемещении сверху вниз по группам
металлические свойства элементов усиливаются. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой “шубой” из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
3) Визуально, для быстрой оценки очень удобно представлять таблицу Менделеева в виде прямоугольника, где оранжевая часть отвечает за металлические элементы, а фиолетовая за неметаллические. А направление стрелок указывают на увеличение металлических свойств. Мне в свое время очень помогло разобраться и запомнить данные тенденции. И да, линия смены металлов и неметаллов условная и именно по этому данная табличка не содержит каких-то границ переходных атомов. Используйте с умом.
Если валентность элемента равна номеру группы,то почему у Cl, у которого по идеи должно быть 7 валентных ē, всего 1 неспаренный,получается у него валентность-1?
В основном состоянии у хлора действительно 1 неспаренный электрон,это видно,если заполнить внешний подуровень
В принципе можно “выбить” все 7 электронов ,и,как следствие,хлор перейдет в степень окисления +7(не путайте понятие степени окисления и валентности,они похожи,но не равны).
Другое дело,что ему проще 1 электрон забрать у кого-либо,и получить завершенный внешний подуровень(а именно к этому и стремятся все элементы,отдавая и принимая электроны,строение внешнего подуровня и объясняет активность элементов)
У хлора 7 валентных электронов – это значит,что они могут быть “оторваны” от него ,перейдя к другому элементу. Валентность электронов не означает,что они должны быть не спарены.
Прочитать ещё 2 ответа
Какое существует объяснение наличию на планете Земля всех элементов таблицы Менделеева?
Researcher, Institute of Physics, University of Tartu
Все химические элементы получаются в результате термоядерного синтеза внутри звезд и тому подобных объектов. Когда температура достаточно велика, то возможно образование любых ядер, но, естественно, выживают наиболее устойчивые, а лучше всего образуются те, реакция формирования которых наиболее энергетически выгодна, а реакция распада – наименее. Есть разнообразные теории на тему того, почему и как идут термоядерные процессы и что там наиболее устойчиво и выгодно. Общее место этих теорий – термоядерный синтез энергетически выгоден вплоть до железа, элементы тяжелее железа из него будут образовываться уже с затратами энергии, то есть нужна подпитка. Именно поэтому, если Вы посмотрите на таблицу Менделеева, то увидите, что все распространенные элементы легче или примерно в районе железа, а заметно более тяжелые – редкие и рассеянные. То есть, пока энергии в этом звездообразном объекте достаточно, чтобы разогнать реакцию, они могут образовываться, но, вообще говоря, их формирование энергетически невыгодно, они остужают систему, а не разогревают ее. Потом, когда Земля остыла до температур, несовместимых с термоядерным синтезом, элементный состав более менее “заморозился”.
Почему все элементы пристутствуют в составе Земли? Ну, во-первых, не все, есть полученные искуственно, но не существующие на Земле, а во-вторых, по той причине, что термоядерный синтез – хаотический и неселективный высокоэнергетический процесс, в результате которого образуется всё, что попало. Ну, и то, что может выжить – выживает.
Перечислите основные свойства металлов. Назовите чем эти свойства обусловлены?
Дипломированный специалист в прикладной математике и физике. Профессиональный химик -… · chemiday.com
Металлы хорошо проводят тепло и электричество – это обусловлено подвижностью электронов в кристаллической решётке металлов.
Металлы блестят (“металлический блеск”) – также обусловлено наличием подвижных, почти свободных электронов в решётке.
Большинство металлов химически активны и легко выступают в роли восстановителя – это обусловлено наличием слабо связанного 1 , 2 или 3-х электронов на внешнем электронном уровне.
Почему говорят, что благополучие западных стран основано на разграблении остального мира – есть ли доля правды здесь?
Историк. Работаю в сфере образования.
Администратор портала https://исторический-сайт.рф/ · исторический-сайт.рф
Да, значительная доля правды здесь есть.
Это началось в период, когда в западной Европе зарождались капиталистические отношения. Первоначальное накопление капитала осуществлялось не только за счет собственного народа, но и за счет других стран (через грабежи, насилие, обман).
В дальнейшем большая часть мира была поделена между ведущими державами при помощи колониальных захватов. Колонии являлись источником дешевого сырья и рынками сбыта. Хотя метрополии и несли свою культуру в колонии, однако главной целью было использование данных стран для своей экономики. Колонии значительно отставали в развитии от метрополий (никому не нужны конкуренты).
В 20 веке колониальная система была разрушена, однако бывшие метрополии, во многом, сохранили свое экономическое влияние и превосходство. И новым игрокам вытеснить кого-то с рынка очень проблематично, поэтому зачастую такие страны периферийного капитализма специализируются только на отдельных отраслях.
Прочитать ещё 34 ответа
Источник
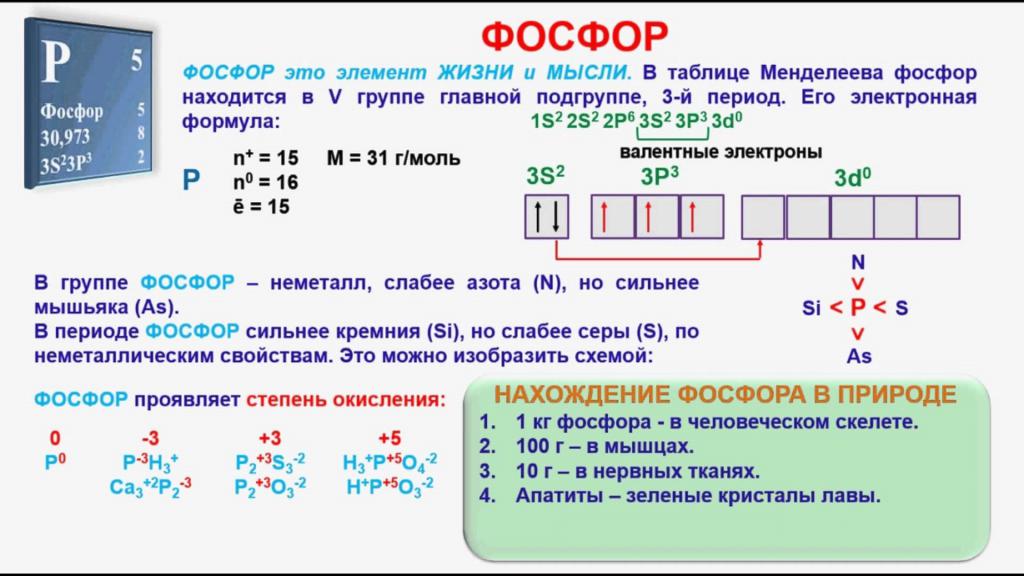
В главной подгруппе пятой группы, наряду с азотом, находится еще и фосфор. Металлом или неметаллом можно считать этот элемент? По сравнению с азотом он имеет более низкую электроотрицательность, однако все же относится к активным неметаллам. В нашей статье мы рассмотрим важнейшие физические и химические свойства фосфора, а также определим области его применения в промышленности.
Положение элемента в периодической системе
Фосфор относится к p-элементам, его атом имеет три энергетических уровня. На последнем из них расположено пять электронов, три из которых являются неспаренными. В возбужденном состоянии атом P содержит пять свободных электронов. Этот факт объясняет появление соединений фосфора, в которых он не трехвалентен, но имеет валентность, равную пяти, например, P2O5 – пятиокись фосфора. Неметалл, вследствие своей высокой активности, в природе отсутствует в свободном состоянии и встречается только в виде соединений. Природный элемент имеет единственный стабильный изотоп с относительной атомной массой, равной 31. Фосфор входит в состав многих горных пород и минералов, его содержание в составе земной коры составляет 0,08%.

Аллотропные модификации
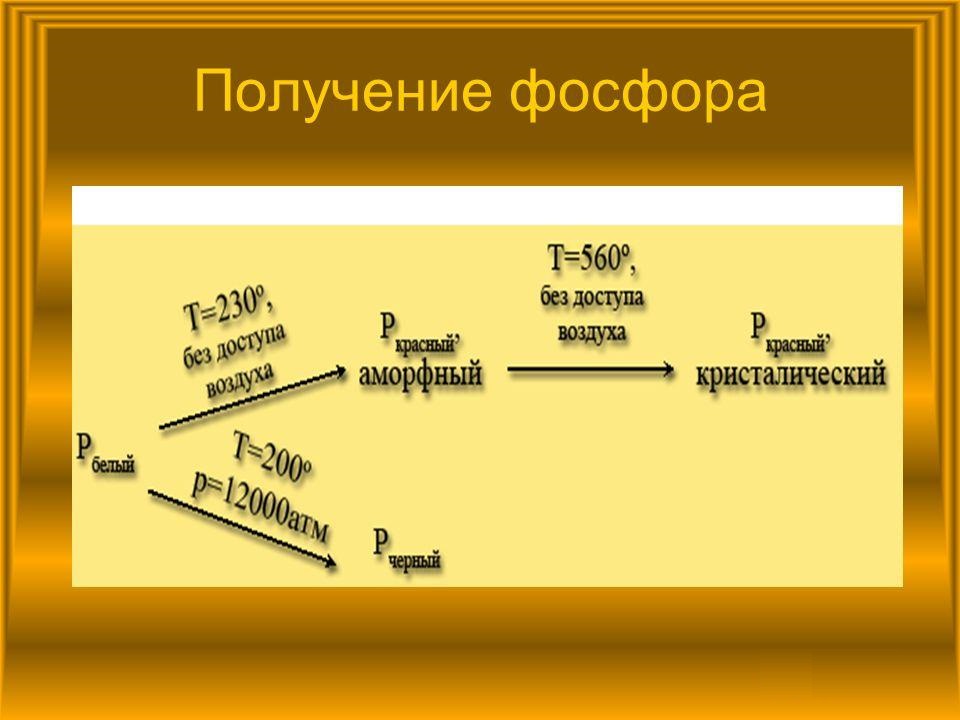
Различное расположение атомов в кристаллических решетках вещества приводит к появлению некоторых видоизменений. Например, черный фосфор очень напоминает графит. Он такой же жирный на ощупь и проявляет полупроводниковые свойства. В промышленности материал получают из белого фосфора, нагревая последний до 200°С и подвергая давлению в 12000 атм.
Красный фосфор – это порошковидное неядовитое вещество. При его детальном изучении было установлено, что соединение представляет собой смесь видоизменений фосфора, которые различаются между собой некоторыми признаками, например, цветом.
Еще одна аллотропная модификация – белый фосфор. Металлом или неметаллом он является? Это вещество проявляет типичные неметаллические свойства, кроме того, оно очень токсично. Получают его, концентрируя пары фосфора. В отличие от красного вида, он может растворяться в сероуглероде. Если белый фосфор длительно подвергать слабому нагреванию, он переходит в модификацию красного фосфора.
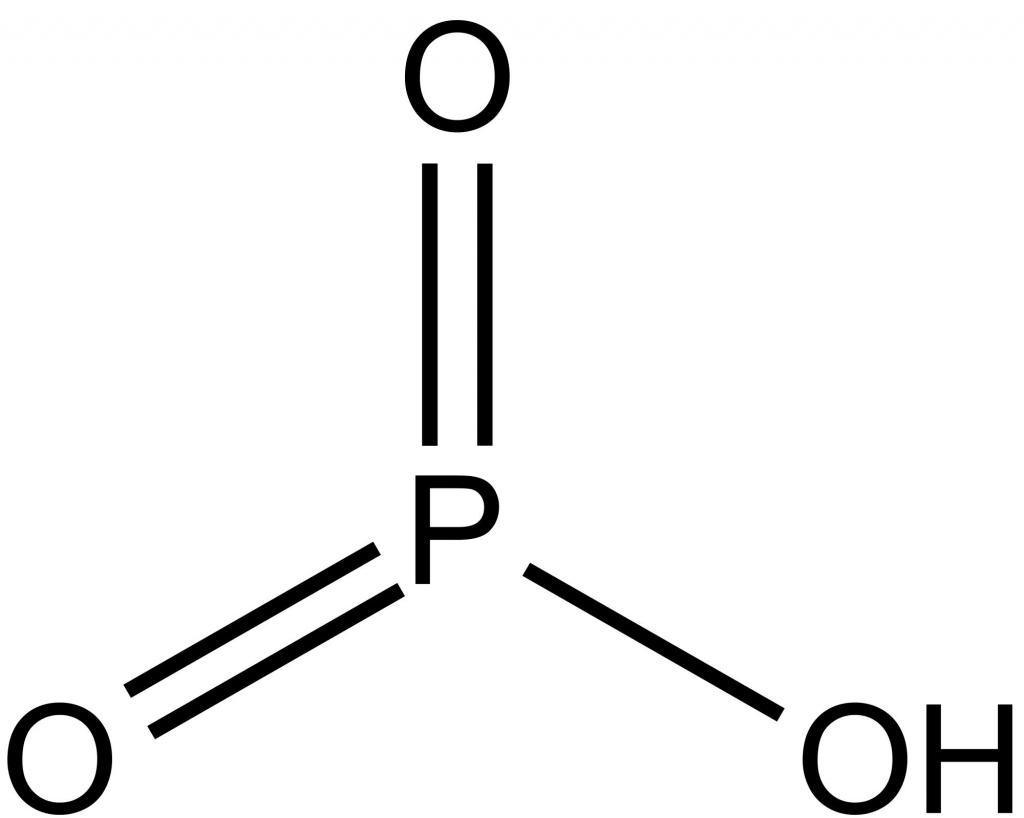
Химическая характеристика
В своих соединениях с другими элементами P может проявлять следующие степени окисления: +3, +5, -3. В парообразном состоянии при температуре ниже 800°, а также в жидкой фазе молекула вещества имеет формулу P4.
Различные модификации вещества имеют непохожие химические признаки. Как ответить на вопрос, чем является фосфор – металлом или нет? Нужно обратиться к строению его атома, который в возбужденном состоянии имеет пять валентных электронов. Наиболее активным в химическом плане неметаллом будет белый фосфор, который уже при обычной температуре легко окисляется, в процессе чего начинает светиться, а также может самовоспламеняться. По этим причинам его рекомендуется хранить покрытым водой. Красный фосфор по своим свойствам является менее активным веществом, чем его белая модификация.
Бинарные соединения
Как металл или неметалл, фосфор может реагировать с кислородом:
4P + 3O2 → 2P2O3
Продуктом реакции является газообразный фосфин – очень токсичное вещество, применяемое в качестве химического оружия. Его легко распознаеть по специфическому запаху чеснока. Гидрид фосфора способен присоединять галогеноводороды, например, такие, как йодоводород, образуя соединение – йодид фосфония PH4I. Взаимодействие с металлами приводит к появлению фосфидов:
2P + 3Ca = Ca3P2.
Как металл, фосфор реагирует и с неметаллами, например, с серой, углеродом, хлором:
2P + 3Cl2 = 2PCl3
Фосфиды легко вступают в реакцию с водой, разлагаясь до фосфина:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3(фосфин)
Оксиды
Среди бинарных соединений элемента с кислородом наиболее важными являются его оксиды: P2O5 и P2O3. Триокись фосфора, иначе называемая фосфорным ангидридом, представляет собой кристаллическое соединение, температура плавления которого – 22,5°. В обычных условиях оно имеет вид воскоподобной массы. В лаборатории его получают сжиганием фосфора в атмосфере, бедной кислородом. Хотя этот оксид и проявляет свойства сильного восстановителя, применяется он крайне редко из-за высокой токсичности. Какие же свойства, металла или неметалла, фосфор оксид проявляет в своих реакциях? Он может реагировать с водой, образуя ортофосфорную кислоту и фосфин. Вещество взаимодействует с хлороводородом, в результате получаются фосфатная кислота и хлорид фосфора.
Другое соединение – пятиокись фосфора, имеет признаки типичного кислотного оксида. Его можно получить в результате сжигания порции фосфора в атмосфере с избытком кислорода. В обычных условиях с водой соединение реагирует очень активно и образует метафосфорную, а при нагревании – ортофосфорную кислоту. Кроме того, пятиокись фосфора отнимает влагу, поэтому может применяться в качестве осушителя для жидких веществ и газов.
Фосфорные кислоты
Наиболее известные фосфорные кислоты – это метафосфорная, ортофосфорная и пирофосфорная, формула которой H4P2O7. Последняя из них образуется при нагревании H3PO4. Наибольшее практическое значение имеет ортофосфорная кислота, соли которой применяют в качестве сырья для получения минеральных удобрений. Она представляет собой твердое вещество белого цвета, очень хорошо растворимое в воде. Являясь кислотой средней силы, она не имеет ярко выраженных окислительных свойств. Как электролит, диссоциирует ступенчато, поэтому образует два ряда солей: средние – фосфаты, кислые – гидрофосфаты и дигидрофосфаты. В промышленности фосфатную кислоту получают термическим и экстракционным способом. Так как оксидам фосфора соответствуют кислоты, то на вопрос, чем является фосфор – металлом или неметаллом, ответ будет однозначным: это активный неметаллический элемент.

Распространение в природе
Наиболее важный минерал, содержащий высокую концентрацию фосфора – это апатит. Он имеет много разновидностей, самая распространенная из которых – фторапатит. Еще один вид минерала, состоящий из соединений фосфора – осадочная порода фосфорит.
Элемент входит в группу десяти важнейших для живых организмов химических элементов. Наибольшее его содержание обнаружено в форме фосфолипидов – органических соединений, которые входят в состав клеточных мембран, гормонов и других биологически активных веществ. Высокое содержание элемента (около 0,38%) регистрируется в нервной ткани, образующей центральный и периферический отделы нервной системы человека и других позвоночных животных. Кроме этого, соединения фосфора входят в мышечную и костную ткань. В последней присутствует фосфат кальция – соль, придающая дентину зубов и костям прочность и высокую твердость. В обмене веществ растительных организмов, наряду с магнием и железом, фосфор играет важную роль в качестве регулятора процессов формирования и созревания плодов и семян. Именно поэтому, вместе с азотом и калием, фосфор считается основным питательным элементом растений.

В нашей статье мы рассмотрели свойства фосфора и ответили на вопрос: чем является фосфор – металлом или неметаллом? Это типичный неметаллический элемент, обладающий высокой химической активностью.
Источник
Вариант 1
1. У какого элемента сильнее выражены неметаллические свойства: а) у кислорода или углерода; б) у фосфора или мышьяка? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у кислорода (неметалличность усиливается слева направо по периоду)
б) у фосфора (неметалличность усиливается снизу вверх по группе)
2. Дайте характеристику элемента №11 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Как и почему изменяются свойства химических элементов в периодах? Покажите это на примере элементов 3-го периода.
4. Рассчитайте относительную атомную массу бора, если известно, что доля изотопа 10B составляет 19,6%, а изотопа 11В – 80,4 %. (Ответ: 10,8.)
Вариант 2
1. У какого элемента сильнее выражены металлические свойства:
а) у лития или рубидия; б) у калия или скандия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у рубидия (металличность усиливается сверху вниз по группе)
б) у калия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №7 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула

3. Как изменяются свойства химических элементов в А-группах? Покажите это на примере элементов IIA-группы.
4. Сколько различных видов молекул оксида углерода (IV) можно получить из изотопа углерода 12C и трех изотопов кислорода: 16О, 17О, 18О? Напишите формулы всех оксидов и рассчитайте их молярные массы.
Вариант 3
1. У какого элемента сильнее выражены неметаллические свойства: а) у хлора или йода; б) у серы или кремния? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у хлора (неметалличность усиливается снизу вверх по группе)
б) у серы (неметалличность усиливается слева направо по периоду)
2. Дайте характеристику элемента №12 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Какие общие свойства проявляют элементы одних и тех же групп? Покажите это на примере элементов VIIA-группы.

4. Медь имеет два изотопа: 63Cu и 65Cu. Их доли в природной меди составляют 73 и 27? Соответственно. Рассчитайте среднюю относительную массу меди. (Ответ: 63,5.)
Вариант 4
1. У какого элемента сильнее выражены металлические свойства: а) у бериллия или стронция; б) у натрия или алюминия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у стронция (металличность усиливается сверху вниз по группе)
б) у натрия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №16 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Что общего и каковы различия в строении малых и больших периодов? Покажите это на примере 3-го и 4-го периодов.
Малые периоды состоят из одного ряда (3-й период), большие и двух рядов (4-й период). Свойства элементов меняются строго от металлов к неметаллам в любом периоде. 4-й период содержит на 10 элементов больше, чем 3-й. Эти элементы являются переходными металлами, у них заполняется d-подоболочка предыдущего энергетического уровня.
4. Оксид элемента имеет состав ЭО3. Массовая доля кислорода в этом оксиде составляет 60%. Какой элемент образуется оксид?
Источник
