Какой металл содержится в хлорофилле
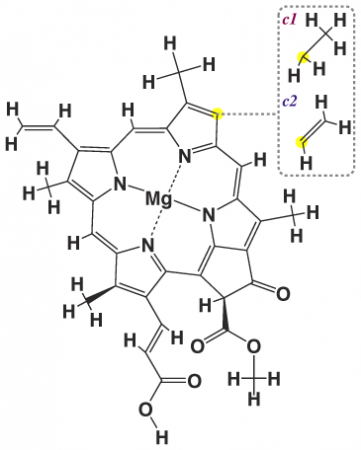
Строение хлорофилла c1 и c2
Хлорофи́лл (от греч. χλωρός, «зелёный» и φύλλον, «лист») — зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет. При его участии происходит фотосинтез. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и близки гему.
Хлорофилл зарегистрирован в качестве пищевой добавки Е140.
История открытия[править | править код]
В 1817 году Жозеф Бьенеме Каванту и Пьер Жозеф Пеллетье выделили из листьев растений зелёный пигмент, который они назвали хлорофиллом[1]. В 1900-х годах Михаил Цвет[2] и Рихард Вильштеттер независимо обнаружили, что хлорофилл состоит из нескольких компонентов. Вильтштеттер очистил и кристаллизовал два компонента хлорофилла, названные им хлорофиллами а и b и установил брутто-формулу хлорофилла а. В 1915 году за исследования хлорофилла ему была вручена Нобелевская премия. В 1940 Ханс Фишер, получивший в 1930 Нобелевскую премию за открытие структуры гема, установил химическую структуру хлорофилла a. Его синтез был впервые осуществлен в 1960 Робертом Вудвордом[3], а в 1967 была окончательно установлена его стереохимическая структура[4].
В природе[править | править код]
Цвет листвы фотосинтезирующих растений обусловлен высокой концентрацией хлорофилла
Хлорофилл присутствует во всех фотосинтезирующих организмах — высших растениях, водорослях, синезелёных водорослях (цианобактериях), фотоавтотрофных простейших (протистах) и бактериях.
Некоторые высшие растения, наоборот, лишены хлорофилла (как, например, петров крест).
Синтез[править | править код]
Синтезирован Робертом Вудвордом в 1960 году.
Синтез включает в себя 15 реакций, которые можно разделить на 3 этапа. Исходными веществами для синтеза хлорофилла являются глицин и ацетат. На первом этапе образуется аминолевулиновая кислота. На втором этапе происходит синтез одной молекулы протопорфирина из четырёх пиррольных колец. Третий этап представляет собой образование и превращение магнийпорфиринов.
Свойства и функция при фотосинтезе[править | править код]
В процессе фотосинтеза молекула хлорофилла претерпевает изменения, поглощая световую энергию, которая затем используется в фотохимической реакции взаимодействия углекислого газа и воды с образованием органических веществ (как правило, углеводов):
После передачи поглощенной энергии молекула хлорофилла возвращается в исходное состояние.
Хотя максимум непрерывного спектра солнечного излучения расположен в «зелёной» области 550 нм (где находится и максимум чувствительности глаза), поглощается хлорофиллом преимущественно синий, частично — красный свет из солнечного спектра (чем и обуславливается зелёный цвет отражённого света).
Растения могут использовать и свет с теми длинами волн, которые слабо поглощаются хлорофиллом. Энергию фотонов при этом улавливают другие фотосинтетические пигменты, которые затем передают энергию хлорофиллу. Этим объясняется разнообразие окраски растений (и других фотосинтезирующих организмов) и её зависимость от спектрального состава падающего света.
Химическая структура[править | править код]
Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумя карбоксильными заместителями (свободными или этерифицированными). Так, хлорофилл a имеет карбоксиметиловую группу при С10, фитоловый эфир пропионовой кислоты — при С7. Удаление магния, легко достигаемое мягкой кислотной обработкой, дает продукт, известный как феофитин. Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида (хлорофиллид, лишенный атома металла, известен как феофорбид a).
Все эти соединения интенсивно окрашены и сильно флуоресцируют, исключая те случаи, когда они растворены в органических растворителях в строго безводных условиях. Они имеют характерные спектры поглощения, пригодные для качественного и количественного определения состава пигментов. Для этой же цели часто используются также данные о растворимости этих соединений в соляной кислоте, в частности для определения наличия или отсутствия этерифицированных спиртов. Хлороводородное число определяется как концентрация HCl (%, масс./об.), при которой из равного объёма эфирного раствора пигмента экстрагируется 2/3 общего количества пигмента. «Фазовый тест» — окрашивание зоны раздела фаз — проводят, подслаивая под эфирный раствор хлорофилла равный объём 30%-го раствора KOH в MeOH. В интерфазе должно образовываться окрашенное кольцо. С помощью тонкослойной хроматографии можно быстро определять хлорофиллы в сырых экстрактах.
Хлорофиллы неустойчивы на свету; они могут окисляться до алломерных хлорофиллов на воздухе в метанольном или этанольном растворе.
Хлорофиллы образуют комплексы с белками in vivo и могут быть выделены в таком виде. В составе комплексов их спектры поглощения значительно отличаются от спектров свободных хлорофиллов в органических растворителях.
Хлорофиллы можно получить в виде кристаллов. Добавление H2O или Ca2+ к органическому растворителю способствует кристаллизации.
| Хлорофилл a | Хлорофилл b | Хлорофилл c1 | Хлорофилл c2 | Хлорофилл d | Хлорофилл f | |
|---|---|---|---|---|---|---|
| Формула | C55H72O5N4Mg | C55H70O6N4Mg | C35H30O5N4Mg | C35H28O5N4Mg | C54H70O6N4Mg | C55H70O6N4Mg |
| C2 группа | -CH3 | -CH3 | -CH3 | -CH3 | -CH3 | -CHO |
| C3 группа | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CHO | -CH=CH2 |
| C7 группа | -CH3 | -CHO | -CH3 | -CH3 | -CH3 | -CH3 |
| C8 группа | -CH2CH3 | -CH2CH3 | -CH2CH3 | -CH=CH2 | -CH2CH3 | -CH2CH3 |
| C17 группа | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl |
| C17-C18 связь | Одинарная | Одинарная | Двойная | Двойная | Одинарная | Одинарная |
| Распространение | Везде | Большинство наземных растений | Некоторые водоросли | Некоторые водоросли | Цианобактерии | Цианобактерии |
Общая структура хлорофилла a, b и d
Оптический спектр поглощения хлорофиллов a (голубой) и b (красный)
Хроматограмма зелёного пигмента растений
Применение[править | править код]
Хлорофилл находит применение как пищевая добавка (регистрационный номер в европейском реестре E140), однако при хранении в этанольном растворе, особенно в кислой среде, неустойчив, приобретает грязно-коричнево-зеленый оттенок, и не может использоваться как натуральный краситель. Нерастворимость нативного хлорофилла в воде также ограничивает его применение в качестве натурального пищевого красителя. Но хлорофилл вполне успешно используется в качестве натуральной замены синтетических красителей при изготовлении кондитерских изделий.[источник не указан 3145 дней]
Производное хлорофилла — хлофиллин медный комплекс (тринатриевая соль) получил распространение в качестве пищевого красителя (Регистрационный номер в европейском реестре E141). В отличие от нативного хлорофилла, медный комплекс устойчив в кислой среде, сохраняет изумрудно-зеленый цвет при длительном хранении и растворим в воде и водно-спиртовых растворах. Американская (USP) и Европейская (EP) фармакопеи относят хлорофиллид меди к пищевым красителям, однако вводят лимит на концентрацию свободной и связанной меди (тяжелый металл).
Хлорофилл придаёт листьям зелёный цвет и поглощает свет при фотосинтезе
В клетках эукариотов хлорофилл обычно находится в хлоропластах
Карта распределения хлорофилла по поверхности мирового океана в период с 1998 по 2006 по данным спутникового прибора SeaWiFS
Примечания[править | править код]
- ↑ Pelletier and Caventou (1817) «Notice sur la matière verte des feuilles»(Замечания о зелёном материале листmtd), Journal de Pharmacie, 3 : 486—491.
- ↑ M. Tswett (1906) Physikalisch-chemische Studien über das Chlorophyll. Die Adsorptionen. (Физико-химические исследования хлорофилла. Адсорбция.) Ber. Dtsch. Botan. Ges. 24, 316—323 .
- ↑ R. B. Woodward, W. A. Ayer, J. M. Beaton, F. Bickelhaupt, R. Bonnett. THE TOTAL SYNTHESIS OF CHLOROPHYLL (EN) // Journal of the American Chemical Society. — 1960. — Т. 82, вып. 14. — С. 3800–3802. — doi:10.1021/ja01499a093.
- ↑ Ian Fleming. Absolute Configuration and the Structure of Chlorophyll (англ.) // Nature. — 1967-10-14. — Vol. 216, iss. 5111. — P. 151–152. — doi:10.1038/216151a0.
Ссылки[править | править код]
- Монтеверде Н. А., Любименко В. Н. Исследования над образованием хлорофилла у растений // Известия Императорской Академии наук. VII серия. — СПБ., 1913. — Т. VII, № 17. — С. 1007–1028.
- Speer, Brian R. (1997). «Photosynthetic Pigments» на сайте UCMP Glossary (online). University of California, Berkeley Museum of Paleontology. Verified availability August 4, 2005. (англ.)
- Chlorophyll d: the puzzle resolved (англ.)
- Билич Г. Л., Крыжановский В. А. Биология. Полный курс: В 4 т. — издание 5-е, дополненное и переработанное. — М.: Издательство Оникс, 2009. — Т. 1. — 864 с. — ISBN 978-5-488-02311-6
Источник
| Хлорофилл а | |
|---|---|
| Систематическое наименование | '”`UNIQ--nowiki-00000000-QINU`”‘ |
| Хим. формула | C55H72Mg1O5N4 |
| Молярная масса | 893,51 г/моль |
| Плотность | 1,079 г/см³ |
| Температура | |
| • плавления | 152,3 °С (разлагается) |
| Растворимость | |
| • в воде | в воде не растворим |
| • в | Хорошо растворим в этаноле, простых эфирах, петролейном эфире, ацетоне, C6H6, CHCl3. |
| Рег. номер CAS | 479-61-8 |
| PubChem | 6433192 |
| Рег. номер EINECS | 207-536-6 |
| SMILES | CCC1=C(C2=NC1=CC3=C(C4=C([N-]3)C(=C5[C@H]([C@@H](C(=N5)C=C6C(=C(C(=C2)[N-]6)C=C)C)C)CCC(=O)OC/C=C(C)/CCCC(C)CCCC(C)CCCC(C)C)[C@H](C4=O)C(=O)OC)C)C.[Mg+2] |
| InChI | InChI=1S/C55H73N4O5.Mg/c1-13-39-35(8)42-28-44-37(10)41(24-25-48(60)64-27-26-34(7)23-17-22-33(6)21-16-20-32(5)19-15-18-31(3)4)52(58-44)50-51(55(62)63-12)54(61)49-38(11)45(59-53(49)50)30-47-40(14-2)36(9)43(57-47)29-46(39)56-42;/h13,26,28-33,37,41,51H,1,14-25,27H2,2-12H3,(H-,56,57,58,59,61);/q-1;+2/p-1/b34-26+;/t32?,33?,37-,41-,51+;/m0./s1 ATNHDLDRLWWWCB-WJQLOWBJSA-M |
| ChEBI | 18230 |
| ChemSpider | 16736115 |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорофи́лл a — особая форма хлорофилла, используемая для оксигенного фотосинтеза. Сильнее всего поглощает свет в фиолетово-голубой и оранжево-красной части спектра[1]. Этот пигмент жизненно необходим для фотосинтеза в клетках эукариот, цианобактерий и прохлорофитов из-за своей способности отдавать возбуждённые электроны в электрон-транспортную цепь[2]. Хлорофилл a также является частью антенного комплекса и передаёт резонансную энергию, которая затем поступает в реакционный центр, где расположены специальные хлорофиллы P680 и P700[3].
Распространённость хлорофилла a[править | править код]
Хлорофилл a необходим большинству фотосинтезирующих организмов для преобразования энергии света в химическую энергию, но это не единственный пигмент, который может быть использован для фотосинтеза. Все организмы с оксигенным типом фотосинтеза используют хлорофилл a, но имеют разные вспомогательные пигменты, как, например хлорофилл b[2]. В небольших количествах можно обнаружить хлорофилл a у зелёных серобактерий — анаэробных фотоавтотрофов[4]. Эти организмы используют бактериохлорофиллы и некоторое количество хлорофилла a, но не производят кислород[4]. Такой фотосинтез называется аноксигенным.
Структура молекулы[править | править код]
Молекула хлорофилла состоит из кольца хлорина с ионом Mg в центре, радикалов-заместителей в кольце и фитольного хвоста.
Кольцо хлорина[править | править код]
Хлорофилл a состоит из центрального иона магния, заключённого в кольцо из четырёх ионов азота, также известного как хлорин. Хлориновое кольцо — это гетероциклическое соединение, образованное из пирролов, окружающих атом металла. Именно Mg в центре однозначно отличает структуру молекулы хлорофилла от других молекул[5].
Заместители[править | править код]
Структура молекулярного центра хлорофилла a. Зелёной рамкой выделена позиция у третьего атома углерода, где располагается важная для его свойств метильная группа.
В кольце хлорофилла a есть заместители. Каждый тип хлорофиллов характеризуется своими заместителями, и, соответственно, своим спектром поглощения[6]. В качестве заместителей хлорофилл a содержит только метильные группы (CH3). В хлорофилле b метильная группа у третьего атома кольца (зелёная рамочка на картинке) замещена на альдегидную группу[4]. Порфириновое кольцо бактериохлорофиллов более насыщено — в нём не хватает чередования одинарной и двойной связи, что сужает спектр поглощаемого молекулами света[7].
Фитольный хвост[править | править код]
К порфириновому кольцу присоединён длинный фитольный хвост[2]. Это длинный гидрофобный радикал, который прикрепляет хлорофилл a к гидрофобным белкам мембраны тилакоида[2]. Отсоединившись от порфиринового кольца, этот длинный гидрофобный хвост становится предшественником двух биомаркёров — пристана и фитана, оба из которых важны для геохимических исследований и определения качества нефти.
Биосинтез[править | править код]
В биосинтезе хлорофилла a принимают участие несколько ферментов[8]. Биосинтез бактериохлорофилла a и хлорофилла a осуществляют схожие ферменты, которые при некоторых условиях могут взаимно заменять друг друга[8]. Всё начинается с глутаминовой кислоты, которая превращается в 5-аминолевулиновую кислоту. Затем две молекулы этой кислоты восстанавливаются до порфобилиногена, четыре молекулы которого формируют протопорфирин IX[5]. После формирования протопорфирина фермент Mg-хелатаза катализирует включение иона Mg в структуру хлорофилла a[8]. Далее происходит циклизация радикала в шестом положении кольца и образуется протохлорофиллид, у которого в ходе светозависимой реакции с участием фермента протохлорофиллид-оксидоредуктаза происходит восстановление двойной связи в кольце D[5]. Завершается биосинтез хлорофилла присоединением фитольного хвоста[9].
Реакции фотосинтеза[править | править код]
Поглощение света[править | править код]
Спектры поглощения хлорофиллов a и b. Совместное использование обеих форм увеличивает спектр поглощения энергии света.
Спектр[править | править код]
Хлорофилл a поглощает свет в фиолетовой, голубой и красной частях спектра, отражая в основном зелёный цвет, что и придаёт ему характерную окраску. Спектр его поглощения расширяется за счёт вспомогательных пигментов[2] (например, хлорофилла b). В условиях плохой освещённости растения повышают соотношение хлорофилл b/хлорофилл a, синтезируя больше молекул первого, чем второго, и, таким образом, увеличивают производительность фотосинтеза[6].
Светособирающая система[править | править код]
Антенный комплекс, передающий энергию света через мембрану тилакоида. Хлорофилл a в реакционном центре — пигмент, способный передавать возбуждённые электроны переносчикам электронов.
Кванты света, поглощённые пигментами, возбуждают их электроны, в результате чего энергия света преобразуется в энергию химической связи. Поскольку молекулы хлорофилла a могут поглощать только световые волны определённой длины, многие организмы используют вспомогательные пигменты (помечены на рисунке жёлтым цветом), чтобы увеличить спектр поглощения[3]. Вспомогательные пигменты передают собранную энергию от одного пигмента к другому в виде резонансной энергии, до тех пор, пока она не достигнет специальной пары молекул хлорофилла a в реакционном центре[6] — P680 в фотосистеме II и P700 в фотосистеме I[10]. P680 и P700 — основные доноры электронов для электрон-транспортной цепи.
См. также[править | править код]
- Хлорофилл
- Фотосистема I
- Фотосистема II
- P680
- P700
Примечания[править | править код]
- ↑ PHOTOSYNTHESIS Архивировано 28 ноября 2009 года.
- ↑ 1 2 3 4 5 Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. Photosynthesis, Light, and Life // Biology of Plants (неопр.). — 7th. — W.H. Freeman (англ.)русск., 2005. — С. 119—127. — ISBN 0-7167-9811-5.
- ↑ 1 2 Papageorgiou,G, and Govindjee. Chlorophyll a Fluorescence, A Signature of Photosynthesis (англ.) : journal. — Springer, 2004. — Vol. 19. — P. 14,48,86.
- ↑ 1 2 3 Eisen J. A., Nelson K. E., Paulsen I. T., et al. The complete genome sequence of Chlorobium tepidum TLS, a photosynthetic, anaerobic, green-sulfur bacterium (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2002. — July (vol. 99, no. 14). — P. 9509—9514. — doi:10.1073/pnas.132181499. — PMID 12093901. See pages 9514,48,86.
- ↑ 1 2 3 Zeiger, Eduardo; Taiz, Lincoln. Ch. 7: Topic 7.11: Chlorophyll Biosynthesis // Plant physiology (неопр.). — 4th. — Sunderland, Mass: Sinauer Associates (англ.)русск., 2006. — ISBN 0-87893-856-7.
- ↑ 1 2 3
Lange, L.; Nobel, P.; Osmond, C.; Ziegler, H. Physiological Plant Ecology I – Responses to the Physical Environment (англ.). — Springer-Verlag, 1981. — Vol. 12A. — P. 67, 259. - ↑ Campbell, Mary K.; Farrell, Shawn O. Biochemistry (неопр.). — 6th. — Cengage Learning (англ.)русск., 2007. — С. 647. — ISBN 978-0-495-39041-1.
- ↑ 1 2 3
Suzuki J. Y., Bollivar D. W., Bauer C. E. Genetic Analysis of Chlorophyll biosynthesis (неопр.) // Annu. Rev. Genet. — 1997. — Т. 31, № 1. — С. 61—89. — doi:10.1146/annurev.genet.31.1.61. (недоступная ссылка) - ↑ Taiz L., Zeiger E., Møller I. M., Murphy A. Figure 7.11.A: The biosynthetic pathway of chlorophyll (2006).
- ↑
Ishikita H., Saenger W., Biesiadka J., Loll B., Knapp E. W. How photosynthetic reaction centers control oxidation power in chlorophyll pairs P680, P700, and P870 (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — June (vol. 103, no. 26). — P. 9855—9860. — doi:10.1073/pnas.0601446103. — PMID 16788069.
Источник

Строение хлорофилла c1 и c2
Хлорофи́лл (от греч. χλωρός, «зелёный» и φύλλον, «лист») — зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет. При его участии происходит фотосинтез. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и близки гему.
Хлорофилл зарегистрирован в качестве пищевой добавки E140.
История открытия
В 1817 году Жозеф Бьенеме Каванту и Пьер Жозеф Пеллетье выделили из листьев растений зелёный пигмент, который они назвали хлорофиллом. В 1900-х годах Михаил Цвет и Рихард Вильштеттер независимо обнаружили, что хлорофилл состоит из нескольких компонентов. Вильтштеттер очистил и кристаллизовал два компонента хлорофилла, названные им хлорофиллами а и b и установил брутто-формулу хлорофилла а. В 1915 году за исследования хлорофилла ему была вручена Нобелевская премия. В 1940 Ханс Фишер, получивший в 1930 Нобелевскую премию за открытие структуры гема, установил химическую структуру хлорофилла a. Его синтез был впервые осуществлен в 1960 Робертом Вудвордом, а в 1967 была окончательно установлена его стереохимическая структура.
В природе


Цвет листвы фотосинтезирующих растений обусловлен высокой концентрацией хлорофилла
Хлорофилл присутствует во всех фотосинтезирующих организмах — высших растениях, водорослях, сине-зелёных водорослях (цианобактериях), фотоавтотрофных простейших (протистах) и бактериях.
Некоторые высшие растения, наоборот, лишены хлорофилла (как, например, петров крест).
Синтез
Синтезирован Робертом Вудвордом в 1960 году.
Синтез включает в себя 15 реакций, которые можно разделить на 3 этапа. Исходными веществами для синтеза хлорофилла являются глицин и ацетат. На первом этапе образуется аминолевулиновая кислота. На втором этапе происходит синтез одной молекулы протопорфирина из четырёх пиррольных колец. Третий этап представляет собой образование и превращение магнийпорфиринов.
Свойства и функция при фотосинтезе
В процессе фотосинтеза молекула хлорофилла претерпевает изменения, поглощая световую энергию, которая затем используется в фотохимической реакции взаимодействия углекислого газа и воды с образованием органических веществ (как правило, углеводов):
xCO2 + xH2O →hν (CH2O)x + xO2
После передачи поглощенной энергии молекула хлорофилла возвращается в исходное состояние.
Хотя максимум непрерывного спектра солнечного излучения расположен в «зелёной» области 550 нм (где находится и максимум чувствительности глаза), поглощается хлорофиллом преимущественно синий, частично — красный свет из солнечного спектра (чем и обуславливается зелёный цвет отражённого света).
Растения могут использовать и свет с теми длинами волн, которые слабо поглощаются хлорофиллом. Энергию фотонов при этом улавливают другие фотосинтетические пигменты, которые затем передают энергию хлорофиллу. Этим объясняется разнообразие окраски растений (и других фотосинтезирующих организмов) и её зависимость от спектрального состава падающего света.
Химическая структура
Хлорофиллы можно рассматривать как производные протопорфирина — порфирина с двумя карбоксильными заместителями (свободными или этерифицированными). Так, хлорофилл a имеет карбоксиметиловую группу при C10, фитоловый эфир пропионовой кислоты — при С7. Удаление магния, легко достигаемое мягкой кислотной обработкой, дает продукт, известный как феофитин. Гидролиз фитоловой эфирной связи хлорофилла приводит к образованию хлорофиллида (хлорофиллид, лишенный атома металла, известен как феофорбид a).
Все эти соединения интенсивно окрашены и сильно флуоресцируют, исключая те случаи, когда они растворены в органических растворителях в строго безводных условиях. Они имеют характерные спектры поглощения, пригодные для качественного и количественного определения состава пигментов. Для этой же цели часто используются также данные о растворимости этих соединений в соляной кислоте, в частности для определения наличия или отсутствия этерифицированных спиртов. Хлороводородное число определяется как концентрация HCl (%, масс./об.), при которой из равного объёма эфирного раствора пигмента экстрагируется 2/3 общего количества пигмента. «Фазовый тест» — окрашивание зоны раздела фаз — проводят, подслаивая под эфирный раствор хлорофилла равный объём 30%-го раствора KOH в MeOH. В интерфазе должно образовываться окрашенное кольцо. С помощью тонкослойной хроматографии можно быстро определять хлорофиллы в сырых экстрактах.
Хлорофиллы неустойчивы на свету; они могут окисляться до алломерных хлорофиллов на воздухе в метанольном или этанольном растворе.
Хлорофиллы образуют комплексы с белками in vivo и могут быть выделены в таком виде. В составе комплексов их спектры поглощения значительно отличаются от спектров свободных хлорофиллов в органических растворителях.
Хлорофиллы можно получить в виде кристаллов. Добавление H2O или Ca2+ к органическому растворителю способствует кристаллизации.
| Хлорофилл a | Хлорофилл b | Хлорофилл c1 | Хлорофилл c2 | Хлорофилл d | Хлорофилл f | |
|---|---|---|---|---|---|---|
| Формула | C55H72O5N4Mg | C55H70O6N4Mg | C35H30O5N4Mg | C35H28O5N4Mg | C54H70O6N4Mg | C55H70O6N4Mg |
| C2 группа | -CH3 | -CH3 | -CH3 | -CH3 | -CH3 | -CHO |
| C3 группа | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CHO | -CH=CH2 |
| C7 группа | -CH3 | -CHO | -CH3 | -CH3 | -CH3 | -CH3 |
| C8 группа | -CH2CH3 | -CH2CH3 | -CH2CH3 | -CH=CH2 | -CH2CH3 | -CH2CH3 |
| C17 группа | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl |
| C17-C18 связь | Одинарная | Одинарная | Двойная | Двойная | Одинарная | Одинарная |
| Распространение | Везде | Большинство наземных растений | Некоторые водоросли | Некоторые водоросли | Цианобактерии | Цианобактерии |
Общая структура хлорофилла a, b и d
Оптический спектр поглощения хлорофиллов a (голубой) и b (красный)
Хроматограмма зелёного пигмента растений
Применение
Хлорофилл находит применение как пищевая добавка (регистрационный номер в европейском реестре E140), однако при хранении в этанольном растворе, особенно в кислой среде, неустойчив, приобретает грязно-коричнево-зеленый оттенок, и не может использоваться как натуральный краситель. Нерастворимость нативного хлорофилла в воде также ограничивает его применение в качестве натурального пищевого красителя. Но хлорофилл вполне успешно используется в качестве натуральной замены синтетических красителей при изготовлении кондитерских изделий.
Производное хлорофилла — хлофиллин медный комплекс (тринатриевая соль) получил распространение в качестве пищевого красителя (Регистрационный номер в европейском реестре E141). В отличие от нативного хлорофилла, медный комплекс устойчив в кислой среде, сохраняет изумрудно-зеленый цвет при длительном хранении и растворим в воде и водно-спиртовых растворах. Американская (USP) и Европейская (EP) фармакопеи относят хлорофиллид меди к пищевым красителям, однако вводят лимит на концентрацию свободной и связанной меди (тяжелый металл).
Хлорофилл придаёт листьям зелёный цвет и поглощает свет при фотосинтезе
В клетках эукариотов хлорофилл обычно находится в хлоропластах
Карта распределения хлорофилла по поверхности мирового океана в период с 1998 по 2006 по данным спутникового прибора SeaWiFS
Соединения магния
- Магний (Mg)
- Азид магния (Mg(N3)2) Тринитрид магний
- Алюминат магния (Mg(AlO2)2) Метаалюминат магния
- Амид магния (Mg(NH2)2)
- Антимонид магния (Mg3Sb2) Магний сурмянистый
- Арсенат магния (Mg3(AsO4)2) Магний мышьяковокислый
- Арсенид магния (Mg3As2) Магний мышьяковистый
- Аурат магния (Mg[AuO2]2)
- Ацетат магния (Mg(C2H3O2)2) Магний уксуснокислый
- Бензоат магния (Mg(C6H5COO)2) Магний бензойнокислый
- Борид магния (MgB2) Магний бористый
- Бромат магния (Mg(BrO3)2) Магний бромноватокислый
- Бромид магния (MgBr2) Магний бромистый
- Ванадат магния (Mg2V2O7) Магний ванадиевокислый
- Висмутид магния (Mg3Bi2)
- Вольфрамат магния (MgWO4) Магний вольфрамовокислый
- Гексаборид магния (MgB6) Бористый магний
- Гексафторогерманат магния (Mg[GeF6])
- Гексафторосиликат магния (MgSiF6)
- Гексацианоферрат II магния (Mg2[Fe(CN)6])
- Гептагидрат сульфата магния (MgSO4·7H2O) Английская соль
- Германид магния (Mg2Ge)
- Гидрид магния (MgH2) Магний водородистый
- Гидроарсенат магния (MgHAsO4)
- Гидрокарбонат магния (Mg(HCO3)2) Бикарбонат магния, Магний двууглекислый
- Гидрокарбонат магния-калия (MgKH(CO3)2)
- Гидроксид магния (Mg(OH)2) Гидроокись магний
- Гидроортофосфат магния (MgHPO4)
- Гипофосфит магния (Mg(PH2O2)2) Магний фосфорноватистокислый (Фосфинат магния)
- Глицерофосфат магния (MgC3H7O6P)
- Дигидроортофосфат магния (Mg(H2PO4)2)
- Дителлурид магния (MgTe2)
- Дифенилмагний (Mg(C6H5)2)
- Диэтилмагний (Mg(C2H5)2)
- Додекаборид магния (MgB12)
- Йодат магния (Mg(IO3)2) Магний йодноватокислый
- Йодид магния (MgI2) Магний йодистый
- Карбид магния (MgC2) Ацетиленид магния
- Карбонат магния (MgCO3) Магний углекислый
- Карбонат магния лекарственное средство
- Каустический магнезит
- Магнезит
- Метаборат магния (Mg(BO2)2) Магний борнокислый мета
- Метагерманат магния (MgGeO3) Магний германиевокислый
- Метасиликат магния (MgSiO3) Магний кремнекислый магний
- Метатитанат магния (MgTiO3) Магний титановокислый мета
- Молибдат магния (MgMoO4) Магний молибденовокислый
- Нитрат магния (Mg(NO3)2) Магний азотнокислый
- Нитрид магния (Mg3N2) Магний азотистый
- Нитрит магния (Mg(NO2)2) Магний азотистокислый
- Оксид магния (MgO) Магний окись (магнезия жженая)
- Оксалат магния (MgC2O4) Магний щавелевокислый
- Олеат магния (Mg(C18H33O2)2) Магний олеиновокислый
- Ортоарсенат магния (Mg3(AsO4)2)
- Ортоборат магния (Mg3(BO3)2)
- Ортосиликат магния (Mg2SiO4)
- Ортотитанат магния (Mg2TiO4)
- Перманганат магния (Mg(MnO4)2) Магний марганцовокислый
- Пероксид магния (MgO2) Перекись магния
- Перхлорат магния (Mg(ClO4)2) Магний хлорнокислый (Ангидрон)
- Пирофосфат магния (Mg2P2O7)
- Рицинолеат магния (Mg(C18H33O3)2) Магний рицинолевокислый
- Селенат магния (MgSeO4) Магний селеновокислый
- Селенид магния (MgSe) Магний селенистый
- Селенит магния (MgSeO3) Магний селенистокислый
- Силицид магния (Mg2Si) Магний кремнистый
- Станнид димагния (Mg2Sn)
- Стеарат магния (MgC36H70O4) Магний стеариновокислый
- Стекломагниевый лист
- Сульфат магния (MgSO4) Магний сернокислый
- Сульфид магния (MgS) Магний сернистый
- Сульфит магния (MgSO3) Магний сернистокислый
- Тартрат магния (MgC4H4O6) Магний виннокислый
- Теллурид магния (MgTe) Магний теллуристый
- Тиосульфат магния (MgS2O3) Гипосульфит магния
- Тиоцианат магния (Mg(SCN)2) Магний роданистый
- Трикарбид димагния (Mg2C3)
- Формиат магния (Mg(HCOO)2) Магний муравьинокислый
- Фосфат магния (Mg3(PO4)2) Магний Фосфорнокислый (Фосфат магния)
- Фосфид магния (Mg3P2) Магний фосфористый
- Фторид магния (MgF2) Магний фтористый
- Хлорат магния (Mg(ClO3)2) Магний хлорноватокислый
- Хлорид магния (MgCl2) Магний хлористый
- Хлорофилл
- Хлорофилл с1
- Хлорофилл с2
- Хлорофилл с3
- Хромат магния (MgCrO4) Магний хромовокислый
- Хромит магния (MgCr2O4) Магний хромистокислый
- Цирконат магния (MgZrO3) Магний циркониевокислый
- Цитрат магния (MgC6H6O7) Магний лимоннокислый
Источник
