Какой оксид имеет амфотерные свойства

Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]

4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Источник
Тема № 10.
Химические свойства оксидов: основных, амфотерных, кислотных
Рекомендуемые видеоуроки
Теоретические сведения
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом
Номенклатура оксидов
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
Классификация оксидов
По химическим свойствам оксиды делятся на две группы:
1. Несолеобразующие (безразличные) – не образуют солей, например: NO, CO, H2O;
2. Солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Основные оксиды
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
Основным оксидам соответствуют основания.
Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Химические свойства основных оксидов
1. Основные оксиды взаимодействуют с водой с образованием оснований.
Условие протекания реакции: должны образовываться растворимые основания!
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2→ CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 → Сa(AlO2)2
Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты.
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3.
Химические свойства кислотных оксидов
1. Взаимодействие с водой с образованием кислоты:
Условия протекания реакции: должна образовываться растворимая кислота.
P2O5 + 3H2O → 2H3PO4
2. Взаимодействие со щелочами с образованием соли и воды:
Условия протекания реакции: с кислотным оксидом взаимодействует именно щелочь, то есть растворимое основание.
SO3 + 2NaOH → Na2SO4 + H2O
3. Взаимодействие с основными оксидами с образованием солей:
SO3 + Na2O → Na2SO4
Амфотерные оксиды
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.
Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2.
Химические свойства амфотерных оксидов
1. C водой не взаимодействуют
2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства):
ZnO + SiO2 → ZnSiO3
3. Взаимодействие с кислотами с образованием соли и воды (основные свойства):
ZnO + H2SO4 → ZnSO4 + H2O
4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства):
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2NaOH → 2NaAlO2 + H2O
5. Взаимодействие с основными оксидами (кислотные свойства):
Al2O3 + CaO → Ca(AlO2)2
Интернет-источники
Источник
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
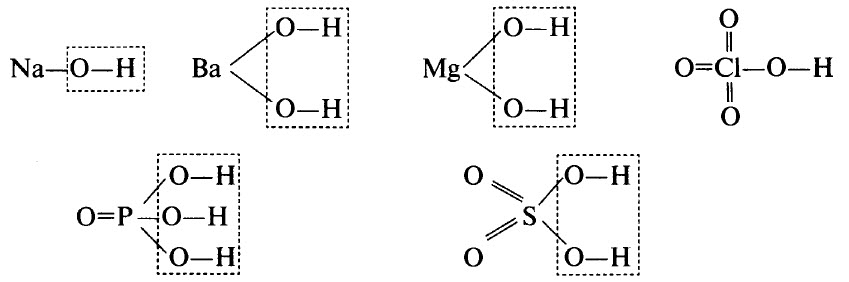
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
Источник
Определение
Оксиды – бинарные соединения, в состав которых входит кислород в степени окисления -2.
Номенклатура оксидов
Названия оксидов строятся по следующим правилам систематической номенклатуры:
Сначала указывают слово оксид, после него, в родительном падеже, – название второго элемента.
Если элемент, образующий оксид, имеет единственную валентность, то её в названии оксида можно не указывать. Если же элемент имеет переменную валентность и образует несколько оксидов, то валентность элемента обязательно указывается римскими цифрами в скобках в конце записи названия оксида.
При записи химической формулы оксида кислород записывается на последнем месте.
Примеры:
$Na_2O$ – оксид натрия
$CaO$ – оксид кальция
$Al_2O_3$ – оксид алюминия
$overset{+7}{Mn_2}O_7$ – оксид марганца (VII)
$overset{+2}{Cr}O$ – оксид хрома (II)
$overset{+3}{Cr_2}O_3$ – оксид хрома (III)
В настоящее время при формировании названий оксидов пользуются правилами систематической номенклатуры. Однако до её появления, пока число известных соединений было не столь велико, широко использовалась тривиальная номенклатура, в которой названия веществ основаны не на особенностях их строения, а на внешнем виде или каких-то специфических свойствах именуемых объектов. Многие тривиальные названия распространены и в наше время.
На смену тривиальной номенклатуре пришла полусистематическая номенклатура. В полусистематических названиях веществ с помощью использования морфем пытались отразить особенности химического строения соединений. Применительно к оксидам вводились следующие названия: закись – для оксидов элементов в низких степенях окисления, окись – для более высоких степеней окисления. Кислотные оксиды часто рассматривали как продукты дегидратации соответствующих кислот и отражали это в виде названия ангидрид: $P_2O_5$ – фосфорный ангидрид, $SO_3$ – серный ангидрид и т.д.
Таблица 1
Формулы и названия некоторых оксидов в соответствии с тривиальной, полусистематической и систематической номенклатурой
| Формула | Тривиальное название | Устаревшее название | Систематическое название |
| $N_2O$ | веселящий газ | закись азота | оксид азота (I) |
| $NO$ | окись азота | оксид азота (II) | |
| $N_2O_3$ | трёхокись азота, азотистый ангидрид | оксид азота (III) | |
| $NO_2$ | бурый газ | двуокись азота | оксид азота (IV) |
| $N_2O_5$ | пятиокись азота, азотный ангидрид | оксид азота (V) | |
| $SO_2$ | сернистый газ | двуокись серы, сернистый ангидрид | оксид серы (IV) |
| $SO_3$ | трёхокись серы, серный ангидрид | оксид серы (VI) | |
| $CO$ | угарный газ | окись углерода | оксид углерода (II) |
| $CO_2$ | углекислый газ | двуокись углерода | оксид углерода (IV) |
| $Na_2O$ | натр | окись натрия | оксид натрия |
| $MgO$ | жжёная магнезия | окись магния | оксид магния |
| $CaO$ | жжёная известь, негашёная известь | окись кальция | оксид кальция |
| $Al_2O_3$ | глинозём | окись алюминия | оксид алюминия |
| $SiO_2$ | кремнезём | двуокись кремния | оксид кремния (IV) |
| $Fe_3O_4$ | железная окалина | закись-окись железа | оксид железа (II, III) |
| $H_2O$ | вода | окись водорода | оксид водорода |
КЛАССИФИКАЦИЯ ОКСИДОВ
Оксиды делятся на две большие группы: солеобразующие и несолеобразующие. Последние, как вытекает из названия, не образуют солей.
Несолеобразующими называют оксиды, которые не вступают во взаимодействие ни с щелочами, ни с кислотами и не образуют солей. Эти оксиды образованы неметаллами.
Несолеобразующих оксидов немного, их необходимо запомнить: $N_2O$, $NO$, $CO$, $SiO$.
Солеобразующими называют оксиды, способные взаимодействовать с кислотами или с основаниями с образованием солей.
Солеобразующие оксиды делятся на основные, кислотные и амфотерные оксиды.
Основные оксиды – оксиды, которым соответствуют основные гидроксиды (основания).
Основные оксиды образованы типичными металлами (щелочными, щелочноземельными, магнием), а также переходными металлами в низких степенях окисления (кроме $ZnO$).
Примеры основных оксидов: $Li_2O$, $Na_2O$, $K_2O$, $MgO$, $CaO$, $BaO$, $overset{+2}{Fe}O$, $overset{+2}{Cr}O$, $overset{+1}{Cu_2}O$, $overset{+2}{Cu}O$, $overset{+2}{Mn}O$ и др.
Кислотные оксиды – оксиды, которым соответствуют кислотные гидроксиды (кислоты).
Кислотные оксиды образованы неметаллами (за исключением несолеобразующих оксидов $CO$, $SiO$, $NO$, $N_2O$), а также переходными металлами в высоких степенях окисления.
Примеры кислотных оксидов: $Cl_2O_7$, $SO_3$, $SO_2$, $N_2O_5$, $NO_2$, $N_2O_3$, $P_2O_5$, $P_2O_3$, $CO_2$, $SiO_2$, $B_2O_3$, $overset{+6}{Cr}O_3$, $overset{+7}{Mn_2}O_7$ и др.
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Им соответствуют амфотерные гидроксиды.
К амфотерным оксидам относятся оксид бериллия $BeO$, оксид алюминия $Al_2O_3$, оксид цинка $ZnO$, а также оксиды переходных металлов в промежуточных степенях окисления.
Примеры амфотерных оксидов: $Al_2O_3$, $overset{+3}{Fe_2}O_3$, $overset{+3}{Cr_2}O_3$, $overset{+4}{Mn}O_2$, $overset{+2}{Sn}O$, $overset{+4}{Sn}O_2$, $overset{+5}{V_2}O_5$, $ZnO$, $BeO$ и др.

Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Это оксиды металлов (кроме некоторых переходных металлов в высших степенях окисления), твердые вещества.
Основным оксидам соответствуют основания, в которых металл имеет такую же степень окисления, как в оксиде, при этом степень окисления равна числу гидроксильных групп.
Например, оксиду натрия $overset{+1}{Na}_2O$ соответствует гидроксид натрия $overset{+1}{Na}OH$;
оксиду кальция $overset{+2}{Ca}O$ соответствует гидроксид кальция $overset{+2}{Ca}(OH)_2$;
оксиду железа (II) $overset{+2}{Fe}O$ соответствует гидроксид железа (II) $overset{+2}{Fe}(OH)_2$.
Кислотные оксиды взаимодействуют с щелочами с образованием соли и воды, им соответствуют кислоты. Это оксиды неметаллов ($mathrm{CO_2, SO_2, SO_3, N_2O_5}$) или переходных металлов в высших степенях окисления ($mathrm{CrO_3, Mn_2O_7}$).
Оксиду соответствует кислота в случае, если степень окисления элемента в обоих соединениях одинакова, при этом степень окисления кислотного остатка равна количеству атомов водорода.
Например, оксиду углерода (IV) $overset{+4}{C}O_2$ соответствует угольная кислота $H_2overset{+4}{C}O_3$;
оксиду серы (IV) $overset{+4}{S}O_2$ соответствует сернистая кислота $H_2overset{+4}{S}O_3$;
оксиду серы (VI) $overset{+6}{S}O_3$ соответствует серная кислота $H_2overset{+6}{S}O_4$;
оксиду азота (V) $overset{+3}{N}_2O_3$ соответствует азотистая кислота $Hoverset{+3}{N}O_2$;
оксиду азота (V) $overset{+5}{N}_2O_5$ соответствует азотная кислота $Hoverset{+5}{N}O_3$;
оксиду азота (IV) $overset{+4}{N}O_2$ соответствует сразу две кислоты: азотная — $Hoverset{+5}{N}O_3$ и азотистая — $Hoverset{+3}{N}O_2$;
оксиду хлора (IV) $Cloverset{+4}O_2$ соответствует хлорноватая $Hoverset{+3}{Cl}O_2$ и хлористая $Hoverset{+5}{Cl}O_3$ кислоты.
Обратите внимание: если элемент в оксиде проявляет степень окисления, отличную от той, которую он проявляет в кислоте, такой оксид является несолеобразующим!
Например: углерод в угарном газе $overset{+2}{C}O$ проявляет степень окисления +2, в то время как в единственной кислоте, содержащей углерод, $H_2overset{+4}{C}O_3$ его степень окисления равна +4. Поэтому оксид углерода (II) относится к несолеобразующим оксидам.
Амфотерные оксиды проявляют в зависимости от условий свойства основных или кислотных оксидов.
Им соответствуют амфотерные основания.
Например, оксиду железа (III) $overset{+3}{Fe}_2O_3$ соответствует гидроксид железа (III) $overset{+3}{Fe}(OH)_3$
оксиду алюминия $overset{+3}{Al}_2O_3$ соответствует гидроксид алюминия $overset{+3}{Al}(OH)_3$
оксиду хрома (III) $overset{+3}{Cr}_2O_3$ соответствует гидроксид хрома (III) $overset{+3}{Cr}(OH)_3$
В таблице представлены основные свойства кислотных, основных и амфотерных оксидов.
| основные | амфотерные | кислотные |
|---|---|---|
Взаимодействуют с кислотами с образованием соли и воды. Это оксиды металлов (кроме некоторых переходных металлов в высших степенях окисления), твердые вещества CaO, FeO, Cu$_2$O | оксиды, проявляющие в зависимости от условий свойства основных или кислотных оксидов. Им соответствуют амфотерные основания Это твердые вещества. Al$_2$O$_3$, ZnO, Fe$_2$O$_3$, $Cr_2O_3$, BeO | взаимодействуют с щелочами с образованием соли и воды, им соответствуют кислоты. Это оксиды неметаллов (CO$_2$, SO$_2$, SO$_3$, N$_2$O$_5$) или переходных металлов в высших степенях окисления (CrO$_3$, Mn$_2$O$_7$) Газы, жидкости, твердые тела Прим. Некоторые (NO$_2$, ClO$_2$) образуют сразу две кислоты |
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Основные и амфотерные оксиды при комнатной температуре – твердые вещества ($CaO$, $Fe_2O_3$ и др.); кислотные оксиды – твёрдые вещества ($P_2O_5$, $SiO_2$), жидкости ($SO_3$, $Сl_2О_7$ и др.) или газы ($NO_2$, $SO_2$ и др.). Все несолеообразующие оксиды являются газами, кроме $SiO$, который является твердым веществом. Однако, нужно помнить, что кремниевую кислоту $H_2SiO_3$ нельзя получить непосредственно из оксида кремния, добавляя воду! Эту кислоту можно получить косвенным путем из солей кремния – силикатов.
Оксиды металлов могут быть окрашены в разные цвета: оксиды щелочных и щелочно-земельных металлов обычно белого цвета, оксиды переходных металлов $Cr_2O_3$ – зеленый; $HgO$ – красно-оранжевый; $CuO$ – черный, а $Cu_2O$ – красный.
Оксид кремния $SiO_2$ – самое распространенное твердое вещество на Земле. Он входит в состав почвы (песок), горных пород и минералов. Драгоценные камни, такие как изумруд, сапфир, горный хрусталь имеют в своей структуре молекулы оксида кремния, при этом атомы кремния и кислорода образуют атомную кристаллическую решетку, и, поэтому представляют собой тугоплавкие, твердые, но хрупкие кристаллы правильной формы:



Бурый газ (оксид азота(IV)) Оксид железа (III) Оксид кремния
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
| Исходное вещество | Реагент | Продукты реакции | Уравнение реакции |
|---|---|---|---|
| $K_2O$ | вода | растворимое основание (щелочь)* | $K_2O + H_2O = 2KOH$ |
| MgO | кислота | соль и вода | $MgO + 2HCl = MgCl_2 + H_2O$ |
| CaO | кислотный оксид | соль | $ CaO + CO_2 = CaCO_3$ |
| $Na_2O$ | амфотерный оксид | соль | $Na_2O + ZnO = Na_2ZnO_2$ |
* Взаимодействие основного оксида с водой протекает только в случае, если образуется растворимое основание, т.е. щелочь. В случае возможного образования нерастворимого основания реакция не идет, например:
$MgO + H_2O not = Mg(OH)_2 downarrow$
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
| Исходное вещество | Реагент | Продукты реакции | Уравнение реакции |
|---|---|---|---|
$SO_3$ $N_2O_5$ | вода | соответствующая растворимая* кислота | $SO_3 + H_2O = H_2SO_4$ $N_2O_5 + H_2O = 2HNO_3$ $SiO_2 + H_2O not = H_2SiO_3 downarrow$ |
| $SO_2$ | щелочь | соль и вода | $SO_2 + 2NaOH = Na_2SO_3 + H_2O$ |
| $P_2O_5$ | основный оксид | соль | $P_2O_5 + 3Na_2O = 2Na_3PO_4 $ |
| $SO_3$ | амфотерный оксид | соль | $ZnO + SO_3= ZnSO_4 $ |
*Реакция не протекает в случае,если образуется нерастворимая кислота, например: $SiO_2 + H_2O not = H_2SiO_3 downarrow$
Кислотные оксиды образуют соли, соответствующие определенной кислоте. Если у элемента может быть две или более кислот, то следует ориентироваться на степень окисления этого элемента в оксиде и кислоте: она должна быть одинаковой. Для лучшего понимания превращений кислотных оксидов в соли советуем воспользоваться следующим алгоритмом (на примере взаимодействия оксида азота(V) с гидроксидом кальция): $N_2O_5 + Ca(OH)_2 rightarrow$
1) Определим степень окисления азота в оксиде: $overset{X}{N}_2 overset{-2}{O_5} $ X=10/2=+5
2) Вспомним, какие кислоты образует азот и определим в каждой его степень окисления:
$hspace{2cm} overset{+1}{H}overset{x}{N}overset{-2}{O_2}hspace{3cm} overset{+1}{H}overset{x}{N}overset{-2}{O_3}hspace{2cm} $
$1cdot (+1) +1 cdot x + 2cdot(−2) = 0 hspace{0.5cm} 1cdot (+1) +1 cdot x + 3cdot(−2) = 0 $
$hspace{2cm} x = +3 hspace{3.2cm} x = +5$
Значит оксиду азота (V) соответствует азотная кислота, и $N_2O_5$ при взаимодействии с щелочами образует ее соли – нитраты ($NO_3^ – $):
$N_2O_5 + Ca(OH)_2 = Ca(NO_3)_2 + H_2O$
Воспользовавшись этим алгоритмом, можно составить следующие логические ряды:
$N_2O_5 rightarrow HNO_3$ ст.ок=+5 образует соли нитраты $NO_3^ – $
$ N_2O_3 rightarrow HNO_2$ ст.ок=+3 образует соли нитриты $NO_2^ –$
$P_2O_5 rightarrow H_3PO_4$ ст.ок=+5 образует соли нитраты $PO_4^{3 -}$
Для наглядного запоминания этого принципа можно воспользоваться таблицей, приведенной ниже.
Таблица. Формулы и названия кислот, кислотных остатков и соответствующих кислотных оксидов
| Формула кислоты | Название кислоты | Формула кислотного остатка | Название кислотного остатка | Соответствующий кислотный оксид |
|---|---|---|---|---|
| HF | Фтороводород, плавиковая | $ F^-$ | Фторид | |
| HCl | Хлороводород, соляная | $ Cl^-$ | Хлорид | |
| HBr | Бромоводород | $Br-$ | Бромид | |
| HI | Йодоводород | $I^-$ | Йодид | |
| $H_2S$ | Сероводород | $S^{2-}$ | Сульфид | |
| HCN | Циановодородная | $CN^-$ | Цианид | |
| $HNO_2$ | Азотистая | $NO^{2-}$ | Нитрит | $N_2O_3$ |
| $HNO_3$ | Азотная | $NO^{3-}$ | Нитрат | $N_2O_5$ |
| $H_3PO_4$ | Ортофосфорная | $mathrm{PO_4^{3-}}$ | Фосфат | $P_2O_5$ |
| $ H_3AsO_4$ | Мышьяковая | $mathrm{AsO_4^{3-}}$ | Арсенат | $As_2O_5$ |
| $ H_2SO_3$ | Сернистая | $mathrm{SO_3^{2-}}$ | Сульфит | $SO_2$ |
| $ H_2SO_4$ | Серная | $mathrm{SO_4^{2-}}$ | Сульфат | $SO_3$ |
| $H_2CO_3$ | Угольная | $mathrm{CO_3^{2-}}$ | Карбонат | $CO_2$ |
| $ H_2SiO_3$ | Кремниевая | $mathrm{SiO_3^{2-}}$ | Силикат | $SiO_2$ |
| $ H_2CrO_4$ | Хромовая | $mathrm{CrO_4^{2-}}$ | Хромат | $CrO_3$ |
| $ H_2Cr_2O_7$ | Дихромовая | $mathrm{Cr_2O_7^{2-}}$ | Дихромат | $CrO_3$ |
| $HMnO_4$ | Марганцовая | $mathrm{MnO_4^{-}}$ | Перманганат | $Mn_2O_7$ |
| $HClO$ | Хлорноватистая | $mathrm{ClO^-}$ | Гипохлорит | $Cl_2O$ |
| $ HClO_2$ | Хлористая | $mathrm{ClO_2^{-}}$ | Хлорит | $Cl_2O_3$ |
| $ HClO_3$ | Хлорноватая | $mathrm{ClO_3^{-}}$ | Хлорат | $Cl_2O_5$ |
| $ HClO_4$ | Хлорная | $mathrm{ClO_4^{-}}$ | Перхлорат | $Cl_2O_7$ |
| $HCOOH$ | Метановая, муравьиная | $mathrm{HCOO^-}$ | Формиат | |
| $CH_3COOH$ | Этановая, уксусная | $mathrm{CH_3COO^-}$ | Ацетат | |
| $ H_2C_2O_4$ | Этандиовая, щавелевая | $mathrm{C_2O_4^-}$ | Оксалат |
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
| Исходное вещество | Реагент | Продукты реакции | Уравнение реакции | |
|---|---|---|---|---|
| $ZnO, Al_2O_3$ | вода | $not = $ | не взаимодействуют | |
| $ZnO$ | кислотный оксид | соль | $ ZnO + SO_3= ZnSO_4 $ | |
| основный оксид | соль | $ZnO + Na_2O = Na_2ZnO_2$ | ||
| $Al_2O_3$ | кислота | соль | $ Al_2O_3 + 6HNO_3 = 2Al(NO_3)_3 + 3H_2O $ | |
| $Al_2O_3$ | щелочь | щелочь в расплаве — соль+вода | $Al_2O_3 + 2NaOH (т)xrightarrow[t, ^circ C]{}$ $ 2NaAlO_2 + H_2O $ | |
| $Al_2O_3$ | щелочь в растворе — комплексная соль | $Al_2O_3 + 6NaOH (p-p) + 3H_2O = $ $=2Na_3[Al(OH)_6]$ |
СПОСОБЫ ПОЛУЧЕНИЯ ОКСИДОВ
1) взаимодействие простых веществ с кислородом
$mathrm{2Ca + O_2 = 2CaO}$
$mathrm{S + O_2 = SO_2}$
2) взаимодействие сложных веществ с кислородом
$mathrm{2ZnS + 3O_2 = 2ZnO + SO_2}$
3) разложение некоторых солей при нагревании
$mathrm{CaCO_3 = CaO + CO_2}$
$mathrm{2CuSO_4 = 2CuO + 2SO_2 + O_2}$
Примечание: соли натрия и калия обычно не разлагаются с образованием оксидов. Подробнее смотрите тему “Разложение солей”
4) дегидратация кислот и нерастворимых оснований
$mathrm{ H_2SO_4 = SO_3 + H_2O}$
(точнее: $mathrm{3H_2SO_4 + P_2O_5 = 3SO_3uparrow + 2H_3PO_4}$)
$mathrm{H_2SiO_3 = SiO_2 + H_2O}$
$mathrm{Cu(OH)_2 = CuO + H_2O}$
5) окисление одних оксидов и восстановление других
$mathrm{MnO_2 + 2H_2 = MnO + 2H_2O}$
$mathrm{2NO + O_2 = 2NO_2}$
$mathrm{Cr_2O_3 + 2Al = Al_2O_3 + 2Cr}$ (алюмотермия)
$mathrm{CuO + C = Cu + CO}$
При этом более активный металл вытесняет менее активный из его оксида. Для сравнения активности металлов следует использовать электрохимический ряд напряжения металлов.
6) вытеснение летучих оксидов из солей менее летучими
$mathrm{Na_2CO_3 + SiO_2 = Na_2SiO_3 + CO_2uparrow}$
Источник
