Какой продукт реакции нитрования бензола
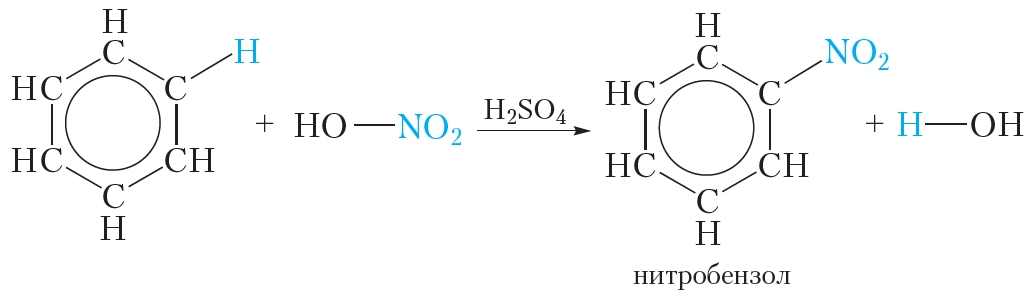
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 мая 2020; проверки требуют 7 правок.
| Нитробензол | |
|---|---|
| Систематическое наименование | Нитробензол |
| Традиционные названия | Нитробензол; мирабановое масло, мирабановая эссенция |
| Хим. формула | C6H5NO2 |
| Состояние | жидкость |
| Молярная масса | 123,06 г/моль |
| Плотность | 1,199 г/см³ |
| Энергия ионизации | 9,92 ± 0,01 эВ[1] |
| Температура | |
| • плавления | 5,85 °C |
| • кипения | 210,9 °C |
| • вспышки | 88 °C |
| • самовоспламенения | 482 °C |
| Пределы взрываемости | 1,8 ± 0,1 об.%[1] |
| Уд. теплоёмк. | 1510 Дж/(кг·К) |
| Давление пара | 0,3 ± 0,1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | 0,19 г/100 мл (20 °C) |
| Показатель преломления | 1,5562 |
| Дипольный момент | 4,22 Д |
| Рег. номер CAS | 98-95-3 |
| PubChem | 7416 |
| Рег. номер EINECS | 202-716-0 |
| SMILES | C1=CC=C(C=C1)[N+](=O)[O-] |
| InChI | InChI=1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H LQNUZADURLCDLV-UHFFFAOYSA-N |
| RTECS | QJ0525000 |
| ChEBI | 27798 |
| ChemSpider | 7138 |
| Предельная концентрация | 1 мг/м3 |
| ЛД50 | 120-140 мг/кг |
| Токсичность | Класс опасности 2 |
| Фразы риска (R) | R23/24/25, R40, R48/23/24, R51/53, R62 |
| Фразы безопасности (S) | (S1/2), S28, S36/37, S45, S61 |
| NFPA 704 | 2 3 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Нитробензóл (нитробензéн, в просторечии – мирабáновое мáсло, мирабáновая эссéнция) — токсичное органическое вещество, имеющее миндальный запах. Формула C6H5NO2.
Физические и химические свойства[править | править код]
Внешний вид нитробензола — ярко-желтые кристаллы или маслянистая жидкость (бесцветная или зеленовато-жёлтая) с запахом горького миндаля, нерастворимая в воде (0,19 % по массе при 297 K, 0,8 % при 350 K). Проявляет слабые основные свойства. Растворяется в концентрированных кислотах (при разведении таких растворов водой осаждается)[2]. Неограниченно смешивается с диэтиловым эфиром, бензолом, некоторыми другими органическими растворителями. Перегоняется с водяным паром. Показатель преломления (для D-линии натрия (589 нм), при 297K) 1,5562. Дипольный момент газообразных молекул (в дебаях) 4,22 D. Удельная теплоёмкость 1,51 Дж/(г·К)[3].
Электрофильное замещение[править | править код]
В связи с сильным электроноакцепторным действием нитрогруппы реакции электрофильного замещения идут в мета-положение и скорость реакции ниже чем у бензола.
- Нитрование. Образуется смесь изомеров: 93% м-динитробензола, 6,5 % о-динитробензола и 0,5 % п-динитробензола.
- Сульфирование
- Галогенирование
В присутствии катализаторов.
Например, порошка железа[4]:
Не вступает в реакцию Фриделя-Крафтса[5]
Нуклеофильное замещение[править | править код]
- При обработке магнийорганическими соединениями в эфире углеводородный радикал как нуклеофил вступает в орто- и в пара-положения к нитрогруппе (которая при этом восстанавливается до нитрозогруппы)[2]
Восстановление[править | править код]
Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов.
Эта реакция была открыта в 1842 году Н. Н. Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %.
Иногда в промышленном гидрировании нитробензола до анилина в качестве катализатора используют никель в комбинации с оксидами ванадия и алюминия. Такой катализатор эффективен в интервале 250—300° и легко регенерируется при окислении воздухом. Выход анилина и других аминов составляет 97—98 %. Восстановление нитросоединений до аминов может сопровождаться гидрированием бензольного кольца. По этой причине для получения ароматических аминов избегают использовать в качестве катализаторов платину, палладий или никель Ренея.
В промышленности анилин получают каталитическим восстановлением нитробензола на медном или никелевом катализаторе, который вытеснил старинный способ восстановления нитробензола чугунными стружками в водном растворе хлорного железа и соляной кислоты. Промежуточные продукты — нитрозобензол и N-фенилгидроксиламин.
Другой вариант получения нитрозобензола[4]:
Восстановление нитрогруппы до аминогруппы сульфидом и гидросульфидом натрия в настоящее время имеет значение только для частичного восстановления одной из двух нитрогрупп, например, в м-динитробензоле или 2,4-динитроанилине.
При ступенчатом восстановлении полинитросоединений с помощью сульфида натрия этот неорганический реагент превращается в тетрасульфид натрия, что сопровождается образованием щелочи.
Высокая щелочность среды приводит к образованию азокси- и азо- и гидразосоединений в качестве побочных продуктов. Для того чтобы избежать этого в качестве восстановителя следует использовать гидросульфид натрия, где щелочь не образуется.
Азоксибензол может быть получен восстановлением нитробензола: спиртовым раствором едкого кали, амальгамой натрия, водородом в присутствии окиси свинца, метиловым спиртом и едким натром, метилатом натрия и метиловым спиртом, закисью свинца в щелочной суспензии, декстрозой в щелочной суспензии, β-фенилгидроксиламином[4].
Азобензол можно получить, например, восстановлением нитробензола при кипячении с цинковой пылью в водно-спиртовом растворе щёлочи[4].
Многие более восстановленные производные могут быть получены электрохимически, при правильном подборе электродов.
Известны методы восстановления нитросоединений до амидов (амальгамами натрия или цинка, сульфидами натрия и аммония)[6].
Получение[править | править код]
Основной способ получения нитробензола (как и других нитроаренов) — нитрование в условиях электрофильного замещения бензола (соответственно, аренов)[2]. Электрофильной частицей является ион нитрония NO2+[6][7].
Например, в промышленности нитробензол получают непрерывным нитрованием бензола смесью концентрированных H2SO4 и HNO3 с выходом 96—99 %.
В лабораторных условиях нитробензол получают нитрованием бензола смесью H2SO4 (1,84 г/см3) и HNO3 (1,4 г/см3) в соотношении 1:1 при 40—60 °C (45 мин). Выход целевого продукта достигает 80 %.
Принципиально возможна (но не применяется в силу низкого выхода) реакция нитрования бензола концентрированной азотной кислотой[6].
Несколько реже (как и для получения других нитроаренов) в лабораториях используют замещение, модификацию или элиминирование заместителей, уже имеющихся при бензольном кольце[2].
Например, возможно получать нитробензол окислением анилина перокситрифторуксусной кислотой (или другими окислителями; чем менее кислая среда — тем больше доля азоксибензола в продуктах)[7].
Применение[править | править код]
Исходное сырьё в производстве анилина, ароматических азотсодержащих соединений (бензидин, хинолин, азобензол), растворитель эфиров целлюлозы[5], компонент полировальных составов для металлов. Применяется как растворитель и мягкий окислитель. В основном используется как прекурсор для производства анилина.
Производные нитробензола используются в качестве взрывчатых веществ и как компоненты ракетных топлив. В парфюмерии — в качестве душистых или фиксирующих запах веществ, в том числе — искусственных мускусов. Сам нитробензол ранее выпускали под названием «горько-миндального» или «мирабанового» масла. Некоторые производные нитробензола используются в составе лаков и красок. Некоторые применяются в медицине[2][6].
Биологическая роль и токсичность[править | править код]
Нитробензол особо токсичен; относится ко второму классу опасности и в больших концентрациях может вызывать гемолиз.
Впитывается через кожу, оказывает сильное действие на ЦНС, нарушает обмен веществ, вызывает заболевания печени, окисляет гемоглобин в метгемоглобин.
ПДК в рабочей зоне – 1 мг/м³, ЛД50 – 120 мг/кг на крысах.
См. также[править | править код]
- 4-Нитрохлорбензол
- 2-Нитрохлорбензол
- Метгемоглобинообразователи
- 3-Нитрохлорбензол
- Высокотоксичные вещества
- Нитросоединения
Примечания[править | править код]
- ↑ 1 2 3 https://www.cdc.gov/niosh/npg/npgd0450.html
- ↑ 1 2 3 4 5 Шабаров Ю. С. «Органическая химия», М.:Химия, 2002, стр. 848. ISBN 5-7245-1218-1, стр. 715—725
- ↑ Волков А. И. Жарский И. М. «Большой химический справочник». Мн.:Современная школа, 2005, 608 с. ISBN 985-6751-04-7 стр. 257, 267
- ↑ 1 2 3 4 Гельман Х. (ред.) Казанский Б. А. (ред.) «Синтезы органических препаратов», М.: Гос. Изд-во иностранной литературы, 1949. Сб. 1, стр. 130—134. Сб. 2, стр. 12-15. Сб. 3, стр. 7-8, 354—356
- ↑ 1 2 Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3, стр. 267—268
- ↑ 1 2 3 4 Горленко В. А. и др. «Органическая химия», М.:Мастерство, 2003, стр. 624. ISBN 5-294-00176-4, стр. 397—403
- ↑ 1 2 Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3, стр. 403—410
Литература[править | править код]
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
Ссылки[править | править код]
- International Chemical Safety Card 0065 (англ.)
- NIOSH Pocket Guide to Chemical Hazards (англ.)
- IARC Monograph: «Nitrobenzene» (англ.)
- US EPA factsheet (англ.)
- Механизм восстановления нитробензола цинком в щелочной среде и железом в соляной кислоте (реакция Бешама) (англ.)
Источник
Определение
Нитросоединения — органические соединения, содержащие одну или несколько нитрогрупп —$NO_2$. Под нитросоединениями обычно подразумевают углеводороды, в которых нитрогруппа непосредственно связана с атомом углерода (нитроалканы, нитроалкены и нитроарены и т.д.).
Наиболее важный метод получения нитросоединений – нитрование.
Определение
Нитрование – непосредственное замещение атома водорода в органическом соединении $NO_2$ -группой.
Различают С-, О- и N-нитрование, направленные на синтез С-нитропроизводных, органических нитратов (нитроэфиров) $R-ONO_2$ и N-нитраминов $RNHNO_2$. Обычно субстратом служат карбоциклические и гетероциклические ароматические соединения. Алифатические соединения нитруются значительно реже. Нитрующими агентами являются азотная кислота и её смеси с разными реагентами, чаще всего, с сильными неорганическими кислотами. Основным побочным процессом при нитровании является окисление. Нитрование менее селективно, чем сульфирование, вследствие меньшего размера и большей активности атакующей частицы. Тем не менее, правильный выбор нитрующего агента позволяет существенно повысить выход целевого продукта
Другие способы получения нитросоединений (например, нуклеофильной заменой галогена) имеют значительно меньшее значение.
МЕХАНИЗМ РЕАКЦИИ НИТРОВАНИЯ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Для нитрования ароматических соединений используют различные нитрующие агенты, в состав которых входит азотная кислота разной концентрации. В зависимости от условий азотная кислота может образовывать следующие электрофильные частицы:
нитроний-катион $[NO_2]^+$, в виде сольватированного иона в протонных растворителях (наиболее активный);
соли нитрония $[NO_2]^+ClO_4^-$, в виде сольватированной ионной пары в диполярных апротонных растворителях (диметилсульфоксид и т.п.);
ацетилнитрат ($CH_3COONO_2$) и его протонированную форму, при смешении азотной кислоты с уксусным ангидридом (наименее активные):
$CH_3COONO_2 + H^+ leftrightarrow CH_3COOH + NO_2^+$
Концентрированная азотная кислота и её смеси с другими кислотами образуют нитроний-катион $NO_2^+$ по следующей схеме:
$HNO_3 xrightarrow{H^+} (OH)_2NO^+ rightarrow NO_2^+ +H_2O$
Молекула $HNO_3$, являясь основанием Льюиса, присоединяет протон с образованием $H_2NO_3^+$, а затем отщепляет молекулу воды.
На скорость нитрование и выход продукта влияют многие факторы процесса: концентрация кислоты, температура, интенсивность перемешивания, порядок слива реагентов, наличие катализатора. Так, например, присутствие кислоты Льюиса ($AlCl_3, BF_3$), облегчают генерацию катиона $NO_2^+$ и ускоряют нитрование аренов азотной кислотой и нитратами металлов в серной кислоте.
1. НИТРОВАНИЕ СМЕСЬЮ АЗОТНОЙ И СЕРНОЙ КИСЛОТ (Нитрующая смесь)
Использование нитрующей смеси азотной и серной кислот – самый распространенный и детально разработанный метод нитрования ароматических соединений. В производстве лекарственных веществ и витаминов применяется чаще всего. Нитрующая смесь готовится смешением концентрированной серной кислоты плотностью 1,84г/мл (92-93%-ая кислота, моногидрат и даже олеум с содержанием $SO_3$ до 20%) с концентрированной азотной кислотой плотностью 1,4-1,5 г/мл (содержит около 99,67% $HNO_3$).
Запомнить! Концентрация серной кислоты должна быть тем выше, чем меньше реакционная способность субстрата и чем больше число нитрогрупп вводится в его молекулу.
Температура смеси не должна быть выше $35-40^circ C$. Превышение этой температуры приводит к частичному разложению азотной кислоты с образованием оксидов азота^
$4HNO_3= 4NO_2uparrow + 2H_2O + O_2 uparrow$
Например, бензойную кислоту нитруют нитрующей смесью при $30-40^circ C$, выход продукта (м-нитробензойная кислота) составляет 75%:

2. НИТРОВАНИЕ КОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТОЙ
Используется значительно реже, чем нитрование нитрующей смесью. Достоинством метода является отсутствие необходимости регенерировать серную кислоту. К недостаткам метода относятся низкая концентрация образующегося нитроний катиона, снижение реакционной способности при разбавлении водой, выделяющейся в процессе нитрования, а также большой расход азотной кислоты (обычно в 1,5 раза выше теоретического). Например, бензол реагирует с концентрированной азотной кислотой очень медленно, даже при нагревании. Однако, нитрование бензола смесью концентрированный азотной и серной кислот протекает уже при $50 ^circ C$ с высоким выходом (85%).
Метод применяют, как правило, для нитрования активированных аренов, например, ксилола.
3. НИТРОВАНИЕ СМЕСЬЮ АЗОТНОЙ И УКСУСНОЙ КИСЛОТ
Этим методом нитруют активные арены, например, фенол, гидроксибензальдегид, салициловую кислоту, фуран, пиррол, производные нафталина, антрацен и другие.

4. НИТРОВАНИЕ РАЗБАВЛЕННОЙ АЗОТНОЙ КИСЛОТОЙ
Разбавленной азотной кислотой, в которой практически полностью отсутствуют ионы нитрония, можно нитровать реакционноспособные арены (фенолы и амины). Нитрование протекает по механизму “нитрозирование – окисление“.

Источник
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 20. Химические свойства, получение и применение бензола |
| Напечатано:: | Гость |
| Дата: | Суббота, 2 Январь 2021, 07:23 |
Химические свойства бензола
Как вы уже знаете, в молекуле бензола имеется устойчивая сопряжённая система π-связей. Поэтому для бензола характерны реакции замещения, так как в этих реакциях сопряжённая система сохраняется. Наоборот, реакции присоединения для бензола малохарактерны. Так, бензол не обесцвечивает бромную воду, но в присутствии катализатора он вступает с бромом в реакцию замещения.
1. Галогенирование
Для осуществления этой реакции бензол смешивают с бромом в колбе и добавляют катализатор FeBr3. При этом протекает реакция замещения одного атома водорода на бром:
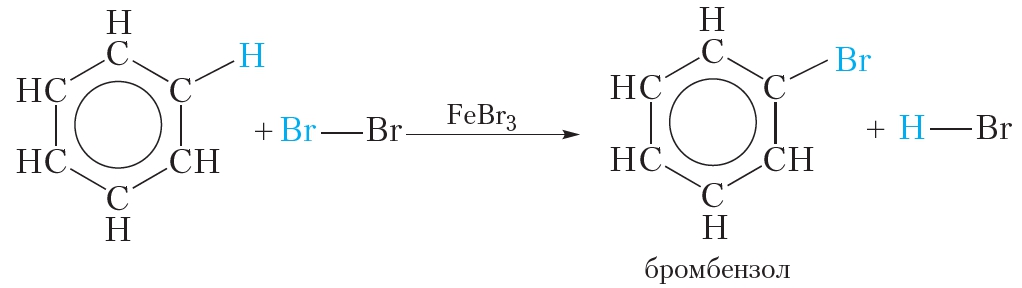
О протекании реакции можно судить по выделению бромоводорода, изменяющего цвет влажной индикаторной бумажки, помещённой в верхнюю часть колбы. Продукт бромирования бензола называется бромбензол.
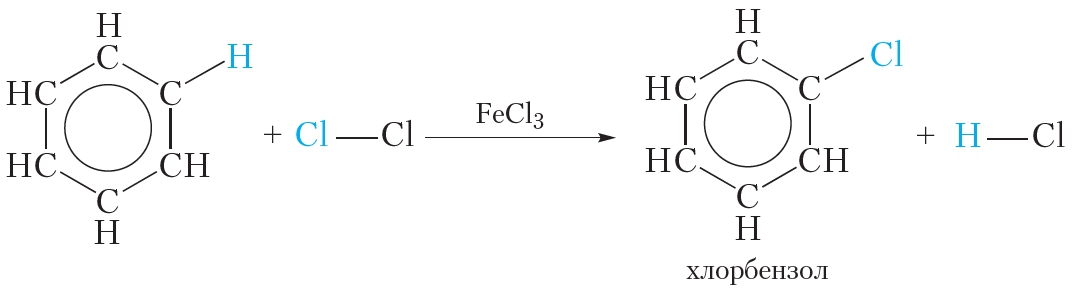
Как видно, в этой реакции единая система π-электронов сохраняется. Подобным образом проводят и хлорирование бензола:
2. Нитрование
Так называются реакции, в результате которых в молекулу органического соединения вводится группа — NO2, называемая нитрогруппой.
Если к смеси концентрированных азотной и серной кислот прибавить бензол, происходит реакция нитрования бензола, в результате которой образуется тяжёлая желтоватая жидкость с запахом горького миндаля — нитробензол:
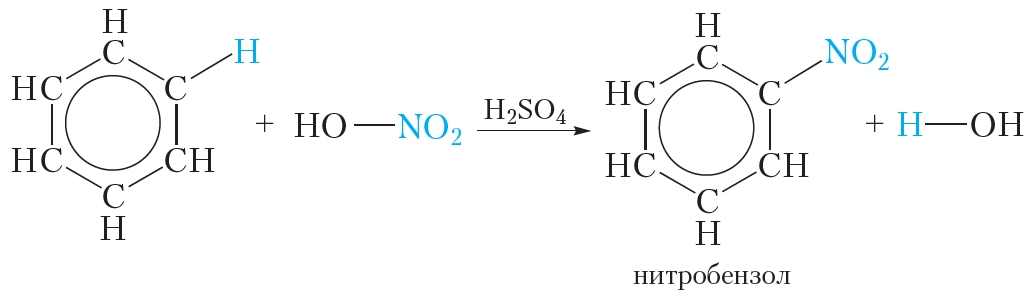
 Данная реакция так же, как и галогенирование, относится к реакциям замещения — один атом водорода в молекуле бензола замещается на группу — NO2.
Данная реакция так же, как и галогенирование, относится к реакциям замещения — один атом водорода в молекуле бензола замещается на группу — NO2.
Смесь концентрированных азотной и серной кислот называется нитрующей смесью. В нитрующей смеси азотная кислота выполняет роль нитрующего реагента, а серная кислота является катализатором.
С нитрованием гомолога бензола — толуола, продуктом которого является взрывчатое вещество, вы можете познакомиться, перейдя по ссылке в QR-коде.
3. Гидрирование
В жёстких условиях бензол может вступать в реакции присоединения. Примером реакции присоединения с участием бензола является его гидрирование, которое протекает при температуре около 200 °С под давлением в присутствии катализаторов гидрирования (никель или платина). При этом одна молекула бензола присоединяет сразу три молекулы водорода и превращается в циклогексан:
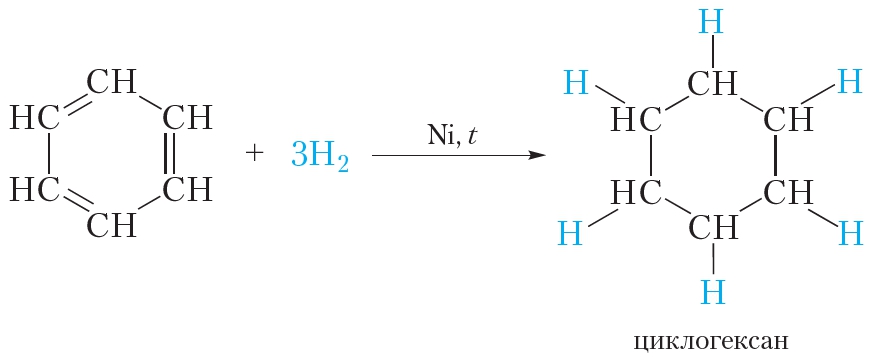
 Реакция гидрирования бензола протекает в более жёстких условиях, чем гидрирование алкенов, так как в молекуле бензола в ходе гидрирования разрушается устойчивая сопряжённая система π-связей.
Реакция гидрирования бензола протекает в более жёстких условиях, чем гидрирование алкенов, так как в молекуле бензола в ходе гидрирования разрушается устойчивая сопряжённая система π-связей.
С реакцией присоединения хлора к бензолу вы можете познакомиться, перейдя по ссылке в QR-коде.
4. Горение
Подобно всем углеводородам, бензол горит. Уравнение реакции горения бензола:
Получение бензола
Из природных источников
Благодаря высокой устойчивости сопряжённой системы p-связей, ароматические фрагменты встречаются в составе каменного угля. Поэтому одним из способов получения бензола является переработка каменного угля. При сильном нагревании без доступа воздуха каменный уголь подвергается сложным химическим превращениям. В результате образуется много летучих продуктов, из которых, наряду с другими веществами, извлекают бензол.
Бензол получают также в результате переработки нефти. Эти процессы будут рассмотрены в следующем параграфе.
Из ацетилена
Бензол можно получить из ацетилена:
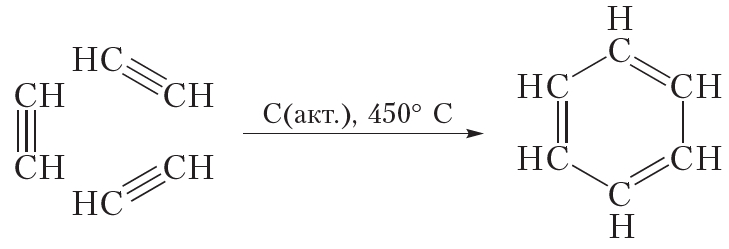
В данной реакции из трёх молекул ацетилена образуется одна циклическая молекула бензола, поэтому эта реакция называется реакцией циклотримеризации. Данная реакция протекает при пропускании ацетилена над нагретым активированным углём.
Применение бензола
Значительная часть бензола используется для синтеза других веществ. Так, нитрованием бензола получают нитробензол, который является исходным веществом для синтеза анилина (§ 45). Хлорированием бензола получают хлорбензол, который применяется для получения фенола (§ 27), пестицидов и т. д. Из бензола получают этилбензол. Дегидрированием этилбензола синтезируют винилбензол (стирол), который является сырьём для производства полимеров.
Бензол и некоторые его гомологи применяются в качестве растворителей органических веществ, однако из-за высокой токсичности бензола его применение в этом качестве ограниченно.
Для бензола характерны реакции замещения, в которых сопряжённая система π-связей сохраняется.
Бензол не обесцвечивает бромную воду, но в присутствии катализатора вступает с бромом в реакцию замещения с образованием бромбензола.
В жёстких условиях бензол вступает в реакцию присоединения с водородом. В результате образуется циклогексан.
Бензол получают в результате переработки нефти и каменного угля. Кроме того, бензол может быть получен по реакции циклотримеризации ацетилена.
*Нитрование толуола
Нитрование толуола
Примером нитросоединения с несколькими нитрогруппами в молекуле является продукт нитрования ближайшего гомолога бензола — толуола. При этом три атома водорода бензольного кольца замещаются на нитрогруппы:
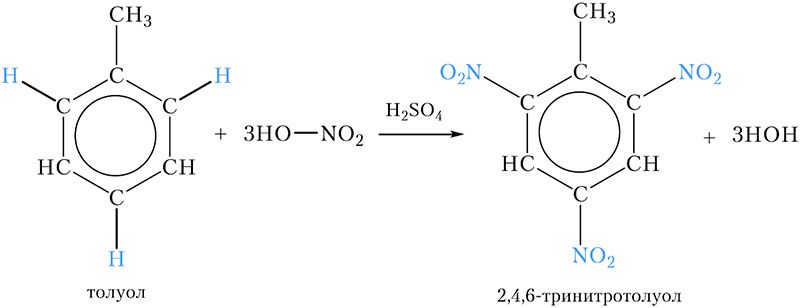
Название продукта — 2,4,6-тринитротолуол, его часто называют просто тринитротолуолом, ТНТ или тротилом. Тринитротолуол является взрывчатым веществом, которое используется в промышленности и военном деле.
*Хлорирование бензола
Хлорирование бензола
Молекула бензола может присоединить три молекулы хлора. Реакция протекает при нагревании и облучении ультрафиолетовым светом:
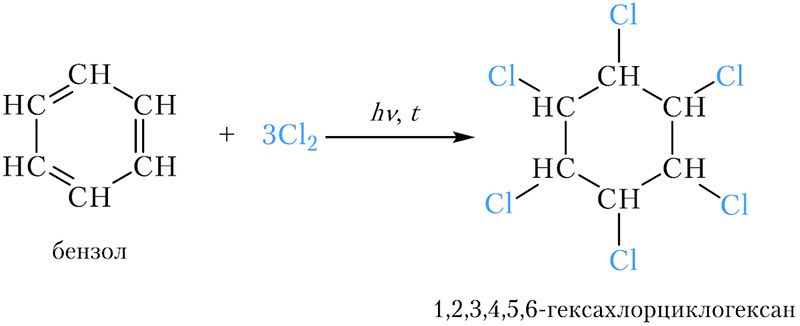
Образуется 1,2,3,4,5,6-гексахлорциклогексан, или гексахлоран. Это вещество долгое время использовалось в качестве инсектицида. Сейчас оно не применяется ввиду высокой токсичности.
Реакции гомологов бензола с участием боковой цепи
Гомологи бензола могут вступать в реакции замещения атомов водорода боковой цепи другими атомами. Используя это свойство, можно легко различить бензол и толуол. Для этого в две пробирки наливают по 2–3 см3 бензола и толуола соответственно, затем по 2–3 см3 бромной воды. Пробирки закрывают пробками и встряхивают. При этом бром из водной фазы за счёт лучшей растворимости в углеводородах переходит в органический слой, который находится сверху. При этом органический слой окрашивается в оранжевый цвет. Пробирки некоторое время интенсивно освещают. Через несколько минут можно наблюдать, что в одной из пробирок оранжевая окраска органического слоя сохранилась, тогда как во второй пробирке органический слой обесцветился. Обесцвечивание произошло в пробирке с толуолом за счёт протекания реакции замещения атома водорода метильной группы на атом брома:
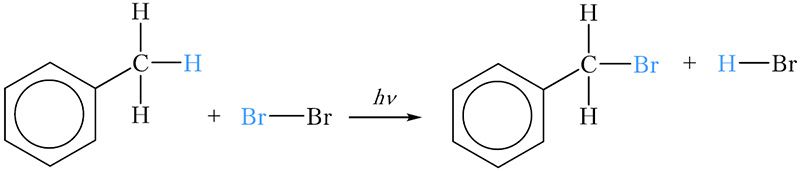
Образовавшееся бромпроизводное толуола не имеет окраски.
Эта реакция напоминает реакцию замещения атомов водорода в молекулах алканов атомами галогенов. Реакция протекает при освещении, это свидетельствует о радикальном механизме реакции замещения, инициируемой светом (§ 10).
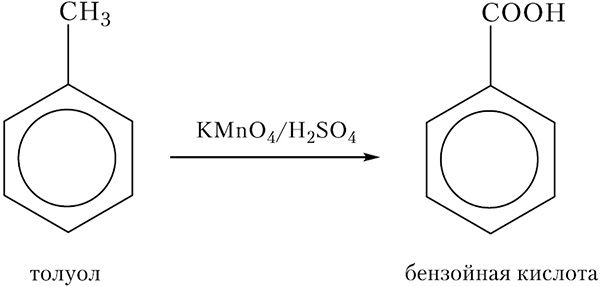
Атом углерода метильной группы в молекуле толуола легко окисляется, при этом образуется бензойная кислота. В качестве окислителя обычно используют раствор перманганата калия, подкисленный серной кислотой, либо хромовую смесь (раствор дихромата калия K2Cr2O7, подкисленный H2SO4). Схема реакции окисления толуола:
Вопросы и задания
1. Как распознать на основании химических свойств три жидкости: бензол, гексан и гексен-1? Приведите уравнения соответствующих реакций. Укажите условия их протекания. Опишите наблюдаемые явления.
2. Напишите уравнения реакций взаимодействия метана и бензола с хлором. Укажите условия их протекания. Почему обе реакции называются реакциями замещения?
3. Известно, что в присутствии платины этилен присоединяет водород даже при комнатной температуре. Бензол в этих условиях водород не присоединяет. Реакция присоединения водорода к бензолу протекает в жёстких условиях — при температуре 200 оС под давлением и в присутствии никеля в качестве катализатора. Объясните, с чем связано такое различие в реакционной способности этилена и бензола.
4. Приведите уравнение реакции циклотримеризации ацетилена в присутствии активированного угля. Какие продукты могут образоваться при циклотримеризации пропина в подобных условиях? Приведите их структурные формулы и дайте им названия.
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
6*. Напишите уравнение реакции нитрования толуола. Назовите продукт реакции. Где он используется?
7*. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
гептен-1 гептан толуол 2,4,6-тринитротолуол.
8*. Напишите структурные формулы всех гомологов бензола состава С9Н12. Назовите их.
9*. Каково строение углеводорода состава С8Н8, обесцвечивающего бромную воду, легко полимеризующегося, а при окислении дающего бензойную кислоту? Напишите уравнения описанных реакций.
(Ответ: стирол.)
10*. Установите строение ароматического углеводорода состава С9Н12, при моногалогенировании которого в присутствии катализатора получается только одно галогенпроизводное.
(Ответ: 1,3,5-триметилбензол.)
Источник
