Каком веществе содержится ионы

Что такое ионизация? Лучше всего ответ на этот вопрос даст википедия. Мы же в данной статье попробуем «на пальцах» рассмотреть и объяснить, что это такое.
Ионизация: что это такое и причины возникновения
Сначала необходимо затронуть легкие вопросы, которые касаются состава воздуха и структуры газов. Все вещества, находящиеся в воздухе, имеют нейтральный заряд, т.е. количество положительно заряженных частиц и отрицательно в веществе одинаковое.

Поэтому само вещество имеет нейтральный заряд. Если же баланс частиц в веществе нарушается, то причина этого кроется в образовавшихся новых ионах – положительных или отрицательных соответственно. Именно образование таких ионов называют ионизацией. И вот тут возникает вопрос, при каких же обстоятельствах эти ионы могут образовываться? Таких ситуаций в обычной жизни существует несколько. А именно:
- Воздействие на воздух (или газ) сильного электрического поля, когда большой показатель напряженности внутреннего электрического поля приводит к отрыву электрона от атома вещества. Научное название такой ионизации – ионизация электрическим полем.
- Воздействие на воздух (или газ) какой-либо энергией, которая приводит к столкновению частиц, повышению температуры, в результате чего электроны отрываются от атома вещества. Научное название этого вида ионизации – термическая ионизация
В этих двух случаях количество образовавшихся ионов достаточно большое. Бытуют суждения о существовании еще одной ситуации, в результате которой может наблюдаться ионизация. Это воздействие на воздух (или газ) так называемым «видимым светом». К такому свету относится инфракрасное и ультрафиолетовое излучение. Что касается инфракрасного излучения, то оно достаточно слабое и не может привести к ионизации. Ультрафиолетовое излучение же, в некоторых случаях, может привести к образованию небольшого количества ионов.
В природе источником ионизации могут являться некоторые растения, чаще всего это хвойные деревья. Также ионизация воздуха происходит при грозе за счёт сильных электрических разрядов. Поскольку ионизация наблюдается не только в газах, но и в жидкостях, то при мелком дроблении воды рядом с водопадами тоже можно наблюдать процесс ионизации.

Принимая во внимание различные научные высказывания, можно сделать вывод, что заряженные частицы воздуха (аэроионы) в целом положительно влияют на организм человека. При этом активизируются работа эритроцитов, увеличивая газообмен в легких примерно на 10%. Именно этот фактор и рассматривается в качестве основного положительного эффекта.
Положительный и отрицательный эффект ионизации
Однако ионизация воздуха имеет две стороны. Помимо самого известного положительного эффекта – улучшающего дыхания – есть много других позитивных воздействий на здоровье человека, но перечислять их все мы здесь не будем. Хотелось бы отметить лишь один из них, который напрямую на организм не воздействует. Рассмотрим его.
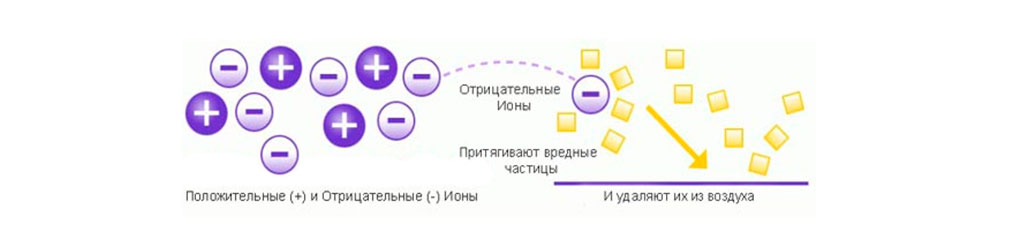
Ионизация воздуха способствует реакции осаждения неприятных газов, аэрозолей, а также всех твёрдых и жидких частиц на электродах, в качестве которых будут выступать различные предметы, стены. Объясняется это тем, что как только воздух начинает ионизироваться, ионы, содержащиеся в нем, приступают к заряжению частиц пыли. Заряженные частицы пыли движутся под действием поля к предметам, где и оседают.
Число ионов может быть различным. Существуют санитарно-гигиенические нормы, в которых регламентируются такие минимальные количества (СанПиН 2.2.4.1294-2003 от 15 июня 2003 года). В производственных и общественных помещениях они должны составлять 400 положительных или 400 отрицательных ионов на куб. см воздуха. Регламентируется и максимально допустимое количество – 50 000 положительных или 50 000 отрицательных ионов на куб. см воздуха.

Кроме положительных воздействий, ионизация может и причинить вред. В основном это касается людей, у которых имеются различного рода хронические заболевания или текущие болезни. Поэтому перед покупкой устройства, которое имеет функцию ионизации, необходимо внимательно ознакомиться с инструкцией и с перечисленными в ней противопоказаниями. Еще лучше получить консультацию у своего лечащего врача. Но даже если у человека есть противопоказания, то можно выращивать растения, которые способны естественным путем ионизировать воздух. Эффект чистого воздуха будет тот же, но без заряженных частиц ионов. В крайнем случае можно приобрести другие приборы, такие как увлажнитель и очиститель воздуха, которые будут давать эффект не хуже ионизатора.
Кстати, в некоторых случаях человек может и сам не знать, что в помещении, где он находится, работают приборы, которые при всей своей непосредственной работе еще и ионизирует воздух. Это такие приборы как, например, копировальные аппараты или лазерные принтеры.
Люстра Чижевского
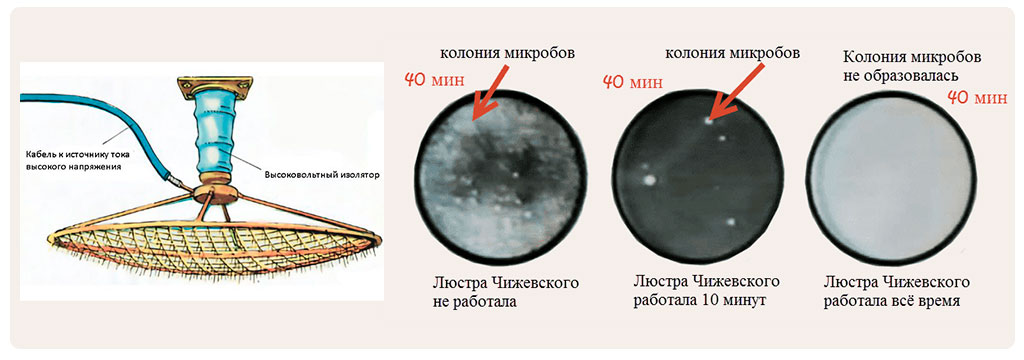
Один из распространенных аппаратов, который предлагается в качестве терапевтических действий, это люстра Чижевского. Доза выработки ионов в пределах 10000-100000 ионов на куб. см воздуха при норме работы от 5 до 60 минут. При этом хочется отметить, что люстра Чижевского производит только отрицательные ионы. Люстра работает на основе искусственной аэроионификации. Также на основе этого создан прибор для лечения – аэроионификатор, который повышает концентрацию отрицательных аэроионов кислорода в воздухе. Для эффективной генерации аэроионов подаваемое напряжение отрицательной полярности должно быть не ниже 25 кВ. Для обеспечения безопасности ток на люстре должен быть ниже 0,03 мА (на выходе перед люстрой ставится ограничивающее сопротивление 1ГОм).
Ионизация и озонирование воздуха – в чем различия
И последнее. Не стоит путать понятие ионизация и озонирование воздуха. Это совершенно разные явления и абсолютно разное принцип воздействия на организм человека. Хотя в некоторых случаях при ионизации воздуха имеет место небольшое озонирование, но это совершенно безопасно.
Источник
В уроке 9 «Ионы в водном растворе» из курса «Химия для чайников» рассмотрим растворение соли в воде, а также электролиз растворов и расплавов солей; познакомимся с законами Фарадея для электролиза и научимся находить продукты электролиза. Базой знаний для данного урока послужит материал из урока 8 «строение солей».
Растворение соли в воде
Из прошлого урока нам известно, что соли трудно расплавить и еще сложнее довести ее до кипения, однако, полярные жидкости, такие как вода, способны растворять соли без особых усилий, поскольку неполные положительные и отрицательные заряды на атомах полярных молекул воды в какой-то мере заменяют собой положительные и отрицательные ионы в кристаллической решетке соли. Другими словами, молекулы воды помогают разрушить кристалл соли.
Из рисунка видно, что происходит с положительными и отрицательными ионами при растворении в воде кристалла поваренной соли NaCl. Каждый ион Na+ окружается молекулами воды, которые обращены к нему отрицательно заряженными атомами кислорода. То же самое происходит с ионами Cl—, которые окружаются молекулами воды, обращенными к нему своими положительно заряженными атомами водорода. Ионы из кристалла соли оказываются гидратированными, а сам процесс присоединения молекул воды к ионам получил название — гидратация. Если в результате процесса гидратации устойчивость ионов, переходящих в раствор, становится больше их устойчивости в кристаллической решетке, то происходит растворение соли в воде. Хлорид натрия является отличным примером растворимой соли. И, наоборот, если энергия гидратации слишком мала, то кристалл является более устойчивой формой и не растворяется в воде. Примером таких нерастворимых солей является сульфат бария (BaSO4) и хлорид серебра (AgCl). Когда кристалл растворяется, он не просто распадается на ионы, а разъединяется на ионы молекулами жидкости, в которой происходит растворение. Неполярные жидкости (например, бензин С8H18) НЕ способны разъединять ионы в кристаллической решетке солей.
Электролиз растворов и расплавов солей
Металлы хорошо проводят ток — это знает каждый школьник. Электропроводность в металлах вызвана перемещением электронов в них, но ионы металла остаются неподвижными. Хотя кристаллы солей не проводят ток, зато растворы и расплавы солей это умеют и практикуют, так как анионы (отрицательные ионы) и катионы (положительные ионы) могут направленно перемещаться в противоположные направления, если приложить напряжение. Подвижность ионов соли оказывается еще большей, если она подверглась процессу гидратации.
Давным-давно английский ученый Майкл Фарадей расплавил соль (нагрев ее выше 801ºС), затем погрузил в расплав два электрода (катод и анод), а после взял и пропустил электрический ток через расплавленную соль. После этих манипуляций он обратил внимание что на электродах начали протекать химические реакции: ионы натрия начали мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия
- Na+ + e— (с катода) → Na
Хлорид-ионы мигрируют в другом направлении-в сторону анода, отдают ему свои избыточные электроны и окисляются до газообразного хлора
- Cl— → ½Cl2 + e—
Все это можно изобразить с помощью полной реакции, которая представляет собой разделение NaCl на составляющие его элементы:
- Na+ + Cl— → Na + ½Cl2
Весь процесс получил название электролиз, что означает «разрыв на части при помощи электричества». Для электролиза не обязательно расплавлять соль, можно также использовать обычный водный раствор соли, ведь подвижность ионов оказывается еще большей, если соль подверглась процессу гидратации. Но тогда полная реакция будет выглядеть иначе, и на катоде будет выделяться не металлический натрий, а газообразный водород:
- Na+ + Cl— + H2O → Na+ + ½Cl2 + ½H2 + OH—
Надеюсь, что вам стало интересно, почему продуктом электролиза водного раствора является не Na (как это было в расплавленной соли), а ½H2. Объясняется просто: часть молекул H2O диссоциируют на ионы H+ и OH—. Поскольку ион H+ обладает большим сродством к электрону (то есть сильнее его притягивает), нежели ион Na+, то ионы H+ первыми достигают катода, где незамедлительно восстанавливают недостающий электрон и превращаются из иона в полноценный газ H2, а ионы Na+ так и остаются в растворе.
Вот вам плюшка с продуктами электролиза водного раствора солей, может пригодится — может нет, но лучше законспектируйте:
А Фарадей тем временем не сидел без дела, а наблюдал, проводил опыты, использовал другие электролиты, увеличивал-уменьшал заряд и опять наблюдал. В конце концов он заметил взаимосвязь между количеством подаваемого электричества и количеством получаемых веществ. Установленные им закономерности называются законы Фарадея для электролиза. Сформулируем их:
- Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса элемента, выделяемого на электроде, пропорциональна количеству заряда, пропущенному через электролитическую ячейку.
- Для выделения на электроде 1 моля вещества, которое в процессе электрохимической реакции приобретает или теряет 1 электрон, необходимо пропустить через ячейку 96485 кулонов (Кл) электричества. Если в реакции принимает участие N электронов, для выделения моля продукта необходимо N·96485 Кл электричества.
Количество электричества, равное 96485 Кл, получило название 1 фарадей и обозначается символом F. Законы Фарадея становятся очевидными, если принять во внимание, что 1 F — это просто заряд 1 моля электронов, т.е. 6,022 1023 электронов. Множитель 6,022-1023, позволяющий переходить от индивидуальных молекул к молям вещества, одновременно позволяет перейти и от 1 электронного заряда к 1 F электрического заряда. Разумеется, в свое время Фарадей ничего не знал ни о числе Авогадро, ни о заряде электрона. Однако из проведенных экспериментов он смог сделать вывод, что заряды на ионах кратны некоторой элементарной единице заряда, так что 96485 Кл электричества соответствуют 1 молю таких единиц. Термин электрон впервые появился в 1881 г.; его ввел английский физик Дж.Стоней для обозначения элементарной единицы ионного заряда. Применять термин «электрон» к реальной отрицательно заряженной частице начали спустя еще 10 лет.
1 пример. Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль NaCl. Сколько граммов натрия и хлора выделится при пропускании 1 F электричества через электролитическую ячейку?
Решение: Уравнение реакции, протекающей на катоде: Na+ + е— → Na, а уравнение 1 анодной реакции: Сl— → Cl2 + е—. Когда через расплавленную соль NaCl проходит 1 моль электронов (1 F), каждый электрон восстанавливает 1 ион натрия, в результате чего образуется 1 моль атомов натрия. Следовательно, на катоде выделяется 22,990 г Na. На аноде происходит удаление 1 моля электронов от 1 моля хлорид-ионов, после чего остается 1 моль атомов хлора, которые попарно соединяются, образуя 1/2 моля молекул Сl2. Следовательно, масса газообразного хлора, выделяющегося на аноде, должна быть равна 35,453 г (что равно атомной массе Сl, или половине молекулярной массы Сl).
Пример 2. Сколько граммов металлического магния и газообразного хлора выделяется при пропускании 1 F электричества через электролитическую ячейку с расплавленным хлоридом магния, MgCl2?
Решение: На катоде происходит реакция Mg2+ + 2е— → Mg, а на аноде — реакция 2Сl— → Сl2 + 2е—. Поскольку для восстановления каждого иона Mg2+ необходимо 2 электрона, 1 моля электронов хватит только для восстановления половины моля ионов магния, таким образом на катоде должно выделиться 12,153 г магния. (Атомная масса магния равна 24,305 г/моль.) Как и в примере 1, на аноде окислится 1 моль ионов Сl— и выделится половина моля, т.е. 35,453 г, газообразного Сl2.
Пример 3. Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы Аl3 +. Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг металла.
Решение: 1 кг алюминия содержит 1000 г / 26,98 г·моль-1 = 37,06 моля атомов. Поскольку на выделение каждого атома алюминия необходимо 3 электрона, на 37,06 моля атомов потребуется 3·37,06 = 111,2 моля электронов. Это количество электричества эквивалентно 111,2F, или 10 730 000 Кл.
Надеюсь урок 9 «Ионы в водном растворе» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к уроку 10 «Ионы в газе».
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Источник
Частица, в которой содержится разное число протонов и электронов, называется ионом. Если количество протонов больше, ион приобретает положительный заряд и становится катионом. Ионы с отрицательным зарядом (преобладают электроны) называются анионами.

Общее описание
Впервые в химии понятие «ион» появилось в 1834 году благодаря экспериментам Майкла Фарадея. Учёный изучал электропроводность водных растворов кислот, солей, щелочей. Он предположил, что возможность проводить электричество обусловлена движением в растворе заряженных частиц – ионов.
Молекулы способны распадаться на ионы – атомы с недостатком или избытком электроном. Процесс распада называется электролитической диссоциацией, а образованный раствор или расплав – электролитом. Если опустить в раствор электролита электрод, катионы начнут двигаться к катоду – отрицательному полюсу, анионы – к аноду – положительному полюсу. Этим объясняется электропроводность электролитов.
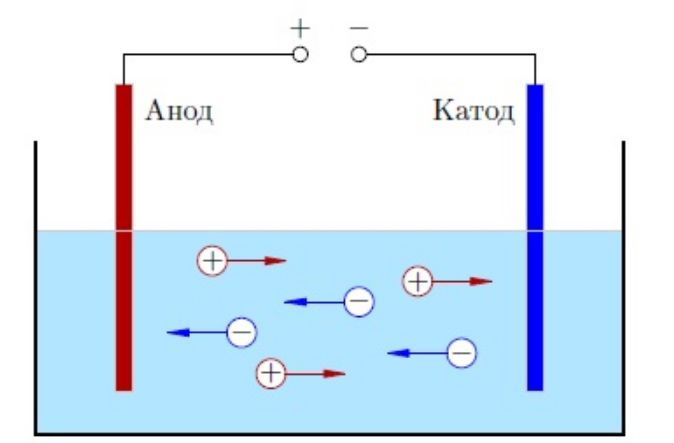
Рис. 1. Движение ионов под действием электрода.
В растворах или в расплавах ионы образуются под действием молекул воды или высокой температуры.
Строение
Ионы состоят из ядра и электронов, движущихся вокруг. Ядро образуют положительно заряженные частицы (протоны) и нейтральные частицы (нейтроны). Количество протонов совпадает с порядковым номером элемента. Количество нейтронов равно значению разницы между относительной атомной массой и количеством протонов.
Электроны располагаются на энергетических уровнях. Количество уровней совпадает с периодом, в котором находится элемент. На внешнем энергетическом уровне находятся валентные электроны, которые могут взаимодействовать с другими атомами. При отдаче валентных электронов атом превращается в катион, при присоединении дополнительного электрона становится анионом.
Например, если к атому хлора присоединить ещё один электрон он станет отрицательно заряженным ионом – анионом. А если у атома натрия отнять один электрон, он станет положительно заряженным ионом – катионом, т.к. количество протонов станет больше, чем отрицательных электронов.
Катионы в уравнениях отмечаются плюсом, а анионы – минусом. Например, Fe2+, Al3+, Na+, F–, Cl–. Цифра означает, сколько электронов отдал или принял атом, став ионом, т.е. показывает степень окисления. Количество катионов или анионов можно посмотреть по таблице растворимости веществ.

Рис. 2. Таблица растворимости.
Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
К простым ионам относятся катионы и анионы металлов и неметаллов – Na+, Mg2+, Cl–. Сложные ионы образуются при присоединении иона к нейтральным молекулам вещества. Например:
- NH3 + H+ → NH4+;
- BF3 + F– → BF4–.
Катионами являются ионы металлов, водорода, аммония и некоторых других веществ. Анионами являются гидроксид-ион (OH–), ионы кислотных остатков, неметаллов и других веществ.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Также выделяют ион-радикалы – свободные заряженные частицы, способные присоединять атомы или присоединяться к атомам других веществ. В зависимости от заряда делятся на китионы-радикалы и анионы-радикалы.
Ионная связь – класс соединения ионов. Ионная связь возникает в результате электростатического притяжения анионов и катионов. При этом атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионная связь возникает преимущественно между ионами металлов и неметаллов. Металл всегда отдаёт электроны, т.е. является восстановителем.
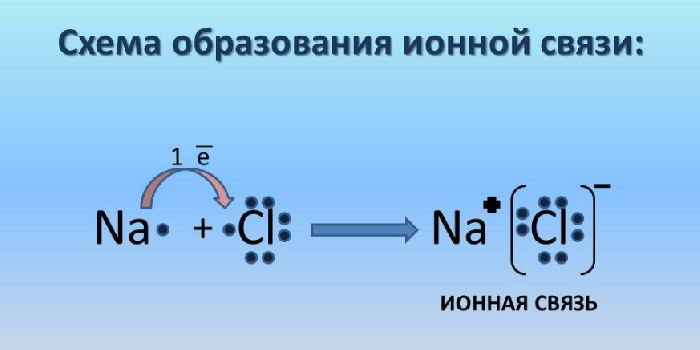
Рис. 3. Схема ионной связи.
Что мы узнали?
Из темы урока узнали, что такое ионы. Атом становится ионом при отщеплении или присоединении электронов. Если электронов становится меньше, то атом приобретает положительный заряд за счёт преобладания протонов и становится катионом. При увеличении количества отрицательно заряженных электронов атом становится анионом. Ионы способны передавать электричество и обязательно присутствуют в электролитах. Между ионами возникает ионная связь за счёт электростатического притяжения отрицательных и положительно заряженных частиц.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Сергей Ефремов
7/10
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 60.
Источник
