Какую информацию о свойствах элемент

Каждый элемент имеет свое строго уникальное строение, в соответствии с которым он и занимает свое постоянное, четко определенное место в периодической системе.
При рассмотрении периодической таблицы элементов, зная химические и физические свойства каждого элемента, можно сделать выводы о закономерностях изменения этих свойств.
Повторение свойств элементов
С увеличением атомной массы происходит периодическое повторение свойств элементов.
Так, одиннадцатый элемент ряда – натрий – имеет общие свойства с третьим химическим элементом – литием. В рамках ряда от лития до фтора металлические свойства соединений постепенно уменьшаются и при этом возрастают неметаллические свойства. И действительно, после активного щелочного металлического элемента лития четвертым размещен тоже металлический элемент бериллий, но уже с амфотерными свойствами соединений. Пятый, шестой, седьмой, восьмой, девятый и десятый элементы – неметаллические. Активность простых веществ и соединений этих элементов с увеличением порядкового номера возрастает и достигает максимума у фтора.
Причиной периодической повторяемости свойств химических элементов и образованных ими соединений является образование у элементов одинакового строения внешнего энергетического уровня (для элементов главных подгрупп) и предпоследнего энергетического уровня (для элементов побочных подгрупп).
Закономерности изменений свойств
Таким образом, рассмотрев свойства каждого из соединений и их изменения в группах и периодах можно составить определенные закономерности.
В рамках одного периода с увеличением порядковых номеров элементов (при движении вниз по периоду) прослеживаются закономерные изменения, характерные для всей таблицы.
При движении вниз по периоду металлические и основные свойства у простых веществ ослабляются, а неметаллические и кислотные – усиливаются.
Кроме размещения в горизонтальных рядах — периодах, элементы входят в состав вертикальных столбиков — групп. Рассмотренные свойства природных семей щелочных элементов, галогенов и инертных элементов дают возможность сделать вывод, что наиболее активные металлы размещены в группе под номером 1, то есть в начале периодов, а самые активные неметаллы — в группе под номером 7, то есть в конце периодов.
Инертным элементом 18 группы заканчивается каждый период.
Если провести воображаемую линию через элементы алюминий, германий, олово, стибий, свинец, полоний, которая разделит периодическую систему на две не равных части, то верхняя правая часть будет содержать неметаллы, нижняя левая — металлы, а элементы, образующие линию разделения, — это металлы с амфотерными свойствами оксидов и гидроксидов.
Зависимость от строения электронных оболочек атомов
На основе современной теории строения атома ученые объясняют, что характер химических свойств и его изменение в периодах находятся в зависимости от изменения строения электронных оболочек атомов. Чтобы понять, какие различия в строении электронных оболочек вызывают ослабление металлических и усиление неметаллических свойств, сравним электронные формулы атомов пары элементов — алюминия и фосфора.
Как видим, количество энергетических уровней у атомов алюминия и фосфора одинаково — их 3. Однако у каждого из них разное число электронов на внешнем (крайнем) энергетическом уровне, которое с увеличением порядкового номера элемента (13 у алюминия и 15 у фосфора) растет. Делаем вывод, что причиной ослабления металлических и усиления неметаллических свойств элементов одного периода является рост числа электронов на внешнем энергетическом уровне.
Итак, в зависимости от собственно строения атома элемента и, соответственно, в какой части периодической системы размещен этот элемент, его соединения проявляют или основные, или кислотные, или амфотерные химические свойства.
Рассмотренные зависимости еще раз подтверждают универсальный характер периодического закона и доказывают, что он является фундаментальным законом природы.
Источник
Источник: https://allpozitive.ru/
Даже если вы не химик, вы точно знаете хоть что-то об этой таблице — например, кто её открыл, как она выглядит, что в ней находится.
Но если вы химик или хотите начать изучать химию — на мой взгляд, вы просто обязаны знать всё, что заложено в ней. Ведь таблица — один большой кладезь справочных данных и свойств, без которых в химии ни шагу нельзя ступить!
В данной статье будут рассмотрены все основные закономерности таблицы… в рамках школьного курса химии — на самом-то деле их гораздо больше.
! Кстати, настоятельно рекомендую положить перед собой таблицу во время прочтения этой статьи. Или хотя бы отдельную вкладку в браузере с ней открыть. Иначе восприниматься материал будет крайне тяжело.
Статика: определённое положение элемента
Положения
Как шахматная доска состоит из строк, столбцов и полей, так и таблица состоит из периодов, групп (которые, в свою очередь, делятся на главные и побочные подгруппы) и фиксированных номеров химических элементов.
Период — это строки, горизонтальные ряды.
Группы — столбцы, ряды вертикальные.
Как определить, где главная подгруппа, а где побочная? Посмотрите на второй и третий период — там элементы только главных подгрупп. Они находятся с одного “бока” ячейки. Если опуститься на периоды ниже, можно заметить, что некоторые элементы смещены в другую сторону ячеек (Cu, Ag, Au, Rg в первой группе, например). Вот это и есть побочная подгруппа.
И, наконец, есть определённая нумерация этих самых ячеек, в которых находятся элементы — их порядковые номера.
Давайте потренируемся и составим “паспортные данные” хрома. Будет лучше, если вы сначала попробуете сами, а потом посмотрите ответ.
https://himi4ka.ru/
Легко и ненавязчиво находим, что хром находится в четвёртом периоде и шестой группе. Находится чуть в стороне от кислорода и серы — следовательно, подгруппа побочная. Ну и, не без некоторых усилий (спасибо, Дзен, за качество и невозможность приближать изображение) обнаруживаем его под двадцать четвёртым номером.
Ответ: четвёртый период, шестая группа, побочная подгруппа, двадцать четвёртый номер.
Всё очень просто!
Свойства
Каждому положению элемента относительно той или иной части таблицы соответствует определённое свойство.
Сопоставим их:
1. Период, в котором находится элемент — показывает число электронных слоёв элемента.
2. Группа — показывает наибольшее число электронов, которые атом может отдавать для образования хим. связи (максимальная валентность). Также показывает максимальную положительную степень окисления.
Следует отметить, что в химии присутствует некое “зло”. Химическое “зло” — большое количество исключений в некоторых разделах, и данный пункт, простите за каламбур, не является исключением.
Так, например, фтор, пусть и находится в седьмой группе, никогда не проявляет степень окисления +7, а у железа нет валентности VIII.
3. По тому, находится элемент в побочной или главной подгруппе, можно определить, металл это или неметалл.
Зачем это нужно, если в учебниках они всегда есть на красиво разукрашенном форзаце?
Всё это, конечно, замечательно, но что будет, если вам попадётся вариант в ч/б?
Кстати, именно такую таблицу раздают на ЕГЭ по химии. И некоторые ребята впадают в ступор уже на втором задании, когда их просят определить, относится элемент к металлам или неметаллам.
Чтобы не потерять лёгкие баллы, запомните:
Металлы — это элементы главных подгрупп 1-ой и 2-ой группы (исключение — водород и гелий), а также все элементы побочных подгрупп.
Неметаллы — все остальные.
Ну и, наконец, есть порядковый номер. Зная его, мы можем определить заряд ядра, число протонов, число электронов и, соответственно, найти число нейтронов через относительную атомную массу и протоны.
Вернёмся к нашему хрому. Как мы помним, он находится в четвёртом периоде, шестой группе, побочной подгруппе и имеет 24-ый номер.
Переводя на свойства: имеет четыре электронных слоя; имеет максимальную валентность VI и степень окисления +6; металл; его заряд/число протонов/число электронов равно 24, а число нейтронов — 28 (52 – 24 = 28).
Очень коварен в плане расчёта нейтронов хлор. Попробуйте сами найти нужное их количество, а в следующей статье узнаете, правы ли вы — поэтому не забудьте подписаться на канал, чтобы ничего не пропустить!
Ну а мы переходим к изменению свойств по периодам и группам.
Динамика
Всё завязано на радиусе атома. Помня об этом, вы всегда можете показать изменение электроотрицательности, окислительно-восстановительных, металлических/неметаллических свойств.
Посмотрите внимательно на распределение электронов по слоям у первых четырёх элементов первой группы и первых четырёх элементов седьмой группы.
Так уж мир устроен — всё стремится к стабильности. Люди ли это, государства, какие-то химические частицы — неважно. Среди химических элементов своеобразным образцом стабильности являются так называемые “благородные газы” — элементы главной подгруппы восьмой группы.
Все остальные химические элементы стремятся этому образцу соответствовать, поэтому химические свойства веществ обусловлены…
… не чем иным, как желанием достигнуть электронной конфигурации благородных газов путём принятия либо отдачи электронов.
Очевидно, что натрию легче отдать один электрон, чтобы достигнуть конфигурации неона, чем присоединить семь электронов и стать “вторым аргоном” — у него и свободных орбиталей-то для этого нет!
Ещё легче с этим решением калию — мало того, что ему так же выгоднее затратить меньшее количество энергии, отдав один электрон вместо присоединения нескольких, так у него ещё и сам валентный электрон далеко — радиус больше, из-за этого его труднее удерживать.
Обратную картину наблюдаем в седьмой группе. Картина, впрочем, объясняется теми же самыми общими закономерностями.
Есть фтор. Ему “впадлу” отдавать семь электронов, когда можно отнять у кого-нибудь один и начать косплеить неон. А есть йод, йоду тоже впадлу — но у него радиус больше, поэтому ему сложнее присоединять присоединить этот несчастный электрон.
Исходя из этих примеров, мы можем вывести некоторые закономерности изменения химических свойств при движении по группам и периодам:
1. Окислительно-восстановительные свойства — собственно, способность присоединять/отдавать электроны, изменяя степень окисления.
Сверху-вниз по группе — возрастают восстановительные (вспомните натрий и калий), уменьшаются окислительные, слева-направо по периоду — уменьшаются восстановительные (вспомните элементы первой группы и элементы седьмой), увеличиваются окислительные.
2. Металлические/неметаллические свойства — то же самое, что и в первом свойстве — отдача/принятие электронов, следовательно — закономерности будут аналогичны.
Разница между окислительно-восстановительными свойствами и металлическими/неметаллическими состоит в том, что первые применительны к частицам (катионам, анионам), а вторые — к простым веществам.
3. Электроотрицательность — способность присоединять электронные пары при образовании химической связи. Снова присоединение/отдача электронов => аналогично первым двум свойствам.
А вот со следующими двумя свойствами рекомендую быть максимально осторожным.
4. Кислотно-основные свойства ОКСИДОВ И ГИДРОКСИДОВ — в группе (сверху вниз) увеличиваются основные свойства, уменьшаются кислотные, по периоду (слева направо) – наоборот, кислотные увеличиваются, а основные – уменьшаются.
5. А однажды моему знакомому встретилось такое задание:
“Тематический тренинг” В. Н. Доронькина
Как вы видите, под цифрой 2 просят указать элементы в порядке возрастания кислотных свойств водородных соединений. Которые он, очевидно, принял за кислотные свойства оксидов и гидроксидов, поэтому там написан неправильный ответ и недоумевающий знак вопроса.
С кислотными свойствами водородных соединений всё с точностью до наоборот… Хотя, нет, ладно, не всё. Наполовину.
Давайте просто вспомним, что вообще такое кислотные свойства. Если очень коротко и упрощённо:
Кислотные свойства – это способность отдавать протон водорода.
А какая разница, протон, электрон – ведь всё опять возвращается на круги своя, к атомному радиусу!
Чем больше он, тем больше длина связи. Чем больше длина связи, тем легче отдавать те или иные частицы. Значит, по группе (сверху вниз) кислотные свойства водородных соединений УСИЛИВАЮТСЯ. Это, кстати, объясняет, почему плавиковую кислоту (HF) считают слабее, чем её соседей с нижних этажей – HCl, HBr, HI.
Пятое свойство упоминается не так часто, как четвёртое, но оно имеет место быть в том числе и в заданиях ЕГЭ. Будьте внимательны.
На сегодня всё, не забудьте определить ЧИСЛО НЕЙТРОНОВ ХЛОРА, в следующей статье мы рассмотрим детальнее этот вопрос (а заодно обсудим изотопы, атомную массу и многие другие интересные вещи) и проверим, правы ли вы в своих рассуждениях, поэтому не забудьте поставить лайк и подписаться на канал!
Крайне занятная таблица. Но если вы школьник, то учить её не стоит, одолейте хотя бы классику 🙂
Источник
Ïîõîæèå ïîñòû

Ñóëüôèä æåëåçà(II) (FeS) – âåùåñòâî, êîòîðîå îáðàçóåòñÿ ïðè âçàèìîäåéñòâèè æåëåçà ñ ñåðîé. Ïðèìåíÿåòñÿ êàê ñûðüå â ïðîèçâîäñòâå ÷óãóíà, à òàêæå ÿâëÿåòñÿ òâåðäûì èñòî÷íèêîì ñåðîâîäîðîäà. Íà ôîòîãðàôèÿõ ìîæíî çàìåòèòü ÷àñòèöû ìåòàëëè÷åñêîãî æåëåçà, êîòîðîå íå ïðîðåàãèðîâàëî ñ ñåðîé.
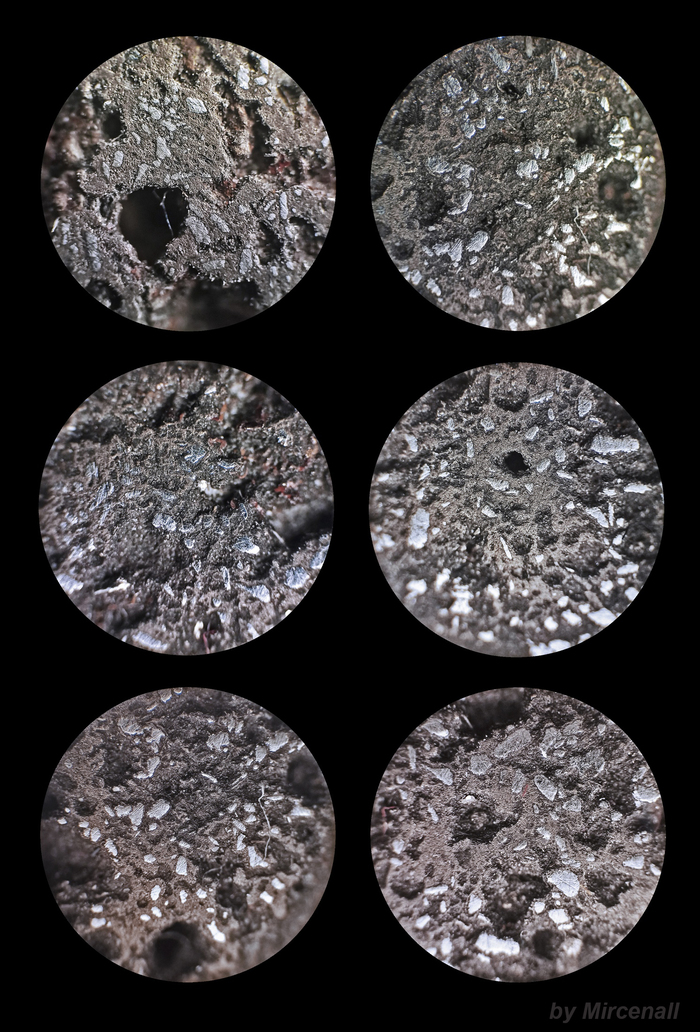
 ïðèðîäå ñóëüôèä æåëåçà(II) âñòðå÷àåòñÿ êðàéíå ðåäêî, îäíàêî ðàñïðîñòðàí¸í äèñóëüôèä æåëåçà(II) (FeS2), èçâåñòíûé êàê ìèíåðàë ïèðèò èëè ñåðíûé êîë÷åäàí.
vk.com/mircenall

Ïîêàçàòü ïîëíîñòüþ
3
Íîâûé ìåäüñîäåðæàùèé êîìïëåêñ, èäåþ ñòðîåíèÿ êîòîðîãî ïîäñêàçàëà ïðèðîäà, ýôôåêòèâíî ðàñùåïëÿåò âîäó â íåéòðàëüíîé ñðåäå. Ýòî îòêðûòèå ìîæåò ñäåëàòü áîëåå äîñòóïíûì ïîëó÷åíèå âîäîðîäà ñ ïîìîùüþ âîññòàíîâëåíèÿ âîäû.
Ìîëåêóëÿðíûé âîäîðîä äàâíî ðàññìàòðèâàþò êàê àëüòåðíàòèâó íåôòè è ãàçó. Åäèíñòâåííûé ïðîäóêò ñãîðàíèÿ âîäîðîäà âîäà, êîòîðàÿ ñàìà ìîæåò áûòü èñòî÷íèêîì âîäîðîäà. Ìíîãèå èññëåäîâàòåëüñêèå ãðóïïû ïî âñåìó ìèðó ñòàðàþòñÿ ðàçðàáîòàòü êàòàëèçàòîðû, ñïîñîáíûå ïîíèçèòü ýíåðãèþ âîññòàíîâëåíèÿ âîäû äî ìîëåêóëÿðíîãî âîäîðîäà è îáëåã÷èòü ïðîòåêàíèå ýòîé ðåàêöèè. Íàèáîëåå ýôôåêòèâíûå êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû â íàñòîÿùåå âðåìÿ êîîðäèíàöèîííûå ñîåäèíåíèÿ ðóòåíèÿ è èðèäèÿ. Ê íåäîñòàòêàì îáîèõ ìåòàëëîâ ìîæíî îòíåñòè èõ íèçêèå êîíöåíòðàöèè â çåìíîé êîðå è âûñîêóþ ñòîèìîñòü.
Íîâîå èññëåäîâàíèå äåìîíñòðèðóåò, ÷òî â ïðèñóòñòâèè ïîðôèðèíîâîãî êîìïëåêñà ìåäè ýëåêòðîêàòàëèòè÷åñêîå ðàñùåïëåíèå âîäû ïðîèñõîäèò ïðè íåéòðàëüíûõ çíà÷åíèÿõ ðÍ è ïðè íèçêîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà. Ïðè 310 ì è ðÍ 7 âîäà îêèñëÿåòñÿ ñ âûäåëåíèåì ìîëåêóëÿðíîãî êèñëîðîäà, à â êèñëîé ñðåäå (ïðè òîì æå ýëåêòðîäíîì ïîòåíöèàëå) äî ïåðåêèñè âîäîðîäà. Õîòÿ ìåäíûé êîìïëåêñ è íå ïðåâîñõîäèò ïî ïðîèçâîäèòåëüíîñòè êîìïëåêñû áëàãîðîäíûõ ìåòàëëîâ, âñå æå ýòî áîëüøîé øàã âïåðåä ìåíüøàÿ ýôôåêòèâíîñòü ïðîèçâîäíûõ ìåäè êîìïåíñèðóåòñÿ åå áîëüøåé ðàñïðîñòðàíåííîñòüþ è äåøåâèçíîé. Êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû íà îñíîâå ìåäè áûëè èçâåñòíû è ðàíåå, íî îíè ðàáîòàëè â ñèëüíîùåëî÷íîé ñðåäå è ïðè áîëüøîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà.
Èññëåäîâàòåëè èñõîäèëè èç òîãî, ÷òî â ïðîöåññå ôîòîñèíòåçà êëþ÷åâóþ ðîëü â îêèñëåíèè âîäû è âûäåëåíèè êèñëîðîäà èãðàåò ìàãíèéïîðôèðèíîâûé êîìïëåêñ. Òåì íå ìåíåå ñïîñîáíîñòü ìåäüïîðôèðèíîâîãî êîìïëåêñà êàòàëèçèðîâàòü îêèñëåíèå âîäû îêàçàëàñü ïðèÿòíîé íåîæèäàííîñòüþ äëÿ ìíîãèõ õèìèêîâ êàê ñïåöèàëèñòîâ ïî õèìèè ïîðôèðèíîâûõ êîìïëåêñîâ, òàê è òåõ, êòî çàíèìàëñÿ ðàñùåïëåíèåì âîäû. Åùå îäíà íåîáû÷íàÿ ÷åðòà ýòîãî êàòàëèçàòîðà îêèñëåíèå âîäû äî ïåðåêèñè âîäîðîäà ïðè íèçêèõ çíà÷åíèÿõ ðÍ. Ýòîò ïðîöåññ íå ñòîèò ðàññìàòðèâàòü êàê íîâûé ñïîñîá ïîëó÷åíèÿ H2O2, è âñå æå îí òðåáóåò âíèìàíèÿ. Óñòàíîâèâ, êàê îáðàçóåòñÿ ïåðåêèñü âîäîðîäà, èññëåäîâàòåëè ñìîãóò îïðåäåëèòü ìåõàíèçì ýòîé êàòàëèòè÷åñêîé ðåàêöèè è âûÿñíèòü, êàê ïîâûñèòü ýôôåêòèâíîñòü ðàñùåïëåíèÿ âîäû.


Ïîêàçàòü ïîëíîñòüþ
3
 îäíîì èç ïîñòîâ îá îëîâå ïèêàáóøíèêîâ çàèíòåðåñîâàëà òàêàÿ äåòàëü – ïðè òåìïåðàòóðå íèæå 13.2°C êîâêîå è ïëàñòè÷íîå îëîâî ïåðåõîäèò â äðóãóþ “ñåðóþ” àëëîòðîïíóþ ìîäèôèêàöèþ.

Ïðè ýòîì ïåðåõîä ñîïðîâîæäàåòñÿ óâåëè÷åíèåì îáúåìà íà 25,6 %, â ñâÿçè ñ ÷åì âîçíèê âîïðîñ
Ñîáñòâåííî ýòî ÿ è ðåøèë ïðîâåðèòü.
Ïåðâûì äåëîì íàøåë â ëàáîðàòîðèè ÷èñòîå îëîâî (ïðîâîëîêà ïðèïîÿ íå ïîäîéäåò, èáî îíà ñîäåðæèò ñâèíåö, êîòîðûé êàê ðàç òàêè ïðåäîòâðàùàåò ðàçðóøåíèå). Îëîâî õðàíèòñÿ â âèäå ìàëåíüêèõ ãðàíóë, íî ÿ ïåðåïëàâèë åãî â êóñîê ïîáîëüøå.

Äåëàòü èäåàëüíóþ äåðåâÿííóþ êîðîáêó áûëî áû ñëèøêîì äîëãî, òàê ÷òî ðåøèë çàëèòü êóñîê ìåòàëëà â ãèïñ è âûñòàâèòü íà ìîðîç íà äîëãîå âðåìÿ â çàêðûòîé êîðîáêå.


Êðîìå òîãî, ÷åì íèæå òåìïåðàòóðà, òåì áûñòðåå îñóùåñòâëÿåòñÿ ïåðåõîä (íàèáîëåå áûñòðîå ïðåâðàùåíèå íàáëþäàåòñÿ ïðè òåìïåðàòóðå íèæå -33°C). Ïîñêîëüêó íà÷àëî çèìû â ñòîëèöå âûäàëîñü òåïëûì, ÿ ðåøèë ïðîâîäèòü ýòîò ýêñïåðèìåíò ñ ñåðåäèíû ÿíâàðÿ. Ãèïñîâûé ñëåïîê ñ îëîâîì ÿ ïîëîæèë â êîðîáêó (äàáû çàùèòèòü åãî îò âîäû) è îñòàâèë íà ïîäîêîííèêå, ðåøèâ îòêðûòü ñïóñòÿ ìåñÿö.

×åðåç ìåñÿö ôîðìà îñòàëàñü ëåæàòü, êàê ëåæàëà. Îäíàêî êàê ðàç ñ ñåðåäèíû ôåâðàëÿ óäàðèëè ñèëüíûå ìîðîçû è ïðîöåññ äîëæåí áûë óñêîðèòüñÿ (òåì âðåìåíåì ïèêàáó íà÷àëî íàïîìèíàòü î ñåáå)

Îòêðûâ êîðîáêó óæå â ìàðòå, ÿ óâèäåë æåëàííîå èçìåíåíèå – òðåùèíó, ðàçäåëèâøóþ ñëåïîê íà äâå ïîëîâèíû!

Àêêóðàòíî äîñòàâ åãî, ÿ ðàçäåëèë ïîëîâèíêè ôîðìû è îòòóäà ïîñûïàëñÿ òåìíûé ïîðîøîê ñ ìåòàëëè÷åñêèì áëåñêîì (è îñòàòîê êóñêà áåëîãî îëîâà, ïîâåðõíîñòü êîòîðîãî áûëà òàêæå âñÿ â ñåðîé ìîäèôèêàöèè ).  êîíöå êîíöîâ îíî-òàêè ðàçîðâàëî ãèïñ.

Ñåðîå îëîâî ñêîðåå ïîõîæå íà ãðàôèò ñ áëåñêîì ñâèíöà, ÷åì íà ìåòàëë. ×òîáû íàãëÿäíî ïðîäåìîíñòðèðîâàòü îòëè÷èå, ÿ âûñûïàë ðÿäîì ïîðîøîê áåëîãî îëîâà è ïîëó÷åííîå ñåðîå. Îäíàêî âåðíóòü åìó èñõîäíîå ñîñòîÿíèå íå ñîñòàâëÿåò òðóäà – òðåáóåòñÿ ëèøü ðàñïëàâèòü α-îëîâî è ñëèòîê ñíîâà áóäåò ÿâëÿòüñÿ áåëûì β-îëîâîì

Òàêèì îáðàçîì ïðåäïîëîæåíèå î ðàçðûâàþùåì êîíòåéíåðå îëîâå ïîäòâåðæäåíî

P.S. îòäåëüíàÿ áëàãîäàðíîñòü ñåäüìîé ïàðòèè ãðàíóëèðîâàííîãî îëîâà Óðàëüñêîãî çàâîäà õèìðåàêòèâîâ îò íîÿáðÿ 1977 ãîäà. Èíà÷å áû ýêñïåðèìåíò íå ñîñòîÿëñÿ.


Ïîêàçàòü ïîëíîñòüþ
12
Êðèñòàëëû ñåðåáðà íà ìåäè.

Ñåðåáðî âûäåëÿåòñÿ íà òðåóãîëüíûõ ìåäíûõ ïëàñòèíêàõ, ïîãðóæåííûõ â ðàñòâîð íèòðàòà ñåðåáðà

Ìåäü
Öèíê

Ñåðåáðî

Îëîâî

Ñâèíåö

Ïîêàçàòü ïîëíîñòüþ
2

Îêñèãåìîãëîáèí íå ôåððîìàãíèòåí, ïîñêîëüêó ýòî ñâîéñòâî ÿâëÿåòñÿ ðåçóëüòàòîì ñîâìåñòíîãî ïîâåäåíèÿ ìàãíèòíûõ àòîìîâ, äåéñòâóþùèõ â óíèñîí. Çäåñü æå àòîìû æåëåçà âõîäÿò â ñîñòàâ î÷åíü áîëüøèõ ìîëåêóë, èç-çà ÷åãî îíè íàõîäÿòñÿ íà çíà÷èòåëüíîì ðàññòîÿíèè äðóã îò äðóãà, ïðè êîòîðîì ñâÿçü ìåæäó àòîìàìè ïðîïàäàåò è îíè ñòàíîâÿòñÿ ìàãíèòíî-íåçàâèñèìûìè.

Ê ñåðåáðÿíîé ìîíåòå, ïîêðûòîé íàëåòîì ñóëüôèäà, ïîäíîñÿò ñíà÷àëà ïðîâîä, ïîäêëþ÷åííûé ê îòðèöàòåëüíîìó êîíòàêòó áàòàðåè, à çàòåì òîò, ÷òî ïîäêëþ÷åí ê ïîëîæèòåëüíîìó. Òàêèì îáðàçîì ìåòàëë ïðîâîäà ñëóæèò âîññòàíîâèòåëåì ñóëüôèäà ñåðåáðà äî ÷èñòîãî ìåòàëëà.
Îáðàçîâàíèå êðèñòàëëîâ îëîâà ïðè ýëåêòðîëèçå ðàñòâîðà õëîðèäà îëîâà â ñåðíîé êèñëîòå

Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïîä ìèêðîñêîïîì

Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïðè íèçêîé êîíöåíòðàöèè õëîðèäà îëîâà è ìàëûõ îáúåìàõ ðàñòâîðà (òàêæå óâåëè÷åíî)

Ðåàêöèÿ îëîâà ñ àçîòíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ ñîëÿíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ öàðñêîé âîäêîé (ñìåñü àçîòíîé è ñîëÿíîé êèñëîòû) ïðîòåêàåò, îäíàêî, áîëåå áóðíî

“Îëîâÿííàÿ ÷óìà” – îñîáîå ñâîéñòâî ýëåìåíòà, êîòîðîå çàêëþ÷àåòñÿ â òîì, ÷òî ïðè òåìïåðàòóðå íèæå 13,2 °C ìåòàëëè÷åñêîå (áåëîå) îëîâî (β-Sn) ïåðåõîäèò â äðóãîå ôàçîâîå ñîñòîÿíèå ñåðîå îëîâî (α-Sn), â êðèñòàëëè÷åñêîé ðåø¸òêå êîòîðîãî àòîìû ðàñïîëàãàþòñÿ ìåíåå ïëîòíî. Ïðîèñõîäèò ýòî ïðî ïðè÷èíå óâåëè÷åíèÿ óäåëüíîãî îáú¸ìà ÷èñòîãî îëîâà íà 25,6 %

Îëîâî èìååò íåáîëüøóþ òåìïåðàòóðó ïëàâëåíèÿ (232 °C) è ëåãêî ïåðåõîäèò â æèäêîå ñîñòîÿíèå ïîä äåéñòâèåì ïëàìåíè ãîðåëêè

Ãîðåíèå ìàëåíüêîãî êóñî÷êà îëîâà (ìîìåíòàëüíîå îêèñëåíèå)

Ïîêàçàòü ïîëíîñòüþ
6

Ðîñò êðèñòàëëîâ ñåðåáðà íà ìåäíîé ïðîâîëîêå (â ðàñòâîðå íèòðàòà ñåðåáðà)

Ðåàêöèÿ ñåðåáðà ñ àçîòíîé êèñëîòîé (ñ âûäåëåíèåì äèîêñèäà àçîòà)

Îáðàçîâàíèå õëîðèäà ñåðåáðà

Ðåàêöèÿ “Ñåðåáðÿíîå çåðêàëî” (â ïðèñóòñòâèè àëüäåãèäîâ èäåò âîññòàíîâëåíèå ìåòàëëà èç àììèà÷íîãî êîìïëåêñà)

Îáðàçîâàíèå ñóëüôèäà ñåðåáðà ïðè äîáàâëåíèè òèîñóëüôàòà

Îáðàçîâàíèå õðîìàòà ñåðåáðà

Âçðûâ îò íàãðåâàíèÿ àöåòèëåíèäà ñåðåáðà
