На каких свойствах кислорода основано его применение
Четыре элемента-«халькогена» (т.е. «рождающих медь») возглавляют главную подгруппу VI группы (по новой классификации – 16-ю группу) периодической системы. Кроме серы, теллура и селена к ним также относится кислород. Давайте подробно разберем свойства этого наиболее распространенного на Земле элемента, а также применение и получение кислорода.
Распространенность элемента
Содержание кислорода в земной коре составляет практически 50%. Он находится в различных минералах в виде оксидов и солей.
В связанном виде кислород входит в химический состав воды – его процентное соотношение составляет порядка 89%, а также в состав клеток всех живых существ – растений и животных.
В воздухе кислород находится в свободном состоянии в виде О2, занимая пятую часть его состава, и в виде озона – О3.
Физические свойства
Кислород О2 представляет собой газ, который не обладает цветом, вкусом и запахом. В воде растворяется слабо. Температура кипения – 183 градуса ниже нуля по Цельсию. В жидком виде кислород имеет голубой цвет, а в твердом виде образует синие кристаллы. Температура плавления кислородных кристаллов составляет 218,7 градуса ниже нуля по Цельсию.
Химические свойства
При нагревании этот элемент реагирует со многими простыми веществами, как металлами, так и неметаллами, образуя при этом так называемые оксиды – соединения элементов с кислородом. Химическая реакция, в которую элементы вступают с кислородом, называется окислением.
Например,
4Na + О2= 2Na2O
S + О2 = SO2
Некоторые из сложных веществ также вступают в реакцию с кислородом, тоже образуя при этом оксиды:
СН4 + 2О2= СО2 + 2Н2О
2СО + О2 = 2СО2
Если какое-либо вещество медленно реагирует с кислородом, то такое окисление называется медленным. Например, это процессы разложения пищевых продуктов, гниение.
Получение кислорода
Этот химический элемент можно получить как в лаборатории, так и на промышленном предприятии.
Получение кислорода в лаборатории проводится несколькими способами:
1. С помощью реакции разложения бертолетовой соли (хлората калия).
2. Через разложение перекиси водорода при нагревании ее в присутствии оксида марганца, выступающего в роли катализатора.
3. Через разложение перманганата калия.
Получение кислорода в промышленности проводится такими способами:
1. Для технических целей кислород получают из воздуха, в котором обычное его содержание составляет порядка 20%, т.е. пятую часть. Для этого воздух сначала сжигают, получая смесь с содержанием жидкого кислорода около 54%, жидкого азота – 44% и жидкого аргона – 2%. Затем эти газы разделяют с помощью процесса перегонки, используя сравнительно небольшой интервал между температурами кипения жидкого кислорода и жидкого азота – минус 183 и минус 198,5 градуса соответственно. Получается, что азот испаряется раньше, чем кислород.
Современная аппаратура обеспечивает получение кислорода любой степени чистоты. Азот, который получается при разделении жидкого воздуха, используется в качестве сырья при синтезе его производных.
2. Электролиз воды также дает кислород очень чистой степени. Этот способ получил распространение в странах с богатыми ресурсами и дешевой электроэнергией.
Применение кислорода
Кислород является основным по значению элементом в жизнедеятельности всей нашей планеты. Этот газ, который содержится в атмосфере, расходуется в процессе дыхания растениями, животными и людьми.
Получение кислорода очень важно для таких сфер деятельности человека, как медицина, сварка и резка металлов, взрывные работы, авиация (для дыхания людей и для работы двигателей), металлургия.
В процессе хозяйственной деятельности человека кислород расходуется в больших количествах – например, при сжигании различных видов топлива: природного газа, метана, угля, древесины. Во всех этих процессах образуется оксид углерода. При этом природа предусмотрела процесс естественного связывания данного соединения с помощью фотосинтеза, который проходит в зеленых растениях под действием солнечного света. В результате этого процесса образуется глюкоза, которую растение потом расходует для строительства своих тканей.
Источник
Кислород – химический элемент VI группы периодической системы Менделеева и самый распространенный элемент в земной коре (47% от ее массы). Кислород является жизненно важным элементом почти всех живых организмов. Более подробно о функциях и применении кислорода в этой статье.

Общие сведения
Кислород представляет собой бесцветный газ без вкуса и запаха, который плохо растворяется в воде. Он входит в состав воды, минералов, горных пород. Свободный кислород образуется благодаря процессам фотосинтеза. Кислород играет наиважнейшую роль в жизни человека. Прежде всего кислород необходим для дыхания живых организмов. Также он принимает участие в процессах разложения погибших животных и растений.
Воздух содержит около 20,95% по объему кислорода. В гидросфере содержится почти 86% по массе кислорода.
Кислород был получен одновременно двумя учеными, но сделали они это независимо друг от друга. Швед К. Шееле получил кислород при прокаливании селитры и других веществ, а англичанин Дж. Пристли – при нагревании оксида ртути.

Рис. 1. Получение кислорода из оксида ртути
Применение кислорода в промышленности
Области применения кислорода обширны.
В металлургии он необходим для производства стали, которую получают из металлолома и чугуна. Во многих металлургических агрегатах для лучшего сжигания топлива используют воздух, обогащенный кислородом.
В авиации кислород используется как окислитель топлива в ракетных двигателях. Также он необходим для полетов в космос и в условиях, где нет атмосферы.
В области машиностроения кислород очень важен для резки и сварки металлов. Чтобы расплавить металл нужна специальная горелка, состоящая из металлических труб. Эти две трубы вставляются друг в друга. Свободное пространство между ними заполняют ацетиленом и зажигают. Кислород же в это время пускают по внутренней трубке. И кислород и ацетилен подаются из баллона под давлением. Образуется пламя, температура в котором достигает 2000 градусов. При такой температуре плавится практически любой металл.

Рис. 2. Ацетиленовая горелка
Применение кислорода в целлюлозно-бумажной промышленности очень важно. Он используется для отбеливания бумаги, при спиртовании, при вымывании лишних компонентов из целлюлозы (делигнификация).
В химической промышленности кислород используется в качестве реагента.
Для создания взрывчатых веществ необходим жидкий кислород. Жидкий кислород производится путем сжижения воздуха и последующего отделения кислорода от азота.
Применение кислорода в природе и жизни человека
Кислород играет наиважнейшую роль в жизни человека и животных. Свободный кислород существует на нашей планете благодаря фотосинтезу. Фотосинтез – это процесс образования органического вещества на свету с помощью углекислого газа и воды. В результате этого процесса образуется кислород, который необходим для жизнедеятельности животных и человека. Животные и человек потребляют кислород постоянно, растения же расходуют кислород только ночью, а днем производят его.
Применение кислорода в медицине
Кислород находит применение и в медицине. Особенно актуально его использование при затрудненном дыхании во время некоторых заболеваний. Он применяется для обогащения дыхательных путей при туберкулезе легких, а также используется в наркозной аппаратуре. Кислород в медицине используется для лечения бронхиальной астмы, болезней желудочно-кишечного тракта. Для этих целей используют кислородные коктейли.
Также большое значение имеют кислородные подушки – прорезиненная емкость, заполненная кислородом. Она служит для индивидуального применения медицинского кислорода.
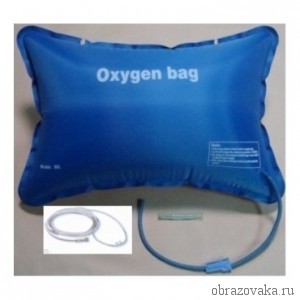
Рис. 3. Кислородная подушка
Что мы узнали?
В данном сообщении, которое охватывает тему «Кислород» по химии 9 класса кратко даны общие сведения о свойствах и применении этого газа. Кислород крайне важен для машиностроения, медицины, металлургической области и т.д.
Тест по теме
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 360.
Источник
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель урока: изучить физические и химические
свойства кислорода, дать общее понятие об
оксидах, реакциях горения; рассмотреть
практическую значимость и применение; доказать,
что кислород – один из важнейших элементов на
Земле.
Задачи урока:
Образовательные:
- Расширить представления обучающихся о
кислороде. - Познакомить со свойствами и применением
кислорода. - Совершенствовать умения составлять уравнения
химических реакций.
Воспитательные:
- Формировать умения работать в парах у каждого
обучающегося, считаться с мнением соседа и
отстаивать свою точку зрения корректно, выполняя
упражнения. - Воспитывать бережное отношение к своему
здоровью, окружающей природе, учить понимать
прекрасное, ценить произведения искусства.
Развивающие:
- Способствовать продолжению развития
устойчивого интереса к химической науке и
практике. - Совершенствовать навыки самостоятельной
работы, развивать умения наблюдать,
формулировать высказывания. - Способствовать развитию исследовательских
навыков, соблюдая правила техники безопасности. - Совершенствовать умения обобщать и делать
выводы.
Планируемые результаты:
- личностные: готовность и способность
учащихся к саморазвитию, самоопределению;
ответственное отношение к учению; способность
ставить цели и строить жизненные планы;
формирование коммуникативной культуры, ценности
здорового и безопасного образа жизни; - метапредметные: уметь ставить цель и
планировать пути её достижения, выбирая более
рациональные способы решения данной проблемы;
учиться корректировать свои действия в связи с
изменением создавшейся ситуации; уметь
создавать, применять и преобразовывать знаки и
символы, модели и схемы для решения учебных и
познавательных задач; уметь осознанно
использовать речевые средства в соответствии с
задачей коммуникации для выражения своих мыслей
и потребностей; уметь организовывать совместную
работу со сверстниками в парах; уметь находить
информацию в различных источниках; владеть
навыками самоконтроля, самооценки; - предметные:
- знать: основные химические понятия
“катализаторы”, “оксиды”, “реакции горения”,
“реакции окисления”; физические и химические
свойства кислорода; области применения
кислорода. - уметь: отличить кислород от других газов;
составлять уравнения реакций горения веществ в
кислороде; записывать химические формулы
оксидов и давать им названия; объяснять, как
происходит круговорот кислорода в природе.
- знать: основные химические понятия
Тип урока: урок формирования умений и навыков.
Форма работы: фронтальная,
групповая,
работа в парах, игровая.
Методы обучения: словесный,
частично-поисковый,
наглядный, демонстрационный, интерактивный.
Приемы обучения: постановка проблемных
вопросов.
Оборудование: компьютер, проектор,
презентация “Свойства и применение кислорода.
Круговорот кислорода в природе”, колбы, пинцет,
ложки для сжигания веществ, спиртовка.
Реактивы: уголь, сера, красный фосфор,
железная пластина, вода, известковая вода.
ХОД УРОКА
І. Организационный момент. (1 мин.)
(Слайд № 1)Учитель: Добрый день! Прошу
всех садиться. Тема сегодняшнего урока
“Свойства и применение кислорода”.
(Слайд № 2) Мы с вами рассмотрим физические и
химические свойства кислорода, сформулируем
общие понятия об оксидах, реакциях горения,
окисления; ознакомимся с практической
значимостью и применением кислорода; а также
докажем, что кислород – один из важнейших
элементов на Земле.
ІІ. Актуализация знаний. (7 мин.).
Работа с карточками. От 2 до 4 обучающихся
получают задание на карточках и выполняют его у
доски.
(Слайд № 3) Фронтальный опрос “А ну-ка,
химики”.
Учитель: Но перед тем как приступить к
изучению новой темы, вам следует ответить на
следующие вопросы:
Химический знак кислорода? Ответ: О
Относительная атомная масса кислорода? Ответ:
16.
Химическая формула кислорода? Ответ: О2.
Относительная молекулярная масса кислорода? Ответ:
32.
В соединениях кислород обычно какой
валентности? Ответ: II.
Расскажите о нахождении кислорода в природе. Ответ:
Кислород — самый распространенный химический
элемент в земной коре. Кислород — самый
распространенный на Земле элемент, на его долю
приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное
количество связанного кислорода — 85,5% (по
массе), в атмосфере содержание свободного
кислорода составляет 21% по объёму и 23% по массе.
Более 1500 соединений земной коры в своем составе
содержат кислород. Кислород входит в состав
многих органических веществ и присутствует во
всех живых клетках. По числу атомов в живых
клетках он составляет 20,9%, по массовой доле —
около 65 %.
Перечислите способы получения кислорода в
лаборатории? Ответ: В лаборатории
кислород получают следующими способами:
1) Разложение перманганата калия. 2KMnO4 =
K2MnO4+MnO2+O2
2) Разложение перекиси водорода. 2H2O2
= 2H2O + O2
3) Разложение бертолетовой соли. 2KClO3 =
2KCl + 3O2
8. Перечислите способы получения кислорода в
промышленности. Ответ: В промышленности
кислород получают:
1) Электролиз воды. 2H2O = 2H2 + O2
2) Из воздуха. ВОЗДУХ давление, -183oC=O2
(голубая жидкость).
В настоящее время в промышленности кислород
получают из воздуха. В лабораториях небольшие
количества кислорода можно получать нагреванием
перманганата калия (марганцовка) KMnO4.
Кислород мало растворим в воде и тяжелее воздуха,
поэтому его можно получать двумя способами:
(Слайд № 4). 9. Установите соответствие
между способом получения кислорода и уравнением
химической реакцией. Работа в парах.
| Способы получения кислорода | Уравнения химических реакций |
| А. Разложение перманганата калия. Б. В. Разложение бертолетовой соли. Г. Электролиз воды. Д. Из воздуха. | 1) 2KClO3 = 2KCl + 3O2 2) 2H2O2 = 2H2O + O2 3) ВОЗДУХ = O2 4) 2KMnO4 = K2MnO4 + MnO2 + O2 5) 2H2O = 2H2 + O2 |
Ответ: А-4; Б-2; В-1; Г-5; Д-3.
10. Что называют катализаторами? Где эти
вещества применяются? Ответ: Вещества,
которые ускоряют химические реакции, но сами при
этом не расходуются, называют катализаторами.
Катализаторы широко применяют в химической
промышленности. С их помощью удается повысить
производительность химических процессов,
снизить себестоимость выпускаемой продукции и
более полно использовать сырье.
(Слайд № 5). На какой диаграмме распределение
массовых долей элементов отвечает
количественному составу (NH4)3PO4? Ответ:
4.
ІІІ. Изучение нового материала. (12 мин.)
(Слайд № 6) Учитель: Физические свойства. Кислород
– бесцветный газ, без вкуса и запаха, относительно
малорастворим в воде (в 100 объемах воды при
температуре 20?С растворяется 3,1 объема
кислорода). Кислород немного тяжелее воздуха: 1л
кислорода при нормальных условиях весит 1,43 г, а 1л
воздуха — 1,29г. (Нормальные условия – сокращенно:
н.у. – температура 0oС и давление 760 мм.рт.ст.,
или 1 атм. 0,1 МПа). При
давлении 760 мм.рт.ст. и температуре -183oС
кислород сжижается, а при снижении температуры
до -218,8oС затвердевает.
(Слайд № 7) Химические свойства. Техника
безопасности (провести инструктаж!)
Кислород при нагревании энергично реагирует
со многими веществами, при этом выделяются
теплота и свет. Такие реакции называют реакциями
горения. Если опустить в сосуд с кислородом O2
тлеющий уголек, то он раскаляется добела и
сгорает, образуя оксид углерода (IV) СO2.
Чтобы определить, какое образовалось вещество, в
сосуд наливают известковую воду — раствор
гидроксида кальция Са(ОН)2. Она мутнеет, так
как при этом образуется нерастворимый карбонат
кальция СаСO3:
CO2 + Ca(OH)2 = CaCO3 + H2O
Видеодемонстрация №1 “Горение угля в
кислороде”
https://files.school-collection.edu.ru/dlrstore/695aa82a-e84a-fa4d-7b04-16d28ded2fbb/index.htm
(Слайд № 8) Сера горит в O2 ярким синим
пламенем с образованием газа с резким запахом —
оксида серы (IV)
S + O2 = SO2
Видеодемонтсрация №2 “Горение серы в
кислороде”
https://files.school-collection.edu.ru/dlrstore/600cd365-f9f2-ae10-56e4-98ee0af7e4c6/index.htm
(Слайд № 9) Горение фосфора в кислороде
Видеодемонстрация №3 “Горение фосфора в
кислороде”
https://files.school-collection.edu.ru/dlrstore/f83beda5-449d-d3dc-442c-a474a89eeca6/index.htm
Опыт следует проводить под тягой. Следует
соблюдать правила обращения с нагревательными
приборами. Не допускать попадания горящего
фосфора на рабочую поверхность стола. Не вдыхать
выделяющийся дым фосфорного ангидрида.
Фосфор Р сгорает в O2 ярким пламенем с
образованием белого дыма, состоящего из твердых
частиц оксида фосфора (V).
4P + 5O2 = 2P2O5
(Слайд № 10) Горение железа в кислороде
Видеодемонстрация №4 “Горение железа в
кислороде”
https://files.school-collection.edu.ru/dlrstore/deb6e939-f8c8-fea7-fe24-7b2c80013fd7/index.htm
В кислороде горят и такие вещества, которые
обычно считают негорючими, например железо. Если
к тонкой стальной проволоке прикрепить спичку,
зажечь ее и опустить в сосуд с кислородом, то от
спички загорится и железо. Горение железа
происходит с треском и разбрасыванием ярких
раскаленных искр — расплавленных капель
железной окалины Fe3O4. В этом соединении два атома
железа трехвалентны и один двухвалентен. Поэтому
реакцию горения железа в кислороде можно
выразить следующим уравнением:
3Fe + 2O2 = FeO * Fe2O3 или Fe3O4
(Слайд № 11) Взаимодействие вещества с
кислородом относится к реакциям окисления.
(Слайд № 12) Горение — это химическая реакция,
при которой происходит окисление веществ с
выделением теплоты и света.
(Слайд № 13) В большинстве случаев при
взаимодействии веществ с кислородом образуются
оксиды.Оксиды — это сложные вещества,
которые состоят из двух элементов, одним из
которых является кислород.
(Слайд № 14) Известны химические элементы,
которые непосредственно с кислородом не
соединяются. К ним относятся золото Au и некоторые
другие. Оксиды этих элементов получают косвенным
путем.
(Слайд № 15) Применение кислорода. Основано
на его химических свойствах. В больших
количествах кислород используют для ускорения
химических реакций в разных отраслях химической
промышленности и в металлургии. Например, при
выплавке чугуна для повышения
производительности доменных печей в них подают
воздух, обогащенный кислородом.
(Слайд № 16) При сжигании смеси ацетилена или
водорода с кислородом в специальных горелках
температура пламени достигает 3000oС. Такое
пламя используется для сварки металлов. Если
берут кислород в избытке, то пламенем можно
резать металл.
(Слайд № 17) Жидкий кислород применяют в
ракетных двигателях.
(Слайд № 18) В медицине кислород служит для
облегчения затрудненного дыхания. В этом случае
кислородом заполняют специальные подушки.
Кислородные маски необходимы в высотных полетах,
в космосе и при работе под водой.
Кислород расходуется в громадных количествах
на многие химические реакции, например на
сжигание топлива.
(Слайд № 19) Из сказанного видно, что очень
много кислорода расходуется на разнообразную
деятельность человека, тратится на процессы
дыхания человека, животных, растений, а также на
процессы гниения. Человек при дыхании в течение 1
мин в среднем употребляет 0,5 дм3 кислорода,
в течении суток — 720 дм3, а в год — 262,8 м3
кислорода, что все жители земного шара (5
миллиардов) в течение года для дыхания
используют 1578 миллиардов кубических метров
кислорода. Если такой объем кислорода при
нормальном давлении поместить в железнодорожные
цистерны, то поезд был бы протяженностью более 300
млн км, что равняется расстоянию до Солнца и
обратно.
(Слайд № 20) Но все же общая масса кислорода в
воздухе заметно не изменяется. Это объясняется
процессом фотосинтеза, происходящим в зеленых
растениях на свету. В результате этого процесса
выделяется кислород. С фотосинтезом вы уже
знакомились в курсе ботаники. Упрощенно процесс
фотосинтеза изображают так:
6CO2 + 6H2O = C6H12O6
+ 6O2.
Так в природе происходит непрерывный
круговорот кислорода.
В целях сохранения кислорода в воздухе вокруг
городов и крупных промышленных центров
создаются зоны зеленых насаждений. Специальная
служба систематически контролирует содержание
кислорода в воздухе. При необходимости применяют
меры по устранению загрязнения воздуха.
Физкультминутка. (1 мин.)
IV. Закрепление знаний. (6 мин.)
(Слайд № 21) Задание №1. “Правда или ложь? Если
знаешь – разберешь”
Для кислорода верны следующие утверждения:
а) Кислород – бесцветный газ, без вкуса и
запаха.
б) Кислород немного легче воздуха.
в) В кислороде горят и такие вещества, которые
обычно считают негорючими, например железо.
г) Известны химические элементы, которые
непосредственно с кислородом соединяются. К ним
относятся золото Au и некоторые другие.
д) Применение кислорода основано на его
физических свойствах.
е) Непрерывный круговорот кислорода
непосредственно связан с таким процессом, как
фотосинтез.
Ответ: а; в; е.
(Слайд № 22) Задание №2. “Скорая помощь”
Вставьте пропущенные вещества в уравнениях
реакций:
а) …….. + Ca(OH)2 = CaCO3 + H2O
б) S + ……. = SO2
в) ….. + 2O2 = FeO * Fe2O3 или Fe3O4
Ответ: а)CO2 б)O2 в) 3Fe
(Слайд № 23) Задание №3. “Мозговой штурм”
Расставьте коэффициенты в уравнениях реакций.
а) CO2 + H2O = C6H12O6 + O2
б) P + O2 = P2O5
(Слайды № 24-25) Задание №4. “Ассоциации”
С каким применением кислорода ассоциируется
данное изображение?
1) в металлургии;
2) для резки металлов;
3) в авиации для дыхания;
4) в авиации для двигателей;
5) для сварки металлов;
6) на взрывных работах;
7) в медицине.
(Слайд № 26) V. Домашнее задание. (1 мин.)
Параграф 20, 21; №6-9 (с.60). Решите задачи 1-2 (с.60).
Творческое задание: подготовить сообщение
№10 с. 60 “Что делается в вашей местности для
поддержания определенного содержания кислорода
в воздухе? В чем может заключаться ваше участие в
этой деятельности?”
(Слайд № 27) VI. Рефлексия. (1 мин.)
Учитель:
- Сегодня я узнал…
- было трудно…
- я понял, что…
- я научился…
- я смог…
- было интересно узнать, что…
- меня удивило…
- мне захотелось…
VII. Подведение итогов урока. (1 мин.)
(Слайд № 28)
В чём горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без….
Обучающиеся: кислорода
(Слайд № 29) Учитель: Правильно. Спасибо за
урок! До свидания!
Литература
[1] Горковенко М. Ю. Поурочные разработки по
химии 8 класс к учебникам О. С. Габриеляна, Л. С.
Гузея, Г. Е. Рудзитиса. – М: “ВАКО”, 2004;
[2] Радецкий А. М., Горшкова В. П. Дидактический
материал: химия 8-9 классы — М: Просвещение, 1997.
[3] Химия: неорганическая химия: учебник для 8
класса общеобразовательных учреждений/ Г. Е.
Рудзитис, Ф.Г. Фельдман. – М: “Просвещение”, 2014 г.
Интернет-ресурсы
- https://files.school-collection.edu.ru/
- https://www.e-osnova.ru/
Источник
