На каких свойствах основано применение предельных углеводородов

Повсеместное применение предельных углеводородов началось ровно с того момента, как люди открыли нефтегазовые месторождения. Конечно, метан и другие углеводороды были известны человечеству до этого. Но это были скорее лабораторные исследования, и здесь не приходится говорить о каком-то промышленном использовании. Например, еще в 1813 году химик Гемфри Дэви по итогу проведенных им анализов заключил, что рудничный газ есть смесь метана с небольшим количеством азота и углекислого газа. Такой же состав можно обнаружить и в воздухе над болотом.
Если мы говорим о природном газе, то большая часть его представлена предельными углеводородами. Остальное – это непредельные углеводороды (алкены, алкины, циклоалканы) и следовые количества других газообразных веществ, не являющихся углеводородами: углекислый газ, водород, азот, сероводород, гелий и другие инертные газы.
Получение предельных углеводородов
На данный момент существует физические и химические способы получения.
В основе физических лежат свойства газов, обусловленные строением молекул, а также свойства веществ, которые способны поглощать нужные газы из смеси.
Химические методы ориентированы на разложение сложных соединений до простых путем катализа при повышенных температуре и давлении. Также в эту группу входят химические реакции, преимуществом которых является получение вещества с определенным строением.
А теперь обо всем подробнее.
Физические способы
Основные физические константы, такие как температура кипения, плавления, замерзания, молекулярная масса и тому подобное определяется молекулярным строением вещества и пространственным расположением групп атомов относительно друг друга.
Эти свойства используются для разделения газов путем охлаждения при повышенном давлении до жидкого состояния. Зная температуру кипения выделяемого газа, можно нагреть смесь таким образом, что в газообразное состояние перейдет только нужное нам соединение. После этого его можно откачать в отдельную емкость, либо поглотить адсорбентом (адсорбенты – это природные или искусственные пористые материалы с большой площадью поверхности, на которой происходит избирательное оседание нужных веществ, находящихся в смеси с другими соединениями). После поглощения проводят операцию десорбции – очищения адсорбента от выделенного газа.
Чтобы понять, насколько легко разделить смесь газов этим способом, необходимо просто сравнить температуры кипения метана и этана (–161,58°С и −88,6°C соответственно). Разница очевидна, хотя в молекуле метана один атом углерода, а у этана – два.
Химические способы
В промышленных масштабах широко используют крекинг – термическое разложение длинных и разветвленных алканов до коротких с использованием катализаторов. Так получают смесь предельных и непредельных соединений, которую потом разделяют и применяют для конечных целей.
Лабораторные способы
В лабораторных условиях, когда надо получить небольшое количество газа для дальнейших синтезов, прибегают к следующим методам.
Гидролиз карбида алюминия
Гидролиз
Это разложение веществ водой.
В данном случае происходит реакция обмена между карбидом алюминия и водой, в результате чего образуется метан и гидроксид алюминия. Уравнение реакции приведено ниже:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Реакция Кольбе
Реакция Кольбе
Электрохимическая реакция получения алканов из одноосновных карбоновых кислот или их солей. Происходит по уравнению
2RCOO– = 2CO2 + R-R + 2e–
Если использовать одну предельную одноосновную кислоту и ее соль, то можно получить строго один углеводород, да еще и симметричный. Если же мы используем разные кислоты, то в результате получим смесь продуктов разнообразного строения.
Гидрирование непредельных соединений
Очень простой метод ввиду результата реакции – предельного углеводорода. Берем, к примеру, алкен/алкин/ароматическое соединение и присоединяем к нему водород при повышенной температуре, давлении да и на никелевом катализаторе. При этом происходит насыщение кратной связи до одинарной.
Таким же образом можно провести гидрирование циклоалкана. При этом происходит раскрытие цикла и присоединение по одному атому водорода к концам молекулы.
C6H12 + H2 = C6H14
Получение из галогеналканов
Одной из важнейших синтетических реакций получения предельных углеводородов является действие натрия на галоидные алкилы, в результате которой происходит отщепление галогена от углеводородного радикала и сшивка двух алкилов в молекулу углеводорода. Данная реакция также имеет название «синтез Вюрца», ее уравнение далее:
2CH3–I + 2Na = CH3–CH3 + 2NaI
Смотря на данную реакцию, мы понимаем, что из йодистого метила при действии натрия можно получить этан.
Взаимодействие гидроксида натрия и натриевой соли предельной одноосновной карбоновой кислоты.
В результате реакции происходит образование карбоната натрия и предельного углеводорода (в нашем случае это метан). Уравнение реакции приведено ниже:
CH3–COONa + NaOH = CH4 + Na2CO3
Сейчас были описаны основные способы получения предельных углеводородов. Конечно, существуют и другие, более экзотические, но об этом мы поговорим в другой статье. А сейчас предлагаю перейти к применению предельных углеводородов.
Применение предельных углеводородов
Предельными углеводородами просто «кишит» природный газ – их там от 70 до 98 процентов, в зависимости от месторождения. На данный момент это самый экологически чистый вид топлива, так как содержащиеся в нем вещества при сгорании окисляются до углекислого газа и воды с выделением большого количества тепла. Последнее используется в газовых плитах на кухне, тепловых электростанциях для нагрева воды и получения электроэнергии.
Широко распространенные бензин, керосин, жидкость для розжига костров – это тоже алканы, которые сгорают в двигателях внутреннего сгорания, давая человеку возможность передвигаться на большие расстояния без затраты мышечной энергии.
Также известно применение предельных углеводородов в качестве растворителей: при отжиме льняного масла из одноименных семян используют гексан, трудно очищающуюся краску в народе удаляют с помощью бензина. Это свойство активно используют при изготовлении различных олиф, красок и пропиток (на основе уайт-спирита).
Окисляя высшие алканы с числом атомов углерода 20-25, можно получить синтетические жирные кислоты для производства моющих средств, смазочных материалов, лаков и эмалей.
Отдельно хочется выделить парафин (смесь твердых углеводородов С19-С35), который применяют при изготовлении свечей, пропитки спичек и упаковочной бумаги, для тепловых процедур в медицине.
Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладагенты и сырье для дальнейших синтезов.
Источник
Сначала рассмотрим предельные углеводороды, особенности их строения, свойства, области применения.
Общие сведения об алканах
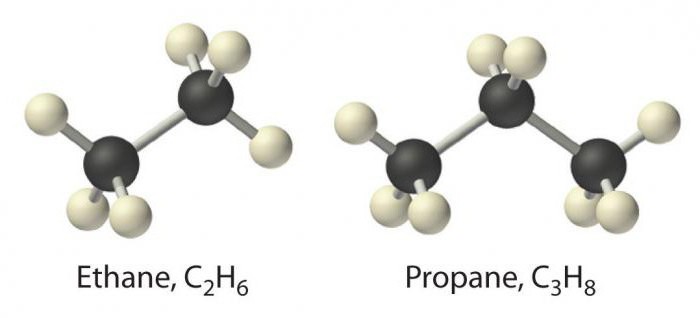
К данному классу относятся соединения, которые отвечают общей формуле CnH2n+2. Их молекулы являются линейными, для них характерна только простая связь.
Предельные углеводороды представлены гомологическим рядом метана. Между атомами углерода в их молекулах sp3 гибридизация, для которой характерен угол 109 градусов.
Нахождение в природе
Предельные углеводороды достаточно широко распространены в природе. Например, метан, возглавляющий данный класс СхНу, образуется при разложении животных и растительных организмов в болотистых местах (без доступа воздуха).
Кроме того, это соединение присутствует в угольных шахтах, что часто приводит к серьезным взрывам и гибели шахтеров.
Предельные углеводороды в большом количестве содержатся в твердом, жидком, а также газообразном виде в нефти. Помимо метана в нефти есть пропан, этан, бутан, пентан.
Физические свойства алканов
Данные вещества малорастворимы в воде. Низшие представители ряда являются газами. С увеличением относительной молекулярной массы соединений наблюдается повышение температур кипения и плавления, происходит переход от газообразного состояния к жидкостям, твердым веществам.

Химические свойства
Рассмотрим основные химические свойства предельных углеводородов. Из-за небольшой полярности связи С-С они являются химически малоактивными соединениями.
Среди характерных свойств представителей данного класса отметим радикальное галогенирование. В результате взаимодействия на первой стадии образуется моногалогенпроизводное соединение, а также галогеноводород. Учитывая, что у реакции цепной механизм, замещение продолжается до тех пор, пока вместо водородов не появятся атомы галогена.
Помимо галогенирования, предельные углеводороды вступают во взаимодействие с азотной кислотой. Нитрование приводит к образованию нитроалканов.
Сульфирование связано с замещением атома водорода сульфо-группой, среди продуктов реакции будет алкансульфокислота и вода. Процесс осуществляется при небольшом нагревании реакционной смеси, серная кислота берется в концентрированном виде.
При нормальных условиях алканы демонстрируют стойкость к таким сильным окислителям, как перманганат калия, бихромат калия.
При повышении температуры наблюдается их окисление кислородом воздуха до оксида углерода (4) и водяного пара.
Неполное (каталитическое) окисление приводит к образованию кетонов, альдегидов, карбоновых кислот.
При разрыве связей С-С происходит крекинг, в результате которого из длинной углеродной цепочки формируются соединения с меньшим количеством углеродных атомов.
Среди продуктов дегидрирования непредельные углеводороды и молекулы водорода, происходит реакция при высоких температурах.
При дегироциклизации образуются ароматические углеводороды, которые имеют практическое применение.
Ненасыщенные СхНу
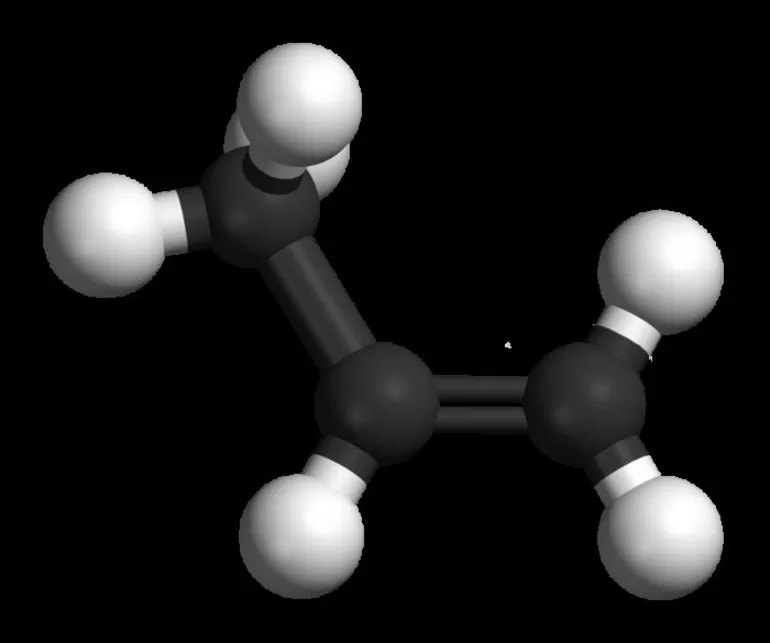
Предельные и непредельные углеводороды могут иметь циклическое или алифатическое строение. Например, алкены, имеющие общую формулу CnH2n, отличаются наличием двойных связей между углеродными атомами.
Именно поэтому для представителей ряда этилена характерны реакции присоединения по двойной связи. Гидрогалогенирование и гидратация осуществляются для несимметричных алкенов по правилу Марковникова. Суть его в том, что при присоединении по двойной связи галогеноводорода или воды атомы галогена или гидроксогруппы присоединяются тому углероду, которые имеет меньшее число Н, а водород идет к первому атому С.
Кроме того, для представителей данного класса органических соединений характерна реакция полимеризации. Она нашла широкое применение в современной химической промышленности. Например, для производства полиэтилена, который востребован в сельском хозяйстве, медицине, в качестве исходного мономера берут этилен. При каталитическом процессе полимеризации наблюдается разрыв двойной связи, в итоге образуется полимерное соединение.
Качественной реакцией на непредельность (присутствие в молекулах двойных и тройных связей) является обесцвечивание бромной (йодной) воды, а также обесцвечивание раствора перманганата калия.
Среди циклических углеводородов, которые в настоящее время нашли широкое применение, следует упомянуть бензол и толуол. Эти СхНу являются типичными представителями ряда ароматических углеводородов, которые имеют общую формулу CnH2n-6.
Бензол, в котором электронная плотность размещается равномерно, считается малоактивным соединением. Большей реакционной способностью обладает толуол, используемый для промышленного производства бензойной кислоты, являющейся отличным консервантом.

Заключение
В органической химии выделяют несколько классов углеводородов, отличающихся между собой по расположению углеродных атомов, наличию одинарных и двойных (тройных) связей. Несмотря на существенные отличия в строении, физических и химических свойствах, все они востребованы в различных сферах промышленности. Среди предельных углеводородов особый интерес вызывает метан, а также его ближайшие гомологи.
Среди диеновых соединений лидирующие показатели при производстве полимерных материалов демонстрируют бутадиен-1,3 и 2метилбутадиен-1,3. Особый интерес вызывают ароматические углеводороды. Именно они являются основой для производства органических красителей, консервантов.
Источник
Автор Маргарита Малиновская На чтение 3 мин. Опубликовано 26.03.2020
Алканы (предельные или насыщенные углеводороды) широко применяются в различных сферах жизни человека. Они применяются в качестве топлива, используются в медицине и косметологии, на их основе изготавливают растворители, используют при производстве асфальта и пластмасс. Рассмотрим кратко области применения алканов в различных отраслях производства.
Общие сведения
Алканы — класс предельных (насыщенных) углеводородов. Общая формула — СnH2n+2, где n — число атомов углерода. Самым известным простым представителем является метан.
Алкана в природе находятся в трёх агрегатных состояниях:
- Газообразные вещества. Это соединения от C до С4 (метан, этан, пропан, бутан).
- Жидкие от С5 до С17 (пентан-гептадекан).
- Твёрдые с С18 (октадекан и далее).
Насыщенные углеводороды в твёрдом и газообразном виде не имеют запаха, жидкие обладают характерным запахом бензина.
Предельные углеводороды не растворяются в воде, но хорошо растворимы в органических растворителях. Прекрасно соединяются друг с другом.
Получение алканов
Основным источником для синтеза насыщенных углеводородов являются природные ресурсы. Они являются главными компонентами природных ископаемых: нефть, природный газ, каменный уголь. Получают их двумя способами:

- Промышленным.
- Лабораторным.
При промышленном способе получения алканы выделяют из природных запасов, которые считаются неиссякаемыми. Нахождением и разработкой месторождений занимаются геологи.
Природный газ на 71—98% состоит из метана. В нём также в незначительном количестве имеются этан, пропан, бутан, пентан, азот и другие газы. Ввиду особого состава природный газ не имеет запаха и становится чрезвычайно горючим при соединении с воздухом.
Предельные углеводороды присутствуют в составе нефти во всех агрегатных состояниях. Содержание их составляет от 40 до 70%. Основную долю продукта составляют углеводороды в жидком состоянии. Далее — в твёрдом. И меньше всего в газообразном состоянии.

Предельные углеводороды находятся в составе озокерита. При его переработке получают церезин.
Насыщенные углеводороды также получают при переработке каменного угля.
При получении предельных углеводородов применяют и лабораторный метод.
К нему можно отнести:
- Гидрирование алкинов и алкенов.
- Восстановление галогеналканов.
- Соединение галогеналканов.
Ввиду неограниченного количества запасов природных источников, в состав которых входят предельные углеводороды, промышленный способ является наиболее выгодным для получения алканов.
Область применения
Сфера применения насыщенных углеводородов обширна. Начиная от горючих материалов и закачивая использованием в медицине и косметологии. Главное применение, в составе природного газа получили в народном хозяйстве, в качестве горючего топлива в газовых печках и котлах. В таблице перечислены области применения алканов:

| Метан | Используется для получения алкинов (ацетилена), хлороформа, синильной кислоты и синтез-газа. |
| Алканы в газообразном состоянии | Применяются как высококалорийное топливо. |
| Алканы в жидком состоянии | Находят применение как растворитель для моторного и ракетного топлива. |
| Вазелин | Используется для приготовления мазей и кремов в медицине и косметологии. |
| Вазелиновое масло | Применяется в медицине, парфюмерии и косметологии. |
| Парафин | Используется для создания свечей, пропитки спичек и обёрточной бумаги, для прогревания в медицине. |
| Гудрон | Применяется при строительстве и укладки асфальтовых дорог. |
| Нефтяные продукты | Используются при выпуске синтетических волокон, пластмасс, моющих средств и каучука. |
Алканы применяются и при тушении пожаров. Пропан и бутан в сжиженном виде используют в качестве заправки для баллонов.
Церезин широко применяется при производстве вазелина и крема для сапог, лекарственных мазей, сургуча, чернил для типографии, при изготовлении свечей, в качестве материала для изоляции в радио- и электротехнике.
В отечественных школах изучение темы алканов проходит в 10-м классе на уроках химии. На уроках подробно изучается строение, состав, химические и физические свойства, способы получения и области использования предельных углеводородов.
И также составляются конспекты, которые в дальнейшем могут помочь при подготовке к экзамену.
Источник
Общая классификация
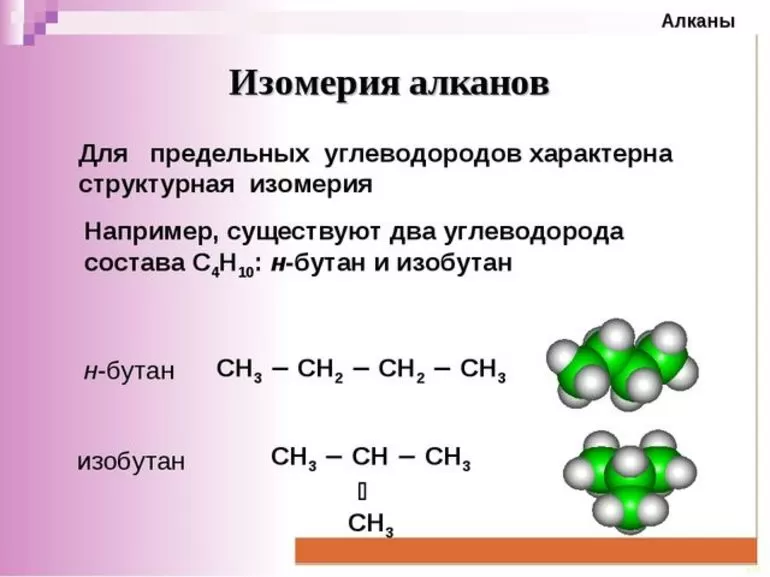
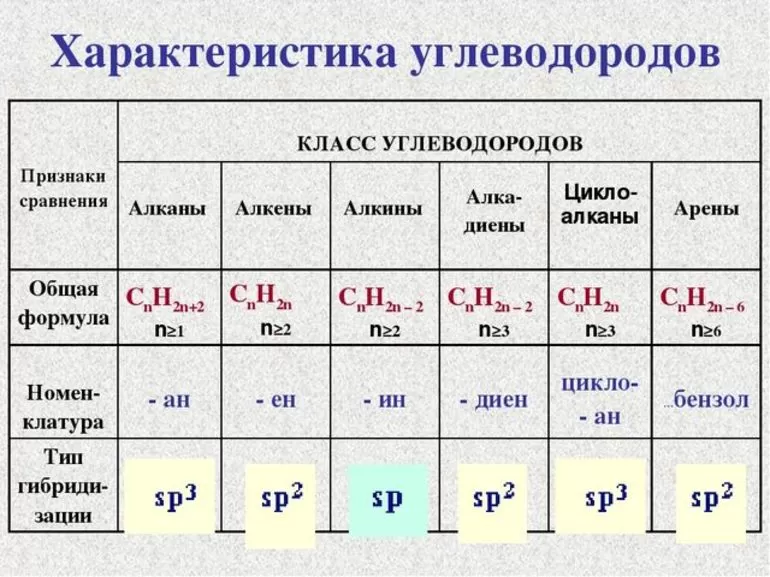
Общая формула предельных углеводородов — CnH2n+2. Если водород образует всего 1 связь, то у углерода их целых 4. Но это не свидетельствует о том, что между ними имеет место соотношение 1 к 4. Существуют не только одинарные, но и двойные, тройные связи между атомами углерода. По такому показателю выделяют классы углеводородов:
- Предельные. Их ещё называют алканами.
- Непредельные, или ненасыщенные алкены и алкины, соответственно, 2 и 3 связи.
Другая классификация относится к характеристикам молекул. В соответствии с ней выделяют углеводороды:
- алифатические;
- карбоциклические.
В первом случае вещества имеют линейную структуру, тогда как во втором они сформированы в виде замкнутой цепи. Карбоциклические подразделяются на ароматические и алициклические. Какие виды изомерии наблюдаются у предельных углеводородов:
- углеродного скелета;
- расположения кратной связи;
- так называемая геометрическая;
- межклассовая.
В отношении углеводородов имеет место и процесс полимеризации. Это ситуация, когда одинаковые молекулы соединяются. В итоге формируется материал, который совершенно не похож на базовый. Классический пример — полиэтилен. Для его получения используется стандартный этилен. Такое возможно, если приходится говорить о ненасыщенных углеводородах.
Отдельную категорию составляют структуры, относящиеся к непредельным. Новые атомы, непохожие на атомы водорода, притягивают новые атомы, пользуясь для этого свободными радикалами. В итоге формируются различные виды органических веществ. К ним можно отнести:
- эфиры;
- амины;
- спирты.
Наглядные примеры
Углеводороды объединяют обширный список веществ. Их рассматривают в школе на уроках химии за 9 класс. Для нахождения формулы этих соединений составляются специальные уравнения. Несмотря на довольно большую классификацию, следует обозначить основные классы и соединения, относящиеся к ним. Вот их названия:
- Предельные. К ним относят гексан, бутан, пропан, метан. В таблице предельных углеводородов представлено очень много веществ, и их список гораздо больше. В большинстве случаев приходится говорить о наиболее распространенных газах.
- Алкены, или как их еще называют, олефины объединяют бутен, пропилен, этилен.
- Алкины включают гексен, пентин, ацетилен.
- Алкадиены и алкадиины. Им соответствуют вещества с двойной и тройной связью, соответственно.
- Циклоалканы представляет собой разновидность углеводородов, у которых цепь имеет замкнутый вид.
Ко второму классу причисляют циклопентен и циклопропен. Существуют циклоалкины, которые не встречаются в естественных условиях. Учёные с давних пор пытаются создавать их искусственным путем. Достигнуть цели удалось только в начале прошлого века. В составе молекул циклоалканов присутствует от 8 атомов углерода. Если их будет меньше, соединение будет отличаться нестабильностью. Объясняется это значительным напряжением.
Ароматические углеводороды включают довольно простые соединения наподобие бензола. Также в эту категорию включены индол и нафталин.
Ключевые параметры
Углеводороды способны объединять большое количество различных соединений. Но если говорить об основных характеристиках, приходится отметить, что общего у них почти нет. Единственное, в чём они сходятся, это состав. Строение всегда отличное. Примечательным является их переход от газообразной формы к твёрдой. Они также могут переходить к нему из жидкого состояния. Происходит это сообразно увеличению числа атомов углерода в начале ряда. Другое сходство, которое можно обнаружить, это способность к горению. Одновременно с этим выделяется большое количество тепла, когда образуются вода и углекислый газ.
Структурные особенности
Алканы являются гомологами метана, то есть его производными. Молекулярная формула этого вещества записывается, как CH4. В случае если отнять от него атом водорода, удастся получить радикал (углеводородный остаток) CH3. В большинстве случаев в молекуле присутствует 4-валентный углерод. Соответственно, объединение двух радикалов приводит к формированию дополнительного представителя ряда гомологов этана C2H6. После отщепления атома гидрогена образуется радикал — этил. При объединении его с CH3 удается получить еще один гомолог — пропан.
Рассматривая структуру пропана, можно установить, что его основу составляет 2 разновидности атомов углерода. Это первичные и вторичные соединения. Любой первичный атом имеет связь с 1 атомом углерода. Если атом гидрогена отщепить от первичного атома пропана, будет сформирован первичный пропил. Объединение метила со вторичным пропилом способствует образованию различных вариантов других гомологов. Это может быть изобутан, имеющий широкую ветвь углеродной цепи либо стандартный бутан, у которого карбоновая цепь является прямой.
Метан представляет собой наиболее типичный вариант алканов. Так называемая сигма-связь характерна для этих соединений. Допустим, у метана присутствует 4 ковалентные связи. Отвечает за это 3 p- и 1 s-орбиталь. Атом углерода образует такие связи благодаря s-орбитали.
Изомерия и номенклатура
Чтобы определить формулы гомологов, в том числе бутана с его формулой C4H10, необходимо изучить явление изомерии. Что касается бутана, то за стабильность его формулы отвечают два различных соединения, тогда как в отношении формулы C5H12 их 3. Число изомеров постепенно увеличивается по мере повышения числа атомов углерода в молекулах алкана. 5 структурных формул, соответственно, присутствует в формуле C6H14. Если первые четыре соединения являются газами, то с 5 по 12 представлены жидкости. Вещества с 16 и далее имеют твердую структуру.
Химические свойства

Предельные углеводороды причисляются к группе инертных веществ. Это можно объяснить сигма-связью атома водорода и углерода в алканах. Вот почему они не способны притягивать к себе атомы водорода. Вещества могут вступать в реакции расщепления, дегидрирования, нитрирования. Также они принимают участие в процессе радикального галогенирования. В последнем случае молекулы галогенов с лёгкостью могут замещать таковые у гидрогена в составе алкана. Процесс нитрования приводит к тому, что водород во вторичных и третичных соединениях замещается нитрогруппой.
Несколько сложнее этот процесс проходит в случае с первичными и вторичными атомами.
Предельные углеводороды используются в производстве органических веществ различных видов. Непредельные получаются после отсоединения атома водорода от них.
Естественные источники
Помимо синтетических соединений, встречаются и природные источники углеводородов. Они присутствуют в почве в виде залежей. Большую часть нефти и газа составляют именно углеводороды. При обработке нефти это хорошо прослеживается. Во время такого процесса отмечается выделение большого количества веществ, относящихся к углеводородам. В составе газа и вовсе присутствует до 97% метана. Это вещество формируется при разложении органических отходов. Соответственно, чтобы получить его, не приходится прикладывать значительных усилий.
Получить углеводороды можно и в условиях лаборатории. Есть соединения, которые невозможно увидеть в природе. Их добывают синтетическим путем, проводя специальные химические реакции.
Ароматические соединения
Это отдельный гомологический ряд, который имеет формулу СпН2п-6. Такие углеводороды способны вступать практически в любые реакции присоединения: галогенирование, гибридизация и т. д. Многочисленные эксперименты, проведённые в их отношении, показали небольшую химическую активность бензола — классического представителя этой категории. Он демонстрирует увеличение стойкости к окислению. Присоединение становится возможным для него при доступе к ультрафиолетовым лучам. Пребывание в ср2-гибридном состоянии является характерной особенностью бензола. Углеродные атомы находятся в единой плоскости.
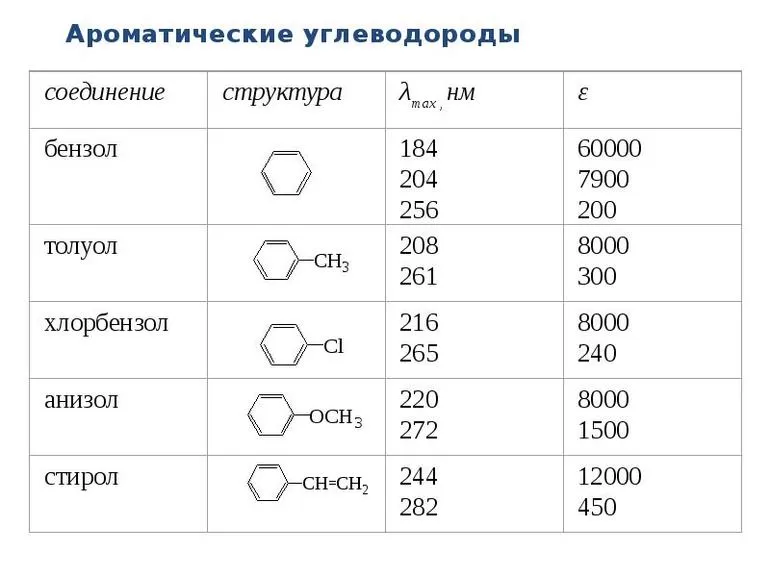
Выделяют чётные и нечётные представителей этого класса. Их нумерация идёт по часовой стрелке, когда выделяют наиболее старших и наиболее младших заместителей. Четные варианты — 2 и 6 обозначают как ортоположения, 3 и 5, то есть нечетное, это метаварианты.
В большинстве случаев это жидкости, обладающие неприятным запахом и запрещённые к использованию без специализированной защиты. Они недостаточно хорошо растворяются в воде, но хорошо реагируют на органические растворители. Мало реагируют они и на кислоты. В смесях с добавлением соли одноосновных кислот органического происхождения вещества распадаются на ионы.
Бензол и другие ароматические углеводороды получают в промышленных условиях. Примером является каменноугольная смола. Ее и другие вещества аналогичного класса получают:
- через отщепление атома водорода от циклопарафинов;
- посредством ароматизации алканов.
Сфера применения
Углеводороды очень важны для полноценного ведения деятельности человека. Применение предельных углеводородов разнообразно. Наиболее ценными ресурсами считаются газ и нефть. Они применяются в качестве энергоносителей и топлива. Но это далеко не полный список всех способов применения веществ этого класса. Углеводороды окружают человека практически всюду. Посредством полимеризации удаётся формировать новые вещества, служащие основой для различных типов тканей, пластмасс. Также необходимо выделить в особую категорию бензин, прочие продукты нефтепереработки, а также лакокрасочные изделия, асфальт, керосин.
Современное общество не может обойтись как без предельных, так и непредельных углеводородов. Несмотря на то что запасы нефти уменьшаются с каждым годом, отказаться от их применения по-прежнему невозможно. Правда, ученые активно занимаются поисками альтернативных источников углеводородов. С другой стороны, той же универсальности применения и эффективности не смог показать ни один из них.
Источник
