На каких свойствах основано применение водорода

 Водород при обыкновенной температуре — бесцветный газ, не имеющий запаха. При температуре ниже минус 240° водород под давлением может быть превращен в бесцветную жидкость.
Водород при обыкновенной температуре — бесцветный газ, не имеющий запаха. При температуре ниже минус 240° водород под давлением может быть превращен в бесцветную жидкость.
Если быстро испарять эту жидкость, то получается твердый водород в виде прозрачных кристаллов, плавящихся при минус 259,4°.
Водород самый легкий из всех газов, он почти в 141/2 раз легче воздуха. Литр водорода при нормальных условиях весит только 0,09 г.
В воде водород растворим очень мало, но растворяется взначительном количестве внекоторых металлах, например впалладии, платине и др. Один объем палладия может растворить до 900объемов водорода.
Рис. Схема строения молекулы водорода
Строение молекулы водорода
Молекула водорода состоит из двух атомов, связь между которыми осуществляется парой электронов, вращающихся вокруг ядер обоих атомов. Строение молекулы водорода (рис.) аналогично строению атома гелия, вследствие чего при обыкновенной температуре водород инертен. При более высоких температурах связь между атомами ослабляется и водород становится активным.
Из физических свойств водорода особенный интерес представляет его теплоемкость, которая при низких температурах значительно меньше, чем следовало бы ожидать на основании кинетической теории газов. Это явление объясняется существованием двух модификаций водорода, получивших название ортоводород и параводород.
Обе модификации состоят из одних и тех же молекул Н2 и имеют одинаковые химические свойства, но их физические свойства, как, например, удельная теплоемкость, точки плавления и кипения и др., несколько различны. Причина различия заключается в том, что водородные ядра (протоны), входящие в состав молекул Н2 и обладающие собственным вращением вокруг своих осей, трёх частей ортоводорода и одной части параводорода, находящихся в равновесии друг с другом.
Понижение температуры смещает равновесие в сторону образования параводорода, а так как его теплоемкость меньше теплоемкости ортоводорода, то с увеличением содержания параводорода в смеси общая ее темплоемкость уменьшается.Химические свойства водорода определяются способностью его атомов отдавать единственный имеющийся у них электрон и превращаться в положительно заряженные ионы.
Однако полностью такое превращение не происходит, так как даже при взаимодействии водорода с наиболее активными металлоидами образуются не ионные, а полярные ковалентные связи. Иногда атомы водорода сами присоединяют электроны, переходя в отрицательно заряженные ионы Н— с оболочкой инертного газа гелия. В виде таких ионов водород находится в соединениях с некоторыми наиболее активными металлами (К, Na, Са и др.).
Эти соединения называются гидридами металлов и, в отличие от газообразных соединений водорода с металлоидами, представляют собой твердые кристаллические вещества (подробнее о гидридах смотри при описании соответствующих металлов). Если к струе водорода, выходящей из какого-нибудь узкого отверстия, поднести зажженную спичку, то водород загорается и горит несветящимся пламенем. Продуктом горения является вода:
2Н2 + О2 = 2Н2О + 136,8 ккал
 Рис. 2. Горелка для гремучего газа
Рис. 2. Горелка для гремучего газа
При поджигании смеси двух объемов водорода с одним объемом кислорода соединение газов происходит почти мгновенно во всей массе смеси и сопровождается сильным взрывом. Поэтому такая смесь называется гремучим газом.
Вследствие выделения при горении водорода большого количества тепла температура водородного пламени довольно высока (~1000°).
Но особенно высокая температура, достигающая 2500—3000°, получается при введении в водородное пламя избытка кислорода. Для получения такого пламени пользуются специальной горелкой (рис. 2), состоящей из двух трубок разного диаметра, вставленных одна в другую. В пространство между стенками трубок впускают водород и зажигают его у выходного отверстия.
После этого по внутренней трубке начинают осторожно вводить в водородное пламя струю кислорода.Оба газа смешиваются у отверстия горелки и дают очень горячее пламя, в котором легко расплавляются почти все металлы, даже самые тугоплавкие. Железная или стальная проволока, внесенная в такое пламя, сгорает в нем, как в кислороде, разбрасывая во все стороны блестящие искорки.
Если направить пламя на кусок извести, то он накаливается добела и испускает ослепительно яркий свет. Водородно-кислородным пламенем пользуются для плавления тугоплавких металлов, для так называемой автогенной сварки, для резания и сверления металлов пламенем.
Реакция водорода с кислородом
При обыкновенной температуре водород с кислородом практически не взаимодействуют. Если смешать оба газа и оставить их в стеклянном сосуде, то и через несколько лет в сосуде нельзя обнаружить даже признаков воды.
Если же смесь водорода с кислородом поместить в запаянный сосуд и держать в нем при 300°, то уже через несколько дней образуется немного воды. При 500° водород полностью соединяется с кислородом за несколько часов, а при нагревании смеси до 700° происходит быстрый подъем температуры и реакция заканчивается мгновенно. Поэтому, чтобы вызвать взрыв смеси, нужно нагреть ее хотя бы в одном месте до 700°
Отсутствие заметной реакции между водородом и кислородом при обыкновенной температуре объясняется тем, что в этих условиях скорость реакции чрезвычайно мала. Принимая, что с понижением температуры на каждые 10° скорость реакции уменьшается в два раза, нетрудно рассчитать, что если при 300° заметное количество воды образуется лишь через 3 дня, то при обыкновенной температуре (20°) для этого потребовалось бы более двух миллионов лет.
Применение катализатора может сильно увеличить скорость взаимодействия водорода с кислородом. Внесем, например, кусочек платинированного (т. е. покрытого мелко раздробленной платиной) асбеста в смесь водорода с кислородом. Взаимодействие между газами настолько ускоряется, что через короткое время происходит взрыв.
При высокой температуре водород может отнимать кислород от многих соединений, в том числе от большинства металлических окислов, освобождая металл. Например, если пропускать водород над накаленной окисью меди, то происходит реакция
СuО + Н2 = Сu + Н2О
Процесс присоединения кислорода к металлу называется окислением, обратный же процесс, при котором от окисла отнимается кислород и таким образом снова освобождается металл, получил название восстановления.
Присоединение водорода к какому-нибудь веществу также называется восстановлением или гидрированием.
Не только водород, но и некоторые другие вещества, как, например, уголь, могут отнимать кислород от различных соединений. Все такие вещества называются восстановителями. Водород является одним из наиболее энергичных восстановителей.
Применение водорода
Водород используется при синтезе ряда важнейших химических продуктов. Его применяют в огромных количествах для синтеза аммиака, идущего в свою очередь на производство азотной кислоты и азотных удобрений, для получения синтетического моторного топлива, для так называемой гидрогенизации жиров (превращение жидких растительных жиров в твердые), для синтеза спиртов (метилового и др.).
Водород используют также для восстановления некоторых цветных металлов из их окислов и для наполнения аэростатов. Жидким водородом (точка кипения —252,7°) пользуются иногда для получения низких температур.
66 67 68
Вы читаете, статья на тему Свойства и применение водорода
Источник
Анонимный вопрос
16 декабря 2018 · 13,1 K
Получил математическое и богословское образование. Есть дети, соответсвенно и…
Водород широко применяется в нефтепереработке – с его помощью из различных нефтепродуктов удаляются соединения серы. Большой объём этого газа используется для получения аммиака (необходимого, например, для производства удобрений). Также реакция водорода с хлором даёт хлороводород, водный раствор которого известен нам как соляная кислота. С помощью водорода также осуществляется восстановление металлов из их оксидов. Этот газ – важная составляющая при производстве метилового спирта.
Водород используется и в пишевой промышленности – для производства маргарина из растительных масел.
Температура сгорания водорода в кислороде – около 3000 градусов, а в специальных горелках её можно довести и до 4000. Поэтому водород используется для сварки тугоплавких металлов. Также жидкий водород – ракетное топливо.
При сгорании водород образует безопасный водяной пар, поэтому в перспективе он может стать экологичным топливом для автомобилей. Правда в настоящий момент его использование невозможно из-за многих технических ограничений.
Применяется он очень широко, все и не описать. Большая часть (около 54%) уходит на проихводство аммиака и метанола, которые нужны для поизводства пластмасс, удобрений и взрывчатки. Еще 35% тратят при переработки нефти. Остальное приходится на: пищевую, косметическую, авиационную промышленность, производство электроники, охлаждение мощных электрогенера… Читать далее
Да знаю
Реально водородсодержащих газ можно получить в специализированной установке, автор которого изобретатель Г.Г.Аракелян. Он успешно эксплуатирует у себя на производстве сушки ЖБК эти установки. Смотрите в Ютубе
Широкого применения в РФ его изобретение не применяется по известной причине.
.
Как работает водородное топливо?
Сотрудник Mitsubishi Power Europe/
Аспирант НИУ МЭИ, кафедра химии и электрохимической… · t.me/century_arch
В зависимости от того как его использовать, возможен вариант прямого сжигания водорода, тогда процесс представляет собой традиционную тепловую машину, удельная теплота сгорания водорода самая высокая из всех известных топлив: 140 и 120 МДж/кг верхняя и низшая соответственно (Для сравнения у метана – 50 МДж/кг).
Проблема в том, что окислителем все равно является кислород, и возможно образование гремучей смеси.
При комнатной температуре водорода и кислорода может храниться в закрытом сосуде неограниченно долго. Однако при повышении температуры сосуда выше некоторого критического значения, зависящего от давления, смесь воспламеняется и сгорает чрезвычайно быстро, со вспышкой или взрывом. Как следствие низкий ресурс такой энергоустановки.
Другое применение – топливный элемент.
Там происходит прямое превращение энергии водорода в электрическую, причем в твердполимерных топливных элементах это происходит при температуре 40 – 60 градусов Цельсия.
Принципиальная схема представлена выше. В одну из камер подается водород (анодная камера) там происходит электроокисление водорода, при это электрон идет по внешней цепи, катион проходит через твердполимерный электролит, где в катодной камере (туда подают кислород) восстанавливается до воды. Реакции представлены ниже:
- на аноде: 2H2 – 4е → 4H+ ;
- на катоде: O2 + 4H+ + 4e— → 2H2O.
Суммарная реакция: 2H2 + O2 → 2H2O.
Недостатки таких систем: катализатором реакции окисления водорода являются металлы платиновой группы, а лучше всего сама платина, которая является весьма дорогой.
Такие энергоустановки не любят переменных графиков нагрузки, а сам водород должен быть высокой чистоты.
Как получить, собрать, распознать водород?
Водород – это самый легкий газ. В лаборатории его получают чаще всего в аппарате Кипа взаимодействием цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2 ↑.
Так как водород самый легкий газ, его собирают в перевернутый вверх дном сосуд.
Для распознавания водорода его поджигают и по характеру звука, с которым он сгорает, определяют наличие данного газа: к отверстию перевернутого вверх дном сосуда подносят зажженную лучину. Раздается глухой хлопок, если водород чистый или «лающий» звук, если водород содержит примеси.
Есть ли будущее у автомобилей, работающих на водороде?
Сотрудник Mitsubishi Power Europe/
Аспирант НИУ МЭИ, кафедра химии и электрохимической… · t.me/century_arch
Машины, работающие на водороде, называют Fuel Cell Electric Vehicles или FCEV, на автомобильном рынке уже представлено несколько подобных решений. Конкретные коммерческие модели: Toyota Mirai и Honda FCX Clarity. Такая машина имеет так называемый топливный элемент (электрохимический генератор), являющийся своеобразной “батарейкой”, в которую поступает водород, после чего он окисляется и в результате на выходе мы имеем чистый водяной пар с нулевым содержанием углекислого газа. В остальном здесь все практически так же, как в обычном электромобиле, но в случае с водородной установкой используется куда более компактная батарея – емкость литий-ионного аккумулятора в водородных автомобилях в 10 раз меньше, поскольку он используется только для холодного старта и буферизации энергии, полученной при рекуперативном торможении.
По оценкам Hydrogen council (совет по водородным технологиям), к 2050 году мировой рынок водорода будет составлять порядка 18% от общего спроса на электроэнергию. При этом в транспортном секторе количество легковых автомобилей на водородном топливе составит 400 млн, 15-20 млн грузовых и 5 млн автобусов.
Китай планирует к 2030 году установить 1000 водородных заправочных станций, обслуживающих более 1 млн FCEV.
Так же активно инвестируют в водородную инфраструктуру Южная Корея, ведь всю страну можно пересечь на одном баке водорода.
В следующем году в Токио будет проходить олимпиада, японское правительство пообещало, что вся инфраструктура будет обслуживаться исключительно водородным топливом, уже переданы первые два автобуса на с топливным элементом на борту.
Несмотря на дешевизну ископаемого топлива, многие страны обделены природными ископаемыми, это вынуждает их отказаться от экспортного ископаемого топливо во благо энергетической безопасности страны, тот же водород можно получать дорогим способом электролиза воды – разложением воды на водород и кислород
Так же в мире появляется все больше компаний, которые внедряют водородные технологии в промышленность, и даже в некоторых случаях (Твердооксидные топливные элементы) создаются целые электрические станции, работающие на водородном топливе.
Прочитать ещё 2 ответа
Водородный генератор насколько эффективен и полезен для автомобиля на бензине?
Сотрудник Mitsubishi Power Europe/
Аспирант НИУ МЭИ, кафедра химии и электрохимической… · t.me/century_arch
Ни насколько он не эффективен, не имеет смысла, и может быть даже опасно.
Водород обладает сильными детонационными свойствами, и бензиновый двигатель просто не рассчитан на такую энергию при сгорании водорода, двигатель просто выйдет из строя и хорошо, если это будет без взрыва.
В теории возможен вариант при использовании газа в качестве топлива, можно разбавлять метан водородом до 3% объема, в этом случае тоже будет происходить повышенный износ двигателя.
Другое дело если двигателем вашего автомобиля является водородный топливный элемент, эффективность повысится, единственным выхлопом будет вода. Все упирается в проблему получения водорода, это возможно или электролизом, то есть разложением воды на водород и кислород, или паровой конверсии – превращение метана в водород и углекислый газ. Поскольку в России нет инфраструктуры водородных заправок более предпочтительный вариант – электролиз, покупаете электролизную установку в гараж и заряжаете автомобиль водородом на ночь. Для получения 1000 литров водорода необходимо затратить около 5 кВт*ч, а для получения 1 кВт*ч электрической энергии необходимо потратить около 800 литров водорода.
Источник
Гидроген Н – химический элемент, один из самых распространённых в нашей Вселенной. Масса водорода как элемента в составе веществ составляет 75 % от общего содержания атомов другого типа. Он входит в наиважнейшее и жизненно необходимое соединение на планете – воду. Отличительной особенностью водорода также является то, что он первый элемент в периодический системе химических элементов Д. И. Менделеева.

Открытие и исследование
Первые упоминания о водороде в трудах Парацельса датируются шестнадцатым веком. Но его выделение из газовой смеси воздуха и исследование горючих свойств были произведены уже в семнадцатом веке учёным Лемери. Досконально изучил гидроген английский химик, физик и естествоиспытатель Генри Кавендиш, который опытным путём доказал, что масса водорода наименьшая в сравнении с другими газами. В последующих этапах развития науки многие учёные работали с ним, в частности Лавуазье, назвавший его «рождающим воду».
Характеристика по положению в ПСХЭ
Элемент, открывающий периодическую таблицу Д. И. Менделеева, – это водород. Физические и химические свойства атома проявляют некую двойственность, так как гидроген одновременно относят к первой группе, главной подгруппе, если он ведёт себя как металл и отдаёт единственный электрон в процессе химической реакции, и к седьмой – в случае полного заполнения валентной оболочки, то есть приёме отрицательной частицы, что характеризует его как подобный галогенам.

Особенности электронного строения элемента
Свойства атома водорода, сложных веществ, в состав которых он входит, и самого простого вещества Н2 в первую очередь определяются электронной конфигурацией гидрогена. Частица имеет один электрон с Z= (-1), который вращается по своей орбите вокруг ядра, содержащего один протон с единичной массой и положительным зарядом (+1). Его электронная конфигурация записывается как 1s1, что означает наличие одной отрицательной частицы на самой первой и единственной для гидрогена s-орбитали.
При отрыве или отдаче электрона, а атом этого элемента имеет такое свойство, что роднит его с металлами, получается катион. По сути ион водорода – это положительная элементарная частица. Поэтому лишенный электрона гидроген называют попросту протоном.
Физические свойства
Если описывать физические свойства водорода кратко, то это бесцветный, малорастворимый газ с относительной атомной массой равной 2, в 14,5 раза легче, чем воздух, с температурой сжижения, составляющей -252,8 градуса Цельсия.
На опыте можно легко убедиться в том, что Н2 самый легкий. Для этого достаточно наполнить три шара различными веществами – водородом, углекислым газом, обычным воздухом – и одновременно выпустить их из руки. Быстрее всех достигнет земли тот, который наполнен СО2, после него опустится надутый воздушной смесью, а содержащий Н2 вовсе поднимется к потолку.
Маленькая масса и размер частиц водорода обосновывают его способность проникать через различные вещества. На примере того же шара в этом легко убедиться, через пару дней он сам сдуется, так как газ просто пройдёт через резину. Также водород может накапливаться в структуре некоторых металлов (палладий или платина), а при повышении температуры испаряться из неё.
Свойство малорастворимости водорода используют в лабораторной практике для его выделения способом вытеснения воды. Физические свойства водорода (таблица, изображенная ниже, содержит основные параметры) определяют сферы его применения и методы получения.
| Параметр атома или молекулы простого вещества | Значение |
| Атомная масса (молярная масса) | 1,008 г/моль |
| Электронная конфигурация | 1s1 |
| Кристаллическая решётка | Гексагональная |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Плотность при н. у. | 0,08987 г/л |
| Температура кипения | -252,76 °C |
| Удельная теплота сгорания | 120,9·106 Дж/кг |
| Температура плавления | -259,2 °C |
| Растворимость в воде | 18,8 мл/л |
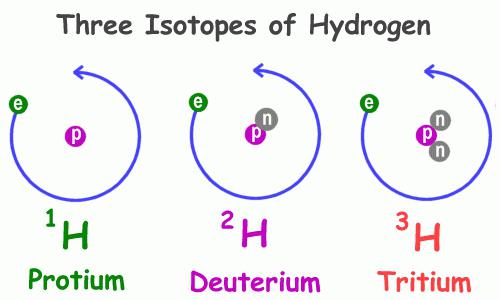
Изотопный состав
Как и многие другие представители периодической системы химических элементов, гидроген имеет несколько природных изотопов, то есть атомов с одинаковым числом протонов в ядре, но различным числом нейтронов – частиц с нулевым зарядом и единичной массой. Примеры атомов, обладающих подобным свойством – кислород, углерод, хлор, бром и прочие, в том числе радиоактивные.
Физические свойства водорода 1Н, самого распространённого из представителей данной группы, значительно отличаются от таких же характеристик его собратьев. В частности, разнятся особенности веществ, в состав которых они входят. Так, существует обычная и дейтерированная вода, содержащая в своём составе вместо атома водорода с одним-единственным протоном дейтерий 2Н – его изотоп с двумя элементарными частицами: положительной и незаряженной. Этот изотоп в два раза тяжелее обычного гидрогена, что и объясняет кардинальное различие в свойствах соединений, которые они составляют. В природе дейтерий встречается в 3200 раз реже, чем водород. Третий представитель – тритий 3Н, в ядре он имеет два нейтрона и один протон.
Способы получения и выделения
Лабораторные и промышленные методы получения водорода весьма отличаются. Так, в малых количествах газ получают в основном с помощью реакций, в которых участвуют минеральные вещества, а крупномасштабные производства в большей степени используют органический синтез.
В лаборатории применяют следующие химические взаимодействия:
- Реакция щелочных и щелочноземельных металлов с водой с образованием щёлочи и искомого газа.
- Электролиз водного раствора электролита, на аноде выделяется Н2↑, а на катоде – кислород.
- Разложение гидридов щелочных металлов водой, продуктами являются щёлочь и, соответственно, газ Н2↑.
- Взаимодействие разбавленных кислот с металлами с образованием солей и Н2↑.
- Действие щелочей на кремний, алюминий и цинк также способствует выделению водорода параллельно с образованием комплексных солей.
В промышленных интересах газ получают такими методами, как:
- Термическое разложение метана в присутствии катализатора до составляющих его простых веществ (350 градусов достигает значение такого показателя, как температура) – водорода Н2↑ и углерода С.
- Пропускание парообразной воды через кокс при 1000 градусов Цельсия с образованием углекислого газа СО2 и Н2↑ (самый распространённый метод).
- Конверсия газообразного метана на никелевом катализаторе при температуре, достигающей 800 градусов.
- Водород является побочным продуктом при электролизе водных растворов хлоридов калия или натрия.
Химические взаимодействия: общие положения
Физические свойства водорода во многом объясняют его поведение в процессах реагирования с тем или иным соединением. Валентность гидрогена равняется 1, так как он в таблице Менделеева расположен в первой группе, а степень окисления проявляет различную. Во всех соединениях, кроме гидридов, водород в с.о.= (1+), в молекулах типа ХН, ХН2, ХН3 – (1-).
Молекула газа водорода, образованная посредством создания обобщенной электронной пары, состоит из двух атомов и довольно устойчива энергетически, именно поэтому при нормальных условиях несколько инертна и в реакции вступает при изменении нормальных условий. В зависимости от степени окисления водорода в составе прочих веществ, он может выступать как в качестве окислителя, так и восстановителя.
Вещества, с которыми реагирует и которые образует водород
Элементные взаимодействия с образованием сложных веществ (часто при повышенных температурах):
- Щелочной и щелочноземельный металл + водород = гидрид.
- Галоген + Н2 = галогеноводород.
- Сера + водород = сероводород.
- Кислород + Н2 = вода.
- Углерод + водород = метан.
- Азот + Н2 = аммиак.
Взаимодействие со сложными веществами:
- Получение синтез-газа из монооксида углерода и водорода.
- Восстановление металлов из их оксидов с помощью Н2.
- Насыщение водородом непредельных алифатических углеводородов.
Водородная связь
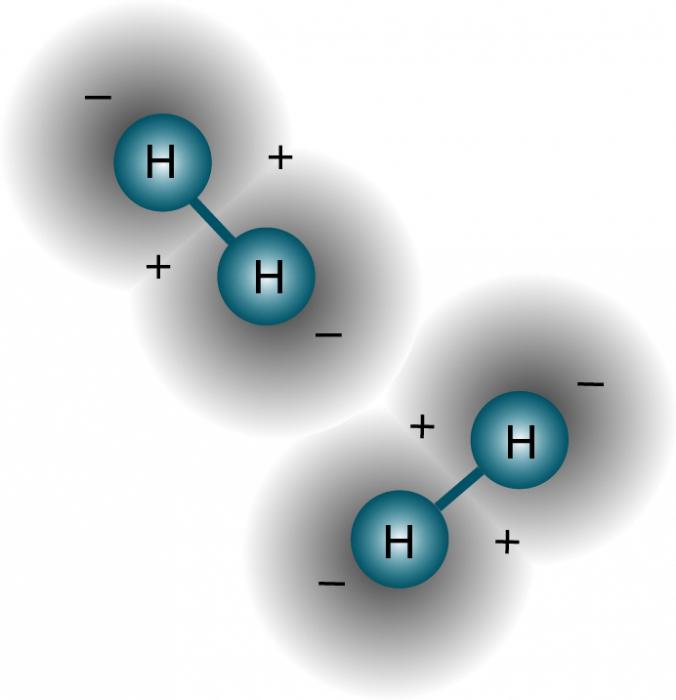
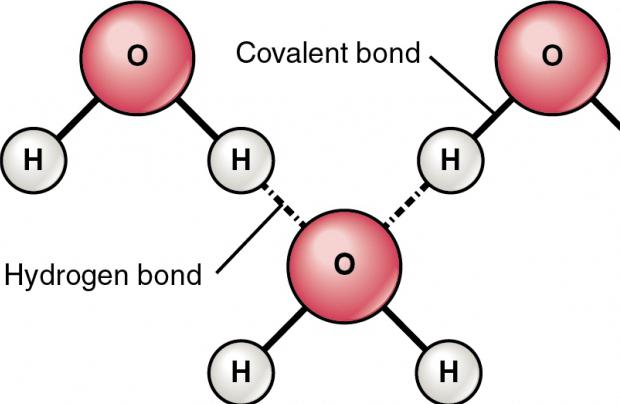
Физические свойства водорода таковы, что позволяют ему, находясь в соединении с электроотрицательным элементом, образовывать особый тип связи с таким же атомом из соседних молекул, имеющих неподелённые электронные пары (например, кислородом, азотом и фтором). Ярчайший пример, на котором лучше рассмотреть подобное явление, – это вода. Она, можно сказать, прошита водородными связями, которые слабее ковалентных или ионных, но за счёт того, что их много, оказывают значительное влияние на свойства вещества. По сути, водородная связь – это электростатическое взаимодействие, которое связывает молекулы воды в димеры и полимеры, обосновывая её высокую температуру кипения.
Гидроген в составе минеральных соединений
В состав всех неорганических кислот входит протон – катион такого атома, как водород. Вещество, кислотный остаток которого имеет степень окисления больше (-1), называется многоосновным соединением. В нём присутствует несколько атомов водорода, что делает диссоциацию в водных растворах многоступенчатой. Каждый последующий протон отрывается от остатка кислоты всё труднее. По количественному содержанию водородов в среде определяется его кислотность.

Водород содержат и гидроксильные группы оснований. В них водород соединён с атомом кислорода, в результате степень окисления этого остатка щёлочи всегда равна (-1). По содержанию гидроксилов в среде определяется её основность.
Применение в деятельности человека
Баллоны с веществом, так же как и емкости с другими сжиженными газами, например кислородом, имеют специфический внешний вид. Они выкрашены в темновато-зелёный цвет с ярко-красной надписью «Водород». Газ закачивают в баллон под давлением порядка 150 атмосфер. Физические свойства водорода, в частности легкость газообразного агрегатного состояния, используют для наполнения им в смеси с гелием аэростатов, шаров-зондов и т.д.
Водород, физические и химические свойства которого люди научились использовать много лет назад, на сегодняшний момент задействован во многих отраслях промышленности. Основная его масса идёт на производство аммиака. Также водород участвует в получении металлов (гафния, германия, галлия, кремния, молибдена, вольфрама, циркония и прочих) из окислов, выступая в реакции в качестве восстановителя, синильной и соляной кислот, метилового спирта, а также искусственного жидкого топлива. Пищевая промышленность использует его для превращения растительных масел в твёрдые жиры.
Определили химические свойства и применение водорода в различных процессах гидрогенизации и гидрирования жиров, углей, углеводородов, масел и мазута. С помощью него производят драгоценные камни, лампы накаливания, проводят ковку и сварку металлических изделий под воздействием кислородно-водородного пламени.
Источник
