На каких свойствах основано применения углерода
Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия углерода
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Углерод в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892%) и 13С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14С с периодом полураспада 5,73*103 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома углерода
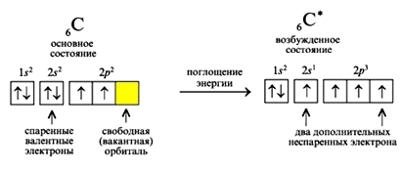
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s22s22p2. Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
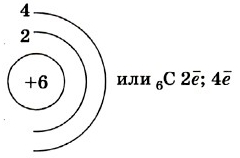
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства углерода
Своими физическими свойствами углерод типичный неметалл. При этом он образует множество аллотропных модификаций («аллотропные» означает существование двух и более разных веществ из одного химического элемента): наиболее популярными из них являются алмаз, графит, уголь, сажа. При этом алмаз – одно из самых твердых веществ, представляющих углерод.
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства углерода
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступая в реакцию с водородом, углерод образует метан:
C0 + 2H2 = CH4
Углерод в природе
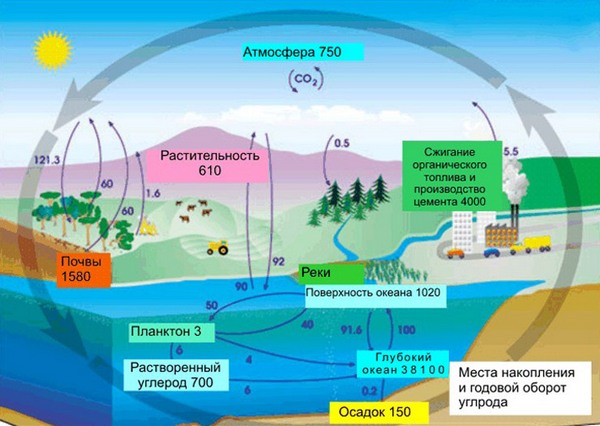
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
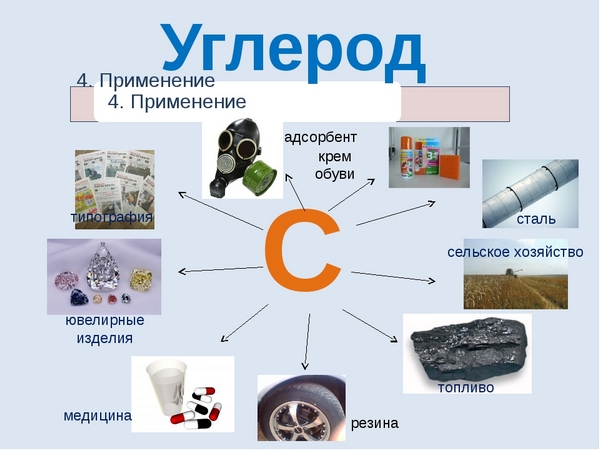
Применение углерода
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
Рекомендованная литература и полезные ссылки
- Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ChemNet. Углерод: история открытия элемента.
- Лейпунский О. И. Об искусственных алмазах (рус.) // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
Углерод, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Углерод С находится в периодической таблице Менделеева под номером 6. Еще первобытные люди обратили внимание, что после сжигания древесины образуется уголь, которым можно рисовать на стенах пещеры. В составе любых органических соединений есть углерод. Наиболее изучены две аллотропные модификации углерода: графит и алмаз.
Графит — мягкое черное вещество, которое легко оставляет следы на бумаге, имеет металлический блеск.
Помимо этого, графит является отличным проводником тепла и электрического тока. Графит используют в промышленности для изготовления графитных смазок, а также для производства карандашей.
Графитовый сланец
[Deposit Photos]
В отличие от графита, структура алмаза (другой аллотропной модификации) напоминает тетраэдр. Кроме углерода, в состав алмаза также входят хром, кремний, алюминий, марганец, титан, железо. Наибольшую долю в составе алмаза углерод делит с азотом. Благодаря своей структуре он не проводит электрический ток и обладает слабой теплопроводностью. Алмазы используют для изготовления драгоценных камней — бриллиантов. Искусственно созданные алмазы используют для изготовления режущих инструментов, абразивных материалов.
[Wikipedia]
Еще одной аллотропной модификацией углерода признан фуллерен. Он состоит из множества атомов углерода, соединенных ковалентными связями. Молекулы в сложной структуре фуллерена удерживаются электростатическими и вандерваальсовыми силами. Свойства фуллерена еще не до конца изучены. Но уже известно, что благодаря своей способности поглощать свободные радикалы эта аллотропная модификация углерода может применяться при изготовлении лекарств.
Молекула фуллерена
[Deposit Photos]
Химические свойства углерода
1. Углерод является неметаллом и способен взаимодействовать с металлами и образовывать карбиды:
Ca + 2C = CaC₂
2. В кислородной среде углерод сгорает в два этапа:
2С + O₂ = 2CO
2СO₂ + О₂ = 2СО₂
3. При взаимодействии углерода и водорода получается органическое вещество — метан:
С + 2H₂ = CH₄
4. При испарении воды под раскаленным углем образуются угарный газ и водород:
C + H₂O = CO + H₂
5. Углерод не реагирует с хлором, бромом и йодом, но взаимодействует со фтором:
С + 2F₂ = CF₄
6. Реагирует с серой:
С + 2S = CS₂
7. Углерод способен восстанавливать металлы из их оксидов:
2ZnO + C = 2Zn + CO₂
8. При повышении температуры реакции углерод взаимодействует с серной кислотой:
C + 2H₂SO₄ = CO₂ + 2SO₂ + 2H₂O
Чтобы лучше изучить свойства этого элемента, рекомендуем провести несколько наглядных экспериментов.
Углерод в органической химии
Углерод занимает особое место в периодической cистеме. Благодаря своему строению он образует длинные цепочки связей линейной или циклической структуры. Известно более 10 миллионов органических соединений. Несмотря на свое разнообразие, на воздухе и под действием температуры они всегда будут превращаться в углекислый газ и воду.
[Deposit Photos]
Роль углерода в нашей повседневной жизни огромна. Без углекислого газа не будет происходить фотосинтез — один из основных биологических процессов.
Применение углерода
Углерод широко применяется в медицине для создания различных лекарств органической природы. Изотопы углерода позволяют проводить радиоуглеродный анализ. Без углерода невозможна работа металлургической промышленности. Уголь, сгорающий в твердотопливных пиролизных котлах, служит источником энергии. В нефтеперерабатывающей промышленности из органических соединений углерода производят бензин и дизельное топливо. В значительной мере углерод необходим для производства сахара. Также он применяется в синтезе органических соединений, важных для всех сфер повседневной жизни.
Источник

- Обозначение – C (Carbon);
- Период – II;
- Группа – 14 (IVa);
- Атомная масса – 12,011;
- Атомный номер – 6;
- Радиус атома = 77 пм;
- Ковалентный радиус = 77 пм;
- Распределение электронов – 1s22s22p2;
- t плавления = 3550°C;
- t кипения = 4827°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,55/2,50;
- Степень окисления: +4, +3, +2, +1, 0, -1, -2, -3, -4;
- Плотность (н. у.) = 2,25 г/см3 (графит);
- Молярный объем = 5,3 см3/моль.
Соединения углерода:
- Оксиды углерода CO, CO2
- Угольная кислота H2CO3 и ее соли
Углерод в виде древесного угля известен человеку с незапамятных времен, поэтому, о дате его открытия говорить не имеет смысла. Собственно свое название “углерод” получил в 1787 году, когда была опубликована книга “Метод химической номенклатуры”, в которой вместо французского названия «чистый уголь» (charbone pur) появился термин «углерод» (carbone).
Углерод обладает уникальной способностью образовывать полимерные цепочки неограниченной длины, порождая тем самым огромный класс соединений, изучением которых занимается отдельный раздел химии – органическая химия. Органические соединения углерода лежат в основе земной жизни, поэтому, о важности углерода, как химического элемента, говорить не имеет смысла – он основа жизни на Земле.
Сейчас рассмотрим углерод с точки зрения неорганической химии.
Углерод в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером “6”, относится к 14(IVa) группе (См. Атомы 14(IVa) группы).
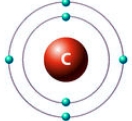
Рис. Строение атома углерода.
Электронная конфигурация углерода – 1s22s22p2 (см. Электронная структура атомов). На внешнем энергетическом уровне у углерода находятся 4 электрона: 2 спаренных на s-подуровне + 2 неспаренных на p-орбиталях. При переходе атома углерода в возбужденное состояние (требует энергетических затрат) один электрон с s-подуровня “покидает” свою пару и переходит на p-подуровень, где имеется одна свободная орбиталь. Т. о., в возбужденном состоянии электронная конфигурация атома углерода приобретает следующий вид: 1s22s12p3.

Рис. Переход атома углерода в возбужденное состояние.
Такая “рокировка” существенно расширяет валентные возможности атомов углерода, которые могут принимать степень окисления от +4 (в соединениях с активными неметаллами) до -4 (в соединениях с металлами).
В невозбужденном состоянии атом углерода в соединениях имеет валентность 2, например, CO(II), а в возбужденном – 4: CO2(IV).
“Уникальность” атома углерода заключается в том, что на его внешнем энергетическом уровне находятся 4 электрона, поэтому, для завершения уровня (к чему, собственно, стремятся атомы любого химического элемента) он может с одинаковым “успехом”, как отдавать, так и присоединять электроны с образованием ковалентных связей (см. Ковалентная связь).
Углерод, как простое вещество
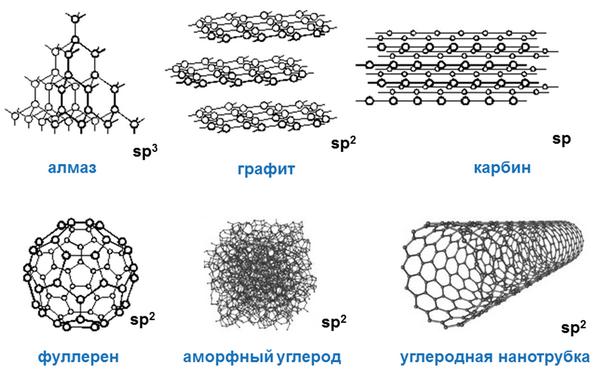
Как простое вещество углерод может находиться в виде нескольких аллотропных модификаций:
- Алмаз
- Графит
- Фуллерен
- Карбин
Алмаз
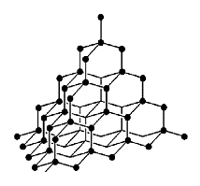
Рис. Кристаллическая решетка алмаза.
Свойства алмаза:
- бесцветное кристаллическое вещество;
- самое твердое вещество в природе;
- обладает сильным преломляющим эффектом;
- плохо проводит тепло и электричество.
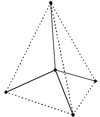
Рис. Тетраэдр алмаза.
Исключительная твердость алмаза объясняется строением его кристаллической решетки, которая имеет форму тетраэдра – в центре тетраэдра находится атом углерода, который связан равноценно прочными связями с четырьмя соседними атомами, образующими вершины тетраэдра (см. рисунок выше). Такая “конструкция” в свою очередь связана с соседними тетраэдрами.
Графит
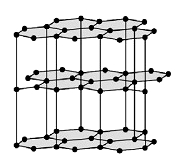
Рис. Кристаллическая решетка графита.
Свойства графита:
- мягкое кристаллическое вещество серого цвета слоистой структуры;
- обладает металлическим блеском;
- хорошо проводит электричество.
В графите атомы углерода образуют правильные шестиугольники, лежащие в одной плоскости, организованные в бесконечные слои.
В графите химические связи между соседними атомами углерода образованы за счет трех валентных электронов каждого атома (изображены синим цветом на рисунке ниже), при этом четвертый электрон (изображен красным цветом) каждого атома углерода, расположенный на p-орбитали, лежащей перпендикулярно плоскости слоя графита, не участвует в образовании ковалентных связей в плоскости слоя. Его “предназначение” заключается в другом – взаимодействуя со своим “собратом”, лежащим в соседнем слое, он обеспечивает связь между слоями графита, а высокая подвижность p-электронов обусловливает хорошую электропроводность графита.
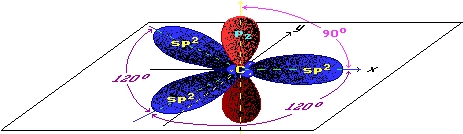
Рис. Распределение орбиталей атома углерода в графите.
Фуллерен
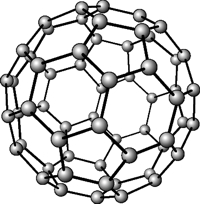
Рис. Кристаллическая решетка фуллерена.
Свойства фуллерена:
- молекула фуллерена представляет собой совокупность атомов углерода, замкнутых в полые сферы типа футбольного мяча;
- это мелкокристаллическое вещество желто-оранжевого цвета;
- температура плавления = 500-600°C;
- полупроводник;
- входит в состав минерала шунгита.
Карбин
Свойства карбина:
- инертное вещество черного цвета;
- состоит из полимерных линейных молекул, в которых атомы связаны чередующимися одинарными и тройными связями;
- полупроводник.
Химические свойства углерода
При нормальных условиях углерод является инертным веществом, но при нагревании может реагировать с разнообразными простыми и сложными веществами.
Выше уже было сказано, что на внешнем энергетическом уровне углерода находится 4 электрона (ни туда, ни сюда), поэтому углерод может, как отдавать электроны, так и принимать их, проявляя в одних соединениях восстановительные свойства, а в других – окислительные.
Углерод является восстановителем в реакциях с кислородом и другими элементами, имеющими более высокую электроотрицательность (см. таблицу электроотрицательности элементов):
- при нагревании на воздухе горит (при избытке кислорода с образованием углекислого газа; при его недостатке – оксида углерода(II)):
C + O2 = CO2;
2C + O2 = 2CO. - реагирует при высоких температурах с парами серы, легко взаимодействует с хлором, фтором:
C + 2S = CS2
C + 2Cl2 = CCl4
2F2 + C = CF4 - при нагревании восстанавливает из оксидов многие металлы и неметаллы:
C0 + Cu+2O = Cu0 + C+2O;
C0+C+4O2 = 2C+2O - при температуре 1000°C реагирует с водой (процесс газификации), с образованием водяного газа:
C + H2O = CO + H2;
Углерод проявляет окислительные свойства в реакциях с металлами и водородом:
- реагирует с металлами с образованием карбидов:
Ca + 2C = CaC2 - взаимодействуя с водородом, углерод образует метан:
C + 2H2 = CH4
Углерод получают термическим разложением его соединений или пиролизом метана (при высокой температуре):
CH4 = C + 2H2.
Применение углерода
Соединения углерода нашли самое широкое применение в народном хозяйстве, перечислить все их не представляется возможным, укажем только некоторые:
- графит применяется для изготовления грифелей карандашей, электродов, плавильных тиглей, как замедлитель нейтронов в ядерных реакторах, как смазочный материал;
- алмазы применяются в ювелирном деле, в качестве режущего инструмента, в буровом оборудовании, как абразивный материал;
- в качестве восстановителя углерод используют для получения некоторых металлов и неметаллов (железа, кремния);
- углерод составляет основную массу активированного угля, который нашел широчайшее применение, как в быту (например, в качестве адсорбента для очистки воздуха и растворов), так и в медицине (таблетки активированного угля) и в промышленности (в качестве носителя для каталитических добавок, катализатора полимеризации и проч.).
Источник
