На каком свойстве оксида серы 4 основано его применение
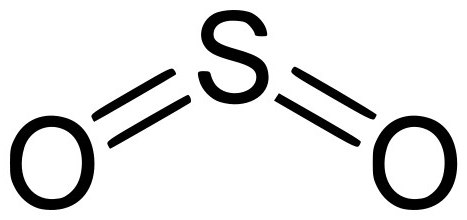
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.

Общие данные о моноокисиде серы
Двухвалентный серный монооксид, или иначе серная моноокись – это неорганическое вещество, состоящее из двух простых элементов – серы и кислорода. Формула – SO. В условиях нормальной обстановки является газом без цвета, но с резким и специфическим запахом. Вступает в реакции с водным раствором. Довольно редкое соединение в земной атмосфере. К воздействию температур неустойчив, существует в димерной форме – S2O2. Иногда способен, взаимодействуя с кислородом, в результате реакции образовывать диоксид серы. Солей не образует.
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
- 2S2+O2 =2SO;
- 2SO2 = 2SO+O2.
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
- S2O2+H2O = H2S2O3.
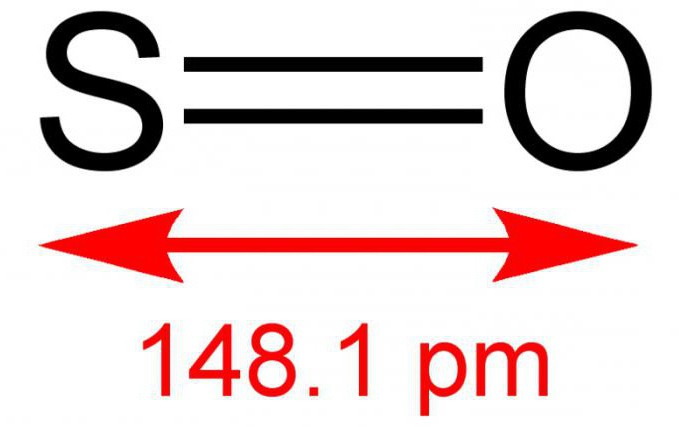
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.

В промышленности получают сжиганием серы или обжигом ее сульфидов:
- 2FeS2+5O2 = 2FeO+4SO2.
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.

SO2 – довольно токсичное соединение. Характерные симптомы, указывающие на отравление им, – это откашливание, появление проблем с дыханием, как правило, в виде насморка, охриплости, появление необычного привкуса и першение в горле. Вдыхание такого газа может вызвать удушье, нарушение речевой способности индивида, рвоту, затруднение процесса глотания, а также легочный отек в острой форме. Максимально допустимой концентрацией этого вещества в рабочем помещении является 10мг/м3. Однако у различных людей организм может проявлять и разную чувствительность к сернистому газу.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
- Fe2(SO4)3 = Fe2O3+3SO3;
- SO2+O3 = SO3+O2.
Окисление SO2 при помощи NO2:
- SO2+NO2 = SO3+NO.
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO3 = K2SO4+H2O;
- CaO+SO3 = CaSO4.
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
- SO3+H2O = H2SO4.
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
- SO3+HCl = HSO3Cl.
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
Источник
Оксиды серы. Общая характеристика, химические свойства

Большинство школьников знают два оксида серы – SO2 и SO3.
Однако, это не все соединения, которые сера образует с кислородом.
Рассмотрим их все.
Монооксид серы – SO

- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
- SO имеет триплетное основное состояние, схожее с таковым у O2, то есть каждая молекула имеет по два неспаренных электрона;
- молекула SO используется в реакциях органического синтеза (встраивается в молекулы алкенов, алкинов, диенов для получения молекул с трехчленными кольцами, содержащими серу);
- монооксид серы обнаружен на Ио – спутнике Юпитера, а также в атмосфере Венеры, в комете Хейла – Боппа (или “Большая комета 1997 года”);
- редко встречается в атмосфере Земли, поэтому токсичность в полной мере не выявлена;
- обладает высокой воспламеняемостью, горит до образования ядовитого сернистого газа SO2.
Дисульфид серы – SO2

- Токсичный газ, ответственен за запах сгоревших спичек;
- в природе образуется в результате вулканической активности;
- вне Земли встречается в атмосфере Венеры, где образует облака в результате конденсации, способствуя при этом глобальному потеплению на планете; а также на Ио, спутнике Юпитера (90% атмосферы)
- промышленное значение сернистого газа в основном заключается в производстве серной кислоты;
- SO2 может связываться с ионами металлов в качестве лиганда с образованием комплексов диоксида серы с металлом, обычно там, где переходный металл находится в степени окисления 0 или +1;
- обладает антимикробными свойствами, используется в качестве консерванта для кураги, инжира (E220);
- диоксид серы издавна применяется в производстве вина – служит антибиотиком и антиоксидантом, защищая вино от порчи и потемнения (окисления);
- сернистый газа является сильным восстановителем, при этом обладает отбеливающим эффектом;
- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид – SO3

- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
- 2NaHSO4 → Na2S2O7 + H2O
Na2S2O7 → Na2SO4 + SO3
- серный ангидрид агрессивно гигроскопичен – теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы – SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 + Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, +6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 – озон.

Монооксид дисеры, субоксид серы – S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- Грамотрицательные бактерии Desulfovibrio desulfuricans способны производить S2O;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы – сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
Реагент | Оксид серы IV – SO2 – Диоксид серы; – газ с резким запахом; – кислотный оксид; – гибридизация серы – sp2; – валентный угол – 120 | Оксид серы VI – SO3 – Триоксид серы; – бесцветная летучая жидкость; – кислотный оксид; – гибридизация серы – sp3; – валентный угол 120 |
Получение | 1) В промышленности: S + O2 = SO2 (360 C) 4FeS + 7O2 = 2Fe2O3 + 4SO2 (t) 2) В лаборатории: Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O (t) Me + 2H2SO4 (k) = MeSO4 + SO2 + 2H2O (Me = Cu, Hg, Bi, Ag) 2HBr + 2H2SO4 (k) = Br2 + SO2 + 2H2O | 1) В промышленности: 2SO2 + O2 = 2SO3 (500 C, V2O5) SO2 + O3 = SO3 + O2 2) В лаборатории: 2CaSO4 = 2CaO + 2SO3 (450 C) 2CuSO4 = 2CuO + 2SO3 Na2S2O7 = Na2SO4 + 2SO3 |
+ O2 | 2SO2 + O2 = 2SO3 + Q | ≠ |
+ H2O | SO2 + H2O = H2SO3 | SO3 + H2O = H2SO4 |
+ H2O2 | SO2 + H2O2 = H2SO4 | ≠ |
+ Основные оксиды | SO2 + CaO = CaSO3 SO2 + Na2O = Na2SO3 | SO3 + Na2O = Na2SO4 SO3 + CaO = CaSO4 |
+ Кислотные оксиды | SO2 + CO = S + 2CO2 (Al2O3, 500 C) SO2 + NO2 = SO3 + NO (нитрозный способ получения серной кислоты) | ≠ |
+ Амфотерные оксиды | SO2 + Al2O3, BeO, ZnO ≠ | SO3 + Fe2O3 = Fe2(SO4)3 |
+ Основания | SO2 + 2NaOH = Na2SO3 + H2O SO2 + Me(OH)x ≠ (Me = Fe, Cr, Al, Sn) SO2 + 2KOH (расплав) = 3K2SO4 + K2S + 4H2O (t) | SO3 + 2NaOH (разб.) = Na2SO4 + H2O SO3 + Ca(OH)2 = CaSO4 + H2O |
+ Кислоты | SO2 + 4HI = S↓ + 2I2 + 2H2O SO2 + 2H2S = 3S + 2H2O SO2 + 2HNO3 (k) = H2SO4 + 2NO2 SO2 + 2HNO2 (p) = H2SO4 + 2NO | SO3 + HF = HSO3F (45 C) SO3 + HCl = HSO3Cl (20 C, в олеуме) SO3 + H2SO4 + CaF2 = 2HSO3F + CaSO4 SO3 + H2SO4 (безводн.) = H2S2O7 3SO3 + H2S = 4SO2 + H2O |
+ Соли | SO2 + Na2CO3 = Na2SO3 + CO2 (20 С) SO2 + Na2SO3 = Na2S2O5 (в этаноле) SO2 + PCl5 = PClO3 + SCl2O (50 – 60 C) | SO3 + MeF = MeSO3F (Me = Li, K, NH4) SO3 + 2KI = K2SO3 + I2 SO3 + Na2S = Na2SO4 |
+ Комплексные соли | 3SO2 + Na3[Al(OH)6] (P) = Al(OH)3 + 3NaHSO3 | ≠ |
+ Неметалл | SO2 + O3 = SO3 + O2 SO2 + 2C = S↓ + 2CO2 (600 С) SO2 + Cl2 = SO2Cl2 (солнечный свет) SO2 + F2 = SO2F2 (20 С, Pt) SO2 + 3F2 = SF6 + O2 (650 C) SO2 + 2H2 = S↓ + 2H2O SO2 + 3S = 2S2O (вакуум, эл. разряд) | 2SO3 + C = 2SO2 + CO2 10SO3 + P4 = P4O10 + 10SO2 |
+ Металл | SO2 + Me + H2O = MeSO3 + H2 (активные Ме) SO2 + Me = MeS2O4 (Me = Zn, Co; в смеси этанола иводы) | SO3 + Mg = MgO + SO2 |
ОВР | SO2 + Cl2 + 2H2O = 2HCl + H2SO4 SO2 + I2 + 2H2O = 2HI + H2SO4 5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 5SO2 + 2K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O SO2 + 2FeCl3+ 2H2O = 2FeCl2 + H2SO4 + 2HCl SO2 + 2CuCl2 + 2H2O = 2CuCl + 2HCl + H2SO4 | SO3 + 2HCl = SO2 + Cl2 + H2O (t) SO3 + 2HBr = SO2 + Br2 + H2O (0 C) SO3 + 8HI = H2S + 4I2 + 3H2O (0 C) |
pangenes.ru © 2020
Источник
Получение [править | править вики-текст]
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
mathsf{4FeS_2 + 11O_2 rightarrow 2Fe_2O_3 + 8SO_2}.
В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:
mathsf{Na_2SO_3 + H_2SO_4 rightarrow Na_2SO_4 + H_2SO_3},
mathsf{H_2SO_3 rightarrow H_2O + SO_2uparrow}.
Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
mathsf{Cu + 2H_2SO_4 rightarrow CuSO_4 + SO_2uparrow + 2H_2O}.
Химические свойства [править | править вики-текст]
Спектр поглощения SO2 в ультрафиолетовом диапазоне.
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
mathsf{SO_2 + H_2O rightleftarrows H_2SO_3}.
Со щелочами образует сульфиты:
mathsf{2NaOH + SO_2 rightarrow Na_2SO_3 + H_2O}.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
mathsf{SO_2 + Br_2 + 2H_2O rightarrow H_2SO_4 + 2HBr},
mathsf{SO_2 + I_2 + 2H_2O rightarrow H_2SO_4 + 2HI},
mathsf{2SO_2 + O_2 xrightarrow[V_2O_5]{450^oC} 2SO_3},
mathsf{3SO_2 + 2KMnO_4 + 2H_2O rightarrow 2H_2SO_4 + 2MnO_2 + K_2SO_4},
mathsf{Fe_2(SO_4)_3 + SO_2 + 2H_2O rightarrow 2FeSO_4 + 2H_2SO_4}.
Предпоследняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода (II):
mathsf{SO_2 + 2CO rightarrow 2CO_2 + S}.
Или для получения фосфорноватистой кислоты:
mathsf{PH_3 + SO_2 rightarrow H_3PO_2 + S}.
Применение [править | править вики-текст]
Большая часть оксида серы (IV) используется для производства сернистой кислоты. Используется также в виноделии в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и, как следствие присутствия воды, H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре [1]. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты.
Токсическое действие [править | править вики-текст]
Skull and crossbones.svg SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
ПДК (предельно допустимая концентрация):
в атмосферном воздухе максимально-разовая — 0,5 мг/м³, среднесуточная — 0,05 мг/м³;
в помещении (рабочая зона) — 10 мг/м³
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Источник
9 класс
Урок № ______. Дата_____________ |
ТЕМА УРОКА: Оксид серы(IV). Сернистая кислота и её соли.
ЦЕЛЬ УРОКА Изучить способы получения сернистого газа, свойства сернистого газа и сернистой кислоты, применение этих веществ. Ознакомить с качественной реакцией на сульфит-ионы.
Основные понятия. Сернистый газ, сульфиты, гидросульфиты.
Планируемые результаты обучения
Предметные. Знать свойства сернистого газа, сернистой кислоты. Уметь составлять уравнения реакций, характеризующих свойства этих веществ, объяснять причину выпадения кислотных дождей, проводить качественную реакцию на сульфит-ионы.
Метапредметные. Формировать умения самостоятельно планировать пути достижения целей, осознанно выбирать наиболее эффективные способы решения учебных и познавательных задач. Формировать и развивать экологическое мышление, умение применять его в познавательной, коммуникативной, социальной практике и профессиональной ориентации.
Личностные. Формировать ответственное отношение к учению, готовность и способность к саморазвитию и самообразованию, основы экологической культуры, соответствующей современному уровню экологического мышления.
Основные виды деятельности учащихся. Самостоятельно составлять уравнения реакций, подтверждающих свойства сернистого газа и сернистой кислоты, молекулярные формулы средних и кислых солей. Проводить химический эксперимент по распознаванию сульфит-ионов.
Лабораторный опыт № 4. «Качественные реакции на сульфит-ионы в растворе».
Структура урока
I. Организационный этап
II. Актуализация опорных знаний
III. Изучение нового материала
IV. Закрепление. Подведение итогов урока
V. Домашнее задание
Ход урока
Проверка домашнего задания.
Упр. № 2, 3 на стр. 70;
ТЗ № 1-2 на стр. 70;
Самостоятельная работа.
Актуализация опорных знаний.
Ответьте на вопросы в начале параграфа 20.
Какие вещества называют оксидами?
Как классифицируют оксиды?
Какие оксиды может образовывать сера?
Тема нашего урока: Оксид серы (IV). Сернистая кислота и её соли.. Сегодня на уроке мы с вами рассмотрим физические и химические свойства, оксида серы (IV). и свойства сернистой кислоты.
Изучение нового материала.
Работа с учебником. §20, стр. 71 – 73.
Физические свойства (стр. 71)(изучают самостоятельно, после чего заполняют таблицу)
Химические свойства сероводорода (стр. 71)
Степень окисления: +4
Окислительные свойства (стр. 71)
Взаимодействие с сероводородом.
SO2 + 2Н2S= 3S + 2H2O (СоставьтеОВР)
Восстановительные свойства (стр.71):
Взаимодействие с хлором.
Cl2 + 2Н2O+ SO2 = 2H2SO4 + 2HCl(СоставьтеОВР)
SO2 – кислотный оксид. Образует H2SO3
Запишите уравнение реакции. (стр. 71)
Со щелочами (стр. 71)
NaOH + SO2 = Na2SO3 + H2O
СaO + SO2 = СаSO3
Применение (стр. 71).
Сернистая кислота – H2SO3 (стр. 72)
Физические свойства.
Сколько ступеней диссоциации у H2SO3?
Запишите уравнения диссоциации.
Как называются ионы HSO3- и SO32-
Как можно распознать соли сернистой кислоты?

Лабораторный опыт № 4. (стр. 72)
«Качественные реакции на сульфит-ионы в растворе».
Цель:
Ход работы.
1. Ход эксперимента.
2. Наблюдение.
3. Уравнение реакции. (молекулярное, ионное, сокращенное).
Вывод:
Закрепление изученного материала.
Решение задач.
Подведение итогов урока.
Домашнее задание:
изучить §20, стр. 71 – 73;
выполнить Упр. № 2 на стр. 73;
ТЗ № 1-2 на стр. 70;
выучить определение, химические свойства.
Перечень использованной литературы.
Учебник. Химия 8 класс.авт. Г.Е. Рудзитис, Ф.Г. Фельдман. Издательство “Просвещение”, 2014.
Источник
