На основании каких свойств можно сделать вывод что пероксиды соли
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н+, а на аноде – HSО4-. Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н+ + 2 = Н2↑;
На аноде: 2HSО4- – 2 = H2S2O8,
или 2H2SO4 = H2S2O8 + 2H+ + 2.
Молекулярная форма:
2H2SO4 = H2S2O8 + Н2↑.
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде – HSО4- . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 = Н2↑ +2ОН–;
На аноде: 2HSО4- – 2 = H2S2O8,
Молекулярная форма:
2(NH4)HSO4 + 2H2O = H2S2O8 + 2NH4OH + H2↑.
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
H2S2O8 + 2Н2О = 2H2SO4 + Н2О2.
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Н2 + О2 = Н2О2.
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
2Н + О2 = Н2О2.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с -связью O−O на ребре и связями H—O на плоскостях двугранного угла:
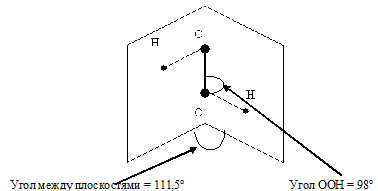
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150°С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( ) больше, чем у Н2О.
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
2Н2О2 ⇔ 2Н2О + О2.
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Электронные уравнения процесса:
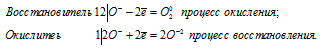
Ионно-молекулярная форма:
4О–= О20 + 2О2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10-3м3. Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
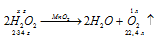
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
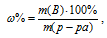
где w% – массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Отсюда
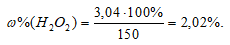
Ответ: 2,02%.
Источник
ОБЩИЕ СПОСОБЫ СИНТЕЗА СОЛЕЙ
Получение средних солей:
Средние соли можно получить путем следующих взаимодействий:
1) металла с неметаллом (получение солей бескилородных кислот):
$2Na + Cl_2 = 2NaCl$
2) металла с кислотой (за исключением $HNO_3$ любой концентрации и $H_2SO_{4textrm{(конц.}}$):
$Zn + 2HCl = ZnCl_2 + H_2uparrow$
3) металла с раствором соли менее активного металла. Более активные металлы, расположенные в ряду активности левее, способны вытеснять менее активные (расположенные правее) металлы из их солей:
$Fe + CuSO_4 = FeSO_4 + Cu$
4) основного оксида с кислотным оксидом:
$4MgO + CO_2 = MgCO_3$
5) основного оксида с кислотой:
$CuO + H_2SO_4= CuSO_4 + H_2O$
6) основания с кислотным оксидом:
$Ba(OH)_2+ CO_2 = BaCO_3 + H_2O$
7) реакциями ионного обмена, а именно:
основания с кислотой,
соли с кислотой,
раствора основания с раствором соли,
растворов двух солей.
Реакции протекают в случае, если образуется газ, осадок или вода (правило Бертолле):
$Ca(OH)_2 + 2HCl = CaCl_2 + 2H_2O$
$MgCO_3 + 2HCl = MgCl_2 + H_2O + CO_2uparrow $
$BaCl_2 + H_2SO_4 = BaSO_4 downarrow+ 2HCl$
$4Ba(OH)_2 + Na_2SO_4 = 2NaOH + BaSO_4downarrow$
$3CaCl_2 + 2Na_3PO_4 = Ca_3(PO_4)_2downarrow + 6NaCl$
Получение кислых солей:
Для получения кислых солей необходимо обеспечить условия, при которых обеспечивается увеличение концентрации протонов водорода $H^+$ . Поэтому кислые соли получаются при:
1. Взаимодействии кислоты с недостатком основания:
$KOH + H_2SO_4 = KHSO_4 + H_2O$
2. Взаимодействии основания с избытком кислотного оксида:
$Ca(OH)_2 + 2CO_2 = Ca(HCO_3)_2$
3. Взаимодействии средней соли с кислотой:
$Ca_3(PO_4)_2 + 4H_3PO_4 = 3Ca(H_2PO_4)_2 $
Получение основных солей:
Для получения основных солей, наоборот, необходимо обеспечить условия, при которых увеличивается концентрация анионов гидроксогруппы $OH^-$. К таким условиям относятся:
1. Гидролиз солей, образованных слабым основанием и сильной кислотой
$ZnCl_2+ H_2O = [Zn(OH)]Cl + HCl$
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
$AlCl_3 + 2NaOH = [Al(OH)_2]Cl + 2NaCl$
3. Взаимодействие солей слабых кислот со средними солями:
$2MgCl_2 + 2Na_2CO_3 + H_2O = [Mg(OH)]_2CO_3 + CO_2 + 4NaCl$
Получение комплексных солей:
Комплексные соли получаются в результате реакций соединения, обмена, окислительно-восстановительных реакций, а также при электролизе:
$HgI_2 + 2KI$ (изб.) = $K_2[HgI_4]$,
$CuSO_4 + 4NH_4OH = [Cu(NH_3)_4]SO_4 + 4H_2O$,
$ZnCl_2 + 4NaOH$ (изб.) = $Na_2[Zn(OH)_4] + 2NaCl$.
Комплексные соли также образуются при взаимодействии солей с лигандами:
$AgCl + 2NH_3 = [Ag(NH_3)_2]Cl$
$FeCl_3 + 6KCN = K_3[Fe(CN)_6] + 3KCl$
Получение двойных солей:
Совместная кристаллизация двух солей:
$Cr_2(SO_4)_3 + K_2SO_4 + 24H_2O = 2[KCr(SO_4)_2 cdot12H_2O] downarrow$
ХИМИЧЕСКИЕ СВОЙСТВА средних солей
1. Термическое разложение.
Карбонаты разлагаются с образованием основного оксида и углекислого газа:
$CaCO_3 = CaO + CO_2$
Нитраты металлов разлагаются с образованием восстановления азотной кислоты до различных продуктов, в зависимости от положения металла в ряду напряжений:

Запомнить! Исключение: $NH_4NO_3 xrightarrow[]{t ^circ C, }N_2O uparrow + 2H_2O$
Соли аммония разлагаются, как правило, с выделением аммиака: $NH_4Cl xrightarrow[]{t ^circ C, } NH_3uparrow + HCl$
Запомнить! Исключения:
$(NH_4)_2Cr_2O_7xrightarrow[]{t ^circ C, } Cr_2O_3 + N_2uparrow + 4H_2O$
$NH_4NO_2 xrightarrow[]{t ^circ C, } N_2uparrow + 2H_2O$
2. Гидролиз.
Более подробно эта тема освещена в разделе “Гидролиз солей”.
$Al_2S_3 + 6H_2O = 2Al(OH)_3 + 3H_2S $
$FeCl_3+ H_2O = Fe(OH)Cl_2 + HCl$
$Na_2S + H2O = NaHS +NaOH$
3. Реакции ионного обмена
Соли могут вступать в обменные реакции с кислотами, основаниями и другими солями в соответствии со следующими правилами:
Определение
1. Соли, образованные более слабой или летучей кислотой, взаимодействуют с более сильными кислотами.
2. Соли реагируют со щелочами, если образуется осадок нерастворимого гидроксида или выделяется газ.
3. Соли взаимодействуют друг с другом в случае образования осадка.
$AgNO_3 + HCl = AgCl downarrow + HNO_3$
$Fe(NO_3)_3 + 3NaOH = Fe(OH)_3 downarrow + 3NaNO_3$
$CaCl_2 + Na_2SiO_3 = CaSiO_3 downarrow + 2NaCl$
$AgCl + 2Na_2S_2O_3 = Nа_3[Ag(S_2O_3)_2] + NaCl$
4. Окислительно-восстановительные реакции,
ОВР, в которые могут вступать соли, обусловленны свойствами катиона или аниона:
$2KMnO_4 + 16HCl = 2MnCl_2 + 2KCl + 5Cl_2 + 8H_2O$
Соли взаимодействуют с более активными металлами, при этом более активный металл стоит в ряду напряжения (ЭХР) левее:

$Zn+ CuSO_4 = Cu + ZnSO_4$
$ZnCl_2 +2Na = 2NaCl + Zn$
В случае, если простое вещество является менее активным металлом (стоит правее металл, входящего в состав соли) замещения не происходит:
$Zn + NaCl ne$
Химические свойства кислых солей:
1. Термическое разложение с образованием средней соли
$Ca(HCO_3)_2 = CaCO_3 + CO_2uparrow + H_2O$
2. Взаимодействие со щёлочью: образование средней соли.
$Ba(HCO_3)_2 + Ba(OH)_2 = 2BaCO_3 + 2H_2O$
Химические свойства основных солей:
1. Термическое разложение:
$[Cu(OH)]_2CO_3 = 2CuO + CO_2 uparrow+ H_2O$
2. Взаимодействие с кислотой: образование средней соли.
$Sn(OH)Cl + HCl = SnCl_2 + H_2O$
Химические свойства комплексных солей:
1. Разрушение комплексов за счёт образования малорастворимых соединений:
$2[Cu(NH_3)_2]Cl + K_2S = CuSdownarrow + 2KCl + 4NH_3uparrow$
2. Обмен лигандами между внешней и внутренней сферами.
$K_2[CoCl_4] + 6H_2O = [Co(H_2O)_6]Cl_2+ 2KCl$
Химические свойства двойных солей:
1. Взаимодействие с растворами щелочей:
$KCr(SO_4)_2 + 3KOH = Cr(OH)_3 + 2K_2SO_4 $
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛЫХ СОЛЕЙ:
1. Термическое разложение с образованием средней соли
$Ca(HCO_3)_2 = CaCO_3 + CO_2uparrow + H_2O$
2. Взаимодействие со щёлочью: образование средней соли.
$Ba(HCO_3)_2 + Ba(OH)_2 = 2BaCO_3 + 2H_2O$
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ СОЛЕЙ:
1. Термическое разложение:
$[Cu(OH)]_2CO_3 = 2CuO + CO_2 uparrow+ H_2O$
2. Взаимодействие с кислотой: образование средней соли.
$Sn(OH)Cl + HCl = SnCl_2 + H_2O$
ХИМИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСНЫХ СОЛЕЙ:
1. Разрушение комплексов за счёт образования малорастворимых соединений:
$2[Cu(NH_3)_2]Cl + K_2S = CuSdownarrow + 2KCl + 4NH_3uparrow$
2. Обмен лигандами между внешней и внутренней сферами.
$K_2[CoCl_4] + 6H_2O = [Co(H_2O)_6]Cl_2+ 2KCl$
ХИМИЧЕСКИЕ СВОЙСТВА ДВОЙНЫХ СОЛЕЙ:
1. Взаимодействие с растворами щелочей:
$KCr(SO_4)_2 + 3KOH = Cr(OH)_3 + 2K_2SO_4 $
Источник
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу сопропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Источник
