На свойстве веществ какая функция основная
Живое вещество играет огромную роль в развитии нашей планеты.
К такому выводу пришёл русский учёный В. И. Вернадский, исследовав состав и эволюцию земной коры. Он доказал, что полученные данные не могут быть объяснены лишь геологическими причинами, без учёта роли живого вещества в геохимической миграции атомов.
Начиная с момента зарождения, жизнь постоянно развивается и усложняется, оказывая воздействие на окружающую среду, изменяя её. Таким образом, эволюция биосферы протекает параллельно с историческим развитием органической жизни.
Время жизни на Земле измеряется примерно (6)–(7) миллиардами лет. Возможно, что примитивные формы жизни появились ещё раньше. Но первые следы своего пребывания они оставили (2,5)–(3) млрд лет назад. С этого времени произошли коренные изменения поверхности планеты и сформировалось до (5) млн видов животных, растений и микроорганизмов. На Земле возникло живое вещество, заметно отличающееся от неживой материи.
Развитие жизни привело к появлению новой общепланетной структурной оболочки биосферы, тесно взаимосвязанной единой системы геологических и биологических тел и процессов преобразования энергии и вещества.
Биосфера — не только сфера распространения жизни, но и результат её деятельности.
Особое место среди живых организмов заняли растения, потому что они обладают способностью к фотосинтезу. Они продуцируют практически всё органическое вещество на планете (растений насчитывается почти (300) тыс. видов).
В. И. Вернадский дал представление об основных биогеохимических функциях живого вещества.
1. Энергетическая функция связана с запасанием энергии в процессе фотосинтеза, передачей её по цепям питания, рассеиванием.
Эта функция — одна из важнейших. В её основе лежит процесс фотосинтеза, в результате которого происходит аккумуляция солнечной энергии и её последующее перераспределение между компонентами биосферы.
Биосферу можно сравнить с огромной машиной, работа которой зависит от одного решающего фактора — энергии: не будь её, всё немедленно остановилось бы.
В биосфере роль основного источника энергии играет солнечное излучение.
Биосфера аккумулирует энергию, приходящую из Космоса на нашу планету.
Живые организмы не просто зависят от лучистой энергии Солнца, они выступают как гигантский аккумулятор (накопитель) и уникальный трансформатор (преобразователь) этой энергии.
Это происходит следующим образом. Растения-автотрофы (и микроорганизмы-хемотрофы) создают органическое вещество. Все остальные организмы планеты — гетеротрофы. Они используют созданное органическое вещество в пищу, что приводит к возникновению сложных последовательностей синтеза и распада органических веществ. Это-то и является основой биологического круговорота химических элементов в биосфере.
Стало быть, живые организмы есть важнейшая биохимическая сила, преобразующая земную кору.
Миграция и разделение химических элементов на земной поверхности, в почве, в осадочных породах, атмосфере и гидросфере осуществляются при непосредственном участии живого вещества. Поэтому в геологическом разрезе живое вещество, атмосфера, гидросфера и литосфера — это взаимосвязанные части единой, непрерывно развивающейся планетарной оболочки — биосферы.
2. Газовая функция — способность изменять и поддерживать определённый газовый состав среды обитания и атмосферы в целом.
Преобладающая масса газов на планете имеет биогенное происхождение.
Пример:
кислород атмосферы накоплен за счёт фотосинтеза.
3. Концентрационная функция — способность организмов концентрировать в своём теле рассеянные химические элементы, повышая их содержание по сравнению с окружающей организмы средой на несколько порядков.
Организмы накапливают в своих телах многие химические элементы.
Пример:
среди них на первом месте стоит углерод. Содержание углерода в углях по степени концентрации в тысячи раз больше, чем в среднем для земной коры. Нефть — концентратор углерода и водорода, так как имеет биогенное происхождение. Среди металлов по концентрации первое место занимает кальций. Целые горные хребты сложены из остатков животных с известковым скелетом. Концентраторами кремния являются диатомовые водоросли, радиолярии и некоторые губки, йода — водоросли ламинарии, железа и марганца — особые бактерии. Позвоночными животными накапливается фосфор, сосредотачиваясь в их костях.
Результат концентрационной деятельности — залежи горючих ископаемых, известняки, рудные месторождения и т. п.
4. Окислительно-восстановительная функция связана с интенсификацией под влиянием живого вещества процессов как окисления благодаря обогащению среды кислородом, так и восстановления прежде всего в тех случаях, когда идёт разложение органических веществ при дефиците кислорода.
Пример:
восстановительные процессы обычно сопровождаются образованием и накоплением сероводорода, а также метана. Это, в частности, делает практически безжизненными глубинные слои болот, а также значительные придонные толщи воды (например, в Чёрном море).
Подземные горючие газы являются продуктами разложения органических веществ растительного происхождения, захороненных ранее в осадочных толщах.
5. Деструктивная функция — разрушение организмами и продуктами их жизнедеятельности как самих остатков органического вещества, так и косных веществ.
Основной механизм этой функции связан с круговоротом веществ. Наиболее существенную роль в этом отношении выполняют низшие формы жизни — грибы, бактерии (деструкторы, редуценты).
6. Транспортная функция — перенос вещества и энергии в результате активной формы движения организмов.
Часто такой перенос осуществляется на колоссальные расстояния, например, при миграциях и кочёвках животных. С транспортной функцией в значительной мере связана концентрационная роль сообществ организмов, например в местах их скопления (птичьи базары и другие колониальные поселения).
7. Средообразующая функция является в значительной мере интегративной (результат совместного действия других функций).
С ней в конечном счёте связано преобразование физико-химических параметров среды. Подробнее о ней см. в разделе «Средообразующая роль живых организмов».
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
https://ecodelo.org
https://lib4all.ru/base/B3337/B3337Content.php
Источник
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
«Вещества и их свойства. Чистые вещества и смеси»
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
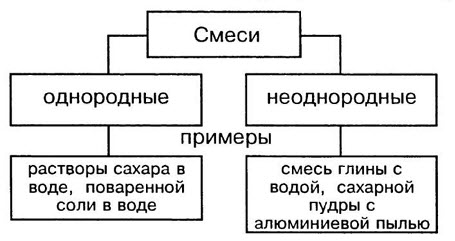
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
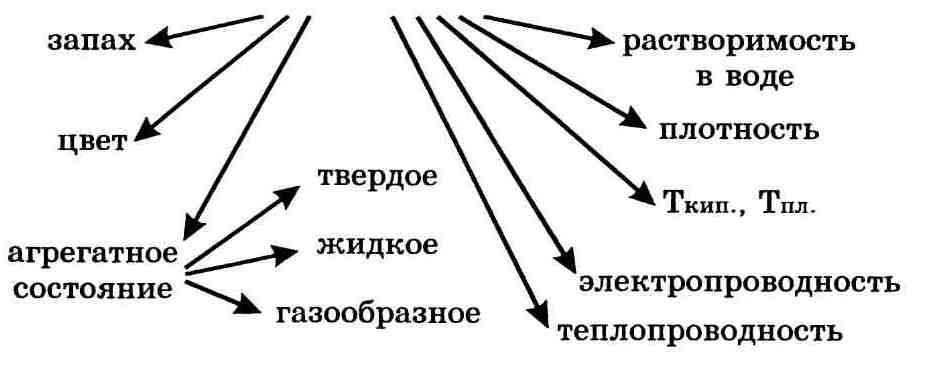
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.

Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
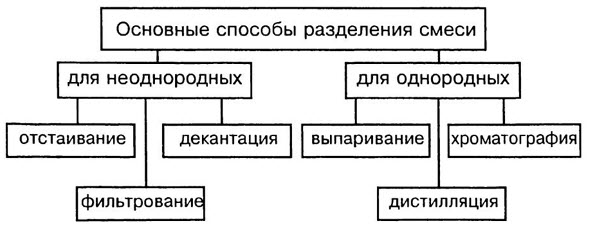
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Следующая тема: «Физические и химические явления».
Источник
