Nh3 какие свойства проявляет

Аммиак – NH3

Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео – Эксперимент ” Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 “Горение аммиака”
Тренажёр №2 “Химические свойства аммиака”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
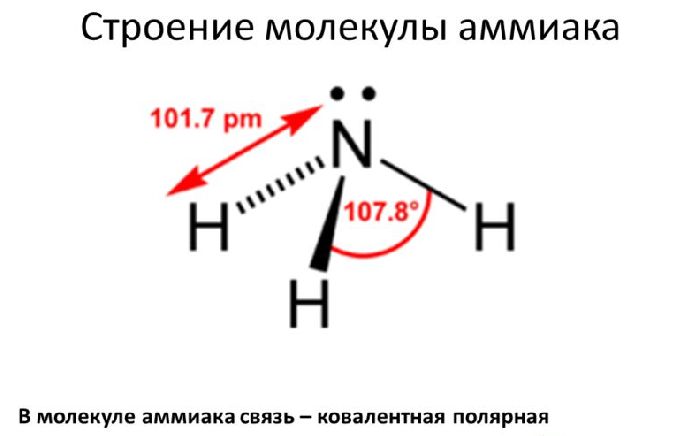
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
Взаимодействие | Продукты реакции | Уравнение |
С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Костя Антонюк
4/5
Александр Котков
5/5
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 374.
Источник
ОПРЕДЕЛЕНИЕ
Аммиак – нитрид водорода.
Формула (
mathrm{NH} 3
). Молярная масса – 17 г / моль.
Физические свойства аммиака
Аммиак ((
mathrm{NH} 3
)) представляет собой бесцветный газ с сильным запахом (запах «аммиака»), более легкий, чем воздух, растворимый в воде (один объем воды растворяется до 700 объемов аммиака). Концентрированный раствор аммиака содержит 25% (масса) аммиака и имеет плотность 0,91 г / см3.
Связи между атомами в молекуле аммиака являются ковалентными. Общий вид молекулы (
mathrm{AB3}
). Все валентные орбитали атома азота входят в гибридизацию, поэтому тип гибридизации молекулы аммиака равен (
mathrm{sp} 3
). Аммиак имеет геометрическую структуру типа (
mathrm{AB3E}
) – тригональную пирамиду (рис.1).
Химические свойства аммиака
Химически аммиак довольно активен: он реагирует со многими веществами. Степень окисления азота в аммиаке «-3» минимальна, поэтому аммиак обладает только снижающими свойствами.
Когда аммиак нагревается с галогенами, оксидами тяжелых металлов и кислородом, образуется азот:
(
2 mathrm{NH} 3+3 mathrm{Br} 2=mathrm{N} 2+6 mathrm{HBr}
)
(
2 mathrm{NH} 3+3 mathrm{CuO}=3 mathrm{Cu}+mathrm{N} 2+3 mathrm{H} 2 mathrm{O}
)
(
4 mathrm{NH} 3+3 mathrm{O} 2=2 mathrm{N} 2+6 mathrm{H} 2 mathrm{O}
)
В присутствии катализатора аммиак может быть окислен до оксида азота (II):
(
4 mathrm{NH} 3+5 mathrm{O} 2=4 mathrm{NO}+6 mathrm{H} 2 mathrm{O}
)(катализатор представляет собой платину)
В отличие от водородных соединений неметаллов групп VI и VII аммиак не проявляет кислотных свойств. Однако атомы водорода в молекуле все еще могут быть замещены атомами металла. При полной замене водорода металлом происходит образование соединений, называемых нитридами, которые также могут быть получены прямым взаимодействием азота с металлом при высокой температуре.
Основные свойства аммиака обусловлены наличием одиночной пары электронов у атома азота. Раствор аммиака в воде имеет щелочную среду:
(
mathrm{NH} 3+mathrm{H} 2 mathrm{O} mapsto mathrm{NH} 4 mathrm{OH} leftrightarrow mathrm{NH} 4++mathrm{OH}-
)
Когда аммиак взаимодействует с кислотами, образуются соли аммония, которые разлагаются при нагревании:
(
mathrm{NH} mathbf{Z}+mathrm{HCl}=mathrm{NH} 4 mathrm{Cl}
)
(
mathrm{NH} 4 mathrm{Cl}=mathrm{NH} 3+mathrm{HCl}
)(при нагревании)
Производство аммиака
Выделяют промышленные и лабораторные методы производства аммиака. В лаборатории аммиак получается при действии щелочей на растворы солей аммония при нагревании:
(
mathrm{NH} 4 mathrm{Cl}+mathrm{KOH}=mathrm{NHZ} uparrow+mathrm{KCl}+mathrm{H} 2 mathrm{O}
)
(
mathrm{NH} 4++mathrm{OH}-=mathrm{NH} 3 uparrow+mathrm{H} 2 mathrm{O}
)
Эта реакция является качественной на ионах аммония.
Применение аммиака
Производство аммиака является одним из важнейших технологических процессов в мире. Ежегодно в мире производится около 100 миллионов тонн аммиака. Выделение аммиака осуществляется в жидкой форме или в виде 25% -ного водного раствора аммиачной воды. Основными направлениями использования аммиака являются производство азотной кислоты (производство азотсодержащих минеральных удобрений), соли аммония, мочевина, гексамин, синтетические волокна (нейлон и нейлон). Аммиак используется в качестве хладагента в промышленном холодильном оборудовании, как отбеливатель при чистке и окрашивании хлопка, шерсти и шелка.
Примеры решения проблем
ПРИМЕР 1
Какова масса и объем аммиака, который потребуется для производства 5 тонн нитрата аммония?
Запишем уравнение для реакции получения нитрата аммония из аммиака и азотной кислоты:
(
mathrm{NH} 3+mathrm{HNO} 3=mathrm{NH} 4 mathrm{NO} 3
)
Согласно уравнению реакции количество вещества нитрата аммония составляет 1 моль-в ((
mathrm{NH} 4 mathrm{NO} 3
)) = 1 моль. Затем масса нитрата аммония, рассчитанная по уравнению реакции:
(
mathrm{m}(mathrm{NH} 4 mathrm{NO} 3)=mathrm{v}(mathrm{NH} 4 mathrm{NO} 3) times mathrm{M}(mathrm{NH} 4 mathrm{NO} 3)
);
(
M(mathrm{NH} 4 mathrm{NO} 3)=1 times 80=80 mathrm{T}
)
Согласно уравнению реакции, количество аммиака также составляет 1 моль-в (NH3) = 1 моль. Затем масса аммиака, рассчитанная по уравнению:
(
(mathrm{NH} 3)=mathrm{v}(mathrm{NH} 3) times mathrm{M}(mathrm{NH} 3)
);
(
(mathrm{NH} 3)=1 times 17=17
)т
Составьте пропорцию и найдите массу аммиака (практический):
(
mathrm{x} text { g } mathrm{NH} 3-,5 ,mathrm{t,} mathrm{NH} 4 mathrm{NO} 3
)
(
17 text { T } mathrm{NH} 3-80; mathrm{T} text { NH4NO } 3
)
(
x=17 times 5 / 80=1,06
)
(
(mathrm{NH} 3)=1,06 mathrm{Т}
)
Аналогичная пропорция будет способствовать обнаружению объема аммиака:
(
1,06; mathrm{г}; mathrm{NH} 3-mathrm{x} 1 mathrm{NH} 3
)
(
17 ;text { T } mathrm{NH} 3-22,4 times 103; mathrm{m3}; mathrm{NH} 3
)
(
x=22,4 times 103 times 1,06 / 17=1,4 times 103
)
(
V;(N H 3)=1,4 times 103; m; 3
)
Аммиачная масса – 1,06 т, объем аммиака – 1,4 × 103 м3
ПРИМЕР 2
Промышленный метод получения аммиака соответствует реакции:
A) (
mathrm{NH} 40 mathrm{H}=mathrm{NH} 3 quad uparrow+mathrm{H} 20
)
Б) (
mathrm{NH} 4 mathrm{Cl}=mathrm{NH} 3 uparrow+mathrm{HCl} uparrow
)
B) (
mathrm{N} 2;+3; mathrm{H} 2 text { & bull; } 2 mathrm{NH} 3
)
Г)(
mathrm{NH}_{4} mathrm{Cl}+mathrm{NaOH}=mathrm{NH}_{3} uparrow+mathrm{H}_{2} mathrm{O}+mathrm{NaCl}
)
Реакция «в» соответствует промышленному методу получения аммиака
Источник
