Области применения кислорода на каких свойствах кислорода они основаны

Кислород – химический элемент VI группы периодической системы Менделеева и самый распространенный элемент в земной коре (47% от ее массы). Кислород является жизненно важным элементом почти всех живых организмов. Более подробно о функциях и применении кислорода в этой статье.

Общие сведения
Кислород представляет собой бесцветный газ без вкуса и запаха, который плохо растворяется в воде. Он входит в состав воды, минералов, горных пород. Свободный кислород образуется благодаря процессам фотосинтеза. Кислород играет наиважнейшую роль в жизни человека. Прежде всего кислород необходим для дыхания живых организмов. Также он принимает участие в процессах разложения погибших животных и растений.
Воздух содержит около 20,95% по объему кислорода. В гидросфере содержится почти 86% по массе кислорода.
Кислород был получен одновременно двумя учеными, но сделали они это независимо друг от друга. Швед К. Шееле получил кислород при прокаливании селитры и других веществ, а англичанин Дж. Пристли – при нагревании оксида ртути.

Рис. 1. Получение кислорода из оксида ртути
Применение кислорода в промышленности
Области применения кислорода обширны.
В металлургии он необходим для производства стали, которую получают из металлолома и чугуна. Во многих металлургических агрегатах для лучшего сжигания топлива используют воздух, обогащенный кислородом.
В авиации кислород используется как окислитель топлива в ракетных двигателях. Также он необходим для полетов в космос и в условиях, где нет атмосферы.
В области машиностроения кислород очень важен для резки и сварки металлов. Чтобы расплавить металл нужна специальная горелка, состоящая из металлических труб. Эти две трубы вставляются друг в друга. Свободное пространство между ними заполняют ацетиленом и зажигают. Кислород же в это время пускают по внутренней трубке. И кислород и ацетилен подаются из баллона под давлением. Образуется пламя, температура в котором достигает 2000 градусов. При такой температуре плавится практически любой металл.

Рис. 2. Ацетиленовая горелка
Применение кислорода в целлюлозно-бумажной промышленности очень важно. Он используется для отбеливания бумаги, при спиртовании, при вымывании лишних компонентов из целлюлозы (делигнификация).
В химической промышленности кислород используется в качестве реагента.
Для создания взрывчатых веществ необходим жидкий кислород. Жидкий кислород производится путем сжижения воздуха и последующего отделения кислорода от азота.
Применение кислорода в природе и жизни человека
Кислород играет наиважнейшую роль в жизни человека и животных. Свободный кислород существует на нашей планете благодаря фотосинтезу. Фотосинтез – это процесс образования органического вещества на свету с помощью углекислого газа и воды. В результате этого процесса образуется кислород, который необходим для жизнедеятельности животных и человека. Животные и человек потребляют кислород постоянно, растения же расходуют кислород только ночью, а днем производят его.
Применение кислорода в медицине
Кислород находит применение и в медицине. Особенно актуально его использование при затрудненном дыхании во время некоторых заболеваний. Он применяется для обогащения дыхательных путей при туберкулезе легких, а также используется в наркозной аппаратуре. Кислород в медицине используется для лечения бронхиальной астмы, болезней желудочно-кишечного тракта. Для этих целей используют кислородные коктейли.
Также большое значение имеют кислородные подушки – прорезиненная емкость, заполненная кислородом. Она служит для индивидуального применения медицинского кислорода.
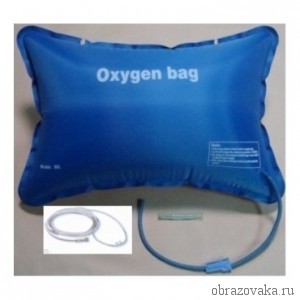
Рис. 3. Кислородная подушка
Что мы узнали?
В данном сообщении, которое охватывает тему «Кислород» по химии 9 класса кратко даны общие сведения о свойствах и применении этого газа. Кислород крайне важен для машиностроения, медицины, металлургической области и т.д.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Лидия Маслова
10/10
Тимофей Кот
10/10
Эльшан Асланов
9/10
Александр Джураев
9/10
Любовь Жовтенко
9/10
Андрей Бордюгов
9/10
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 455.
Источник

Области применения кислорода в промышленности и сельском хозяйстве
Кислород — одно из самых широко используемых веществ, которое находит применение практически во всех областях человеческой деятельности.
Металлургическая промышленность.
Именно высокая эффективность использования кислорода в металлургии стала толчком к развитию воздухоразделения. Металлургия и в настоящее время является основным потребителем кислорода в промышленности. Так, именно с кислородом связано развитие важнейшего направления в сталеплавлении – конвертерной выплавки стали.
Кислород применяется в процессах:
Производство чугуна и стали (удаление избытка углерода).
Конвертерное производство стали.
Электросталеплавильное производство.
Кислородное дутье в доменных печах.
Производство ферросплавов.
Выплавка никеля, цинка, свинца, циркония и других цветных металлов.
Интенсификация процессов обжига сырья в цветной металлургии.
Прямое восстановление железа.
Химическая и нефтехимическая промышленность.
Кислородное оборудование востребовано в химической промышленности, так как кислород необходим при получении искусственного жидкого топлива, смазочных масел, азотной и серной кислот, метанола, аммиака и аммиачных удобрений, перекисей металлов и др. химических продуктов. В нефтегазовой промышленности применяется для более эффективной работы НПЗ – для увеличения производительности заводов по крекингу нефти.
Энергетика.
Что касается энергетики, то здесь кислород необходим для газификации твердого топлива, сжатия твердо-угольной смеси, а также для того, чтобы обогащать воздух для промышленных котлов.
В строительстве и машиностроении.
Кислородо-ацетиленовая газорезка и газосварка металлов, плазменный раскрой металлов и пайка, напыление и наплавка металлов – это одно из самых важных и распространенных областей применения кислорода с машиностроении и строительстве.
Золото- и нефтедобыча.
Добыча добыче драгоценных металлов из руд, термическое бурение твердых пород, также кислород применяется при аффинаже золота. В нефтедобыче применяется закачка кислорода в пласт для увеличения энергии вытеснения, кроме того, для создания эффективно перемещающегося внутри пласта очага горения.
Стекольная промышленность.
Кислород позволяет повысить температуру в печах и улучшить процесс горения, уменьшить выбросы окислов азота и твердых частиц из стекловаренных печей, тем самым увеличить производительность производства.
При производстве стеклоизделий кислород подается на газовые горелки, которые используются для отрезания некондиционной части изделия, оплавления кромок и огневой полировки поверхности для оплавления микродефектов.
Кислород необходим при выдувке стекла, на фабриках медицинского и лабораторного стекла, при производстве электрических лампочек.
Экология.
Кислород применяется в процессах:
Для повышения эффективности работы озонаторных установок – озонирование для водоподготовки, очистки сточных вод, отбеливания целлюлозы и т. д.
Утилизация отходов- при обезвреживании (окислении) химически активных отходов в очистных установках в мусоросжигательных печах с кислородным дутьём.
При очистке питьевой воды.
При вторичной переработке металлов.
Сельское хозяйство.
Кислород используются в рыбных хозяйствах для увеличения выживаемости и выхода потомства при выращивании рыбы, раков, креветок, мидий.
Поделитесь
Источник
Кислород

Кислород — самый распространенный элемент земной коры, входит в состав более 1500 соединений земной коры. Общее количество кислорода в земной коре близко к половине ее массы (около 47%).
В свободном состоянии кислород находится в атмосферном воздухе, содержание свободного кислорода составляет 20,95 % (по объёму). В связанном виде входит в состав воды, морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), минералов, горных пород и всех веществ, из которых построены организмы растений и животных.
Кислород играет исключительно важную роль в природе. При участии кислорода совершается один из важнейших жизненных процессов — дыхание. Важное значение имеет и другой процесс, в котором участвует кислород, — тление и гниение погибших животных и растений; при этом сложные органические вещества превращаются в более простые (в конечном результате в CO2, воду и азот), а последние вновь вступают в общий круговорот веществ в природе. Кислород является необходимым для обеспечения жизни и легко соединяется с другими элементами.
В настоящее время в промышленности кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Основным лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода.
Свойства кислорода
Кислород (O2) – бесцветный газ без вкуса и запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1 л воздуха 1,293 г. Растворим в воде, хотя и в небольших количествах: 100 объемов воды при 0°C растворяют 4,9, а при 20°C — 3,1 объема кислорода. Температура кипения – минус 183,0°C, температура плавления – минус 218,8°C. Плотность Р при 200°C составляет 1061,45 мг/м3. Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500°C она становится заметной.
Жидкий кислород не имеет запаха, по цвету голубой и кипит при -183°С. Один литр жидкого кислорода дает около 840 литров газообразного кислорода.
Области применения кислорода
Широкое промышленное применение кислорода началось в середине ХХ века, после изобретения турбодетандеров — устройств для сжижения и разделения.
Применение кислорода весьма разнообразно и основано на его химических свойствах. В больших количествах кислород используют для ускорения химических реакций в разных отраслях химической промышленности и в металлургии. Например, при выплавке чугуна для повышения производительности доменных печей в них подают воздух, обогащенный кислородом. Его применяют для интенсификации химических процессов во многих производствах (например, в производстве серной и азотной кислот, в доменном процессе). Кислородом пользуются для получения высоких температур, для чего различные горючие газы (водород,ацетилен) сжигают в специальных горелках. Кислород используют в медицине при затрудненном дыхании.
При сжигании ацетилена или водорода с кислородом в специальных горелках температура пламени достигает 3000°C. Кислород — важнейший продукт основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали), газификации природного угля, сварке и резке металлов. Жидкий кислород — окислитель топлива в ракетной технике. Технический жидкий кислород применяется после его газификации газопламенной обработки металлов и других технических целей.
Химическая и нефтехимическая промышленность
Кислород используется для окисления исходных реагентов, образуя азотную кислоту, этиленоксид, пропиленоксид, винилхлорид и другие основные соединения. Помимо этого он может использоваться для увеличения производительности мусоросжигательных печей.
Нефтегазовая промышленность
В нефте- и газодобыче кислород находит применения для увеличения вязкости и улучшения нефтегазового потока из колодцев. Кислород используется для увеличения производительности заводов по крекингу нефти, для более эффективной переработки высокооктановых компонент, для уменьшения серных отложений на НПЗ.
Металлургия
Кислород используется для увеличения температуры горения при производстве черных и цветных металлов, дутье в доменных печах, извлечении золота из руд, производстве ферросплавов, выплавке никеля, цинка, свинца, циркония и других цветных металлов, для создания высокотемпературного пламени в сварочных горелках при резке и пайке металла, для напыления и наплавки металлов кислородном. Конвертерный способ производства стали связан с применением кислорода.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов, для плазменного
высокоточного раскроя металлов;
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и
другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей
ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород — фтор и
водород — фторид кислорода).
Стекольная промышленность
В стекловаренных печах кислород используется для улучшения горения. Кроме этого он применяется для
уменьшения выбросов оксидов азота до безопасных уровней.
Целлюлозно-бумажная промышленность
Кислород используется при делигнификации, спиртовании и других процессах.
Медицина
Кислород используется для обогащения дыхательных смесей при нарушении дыхания, для лечения астмы,
в виде кислородных коктейлей и в других случаях.
Хранение и перевозка кислорода
Технический газообразный кислород хранят и перевозят в стальных баллонах (ГОСТ 949-73) голубого цвета.
Перевозка баллонов осуществляется всеми видами транспорта в соответствии с правилами перевозки опасных грузов,
действующими на данном виде транспорта. Технический жидкий кислород перевозят в специализированных транспортных
цистернах с нанесённой на них синей полосой и надписью «кислород». Криогенные сосуды, наполненные жидким кислородом,
перевозят только автомобильным транспортом.
Опасные факторы и меры безопасности
Кислород не оказывает вредного воздействия на окружающую среду. Не токсичен, не горюч и не взрывоопасен, однако, являясь сильным окислителем, увеличивает способность материалов к горению. Многие несгораемые при нормальном воздухе материалы могут гореть в чистом кислороде или в воздухе, богатом кислородом. При взаимодействии со смазочными веществами – взрывается. Во избежание взрывов необходимо защищать кислородные баллоны от нагрева. Запрещено курить и пользоваться открытым огнем вблизи работы с кислородом.
Когда жидкий кислород испаряется, испарившийся газ имеет очень низкую температуру и плотность тяжелее воздуха. Поэтому он может накапливаться, например, в канализации и вызвать повышенную концентрацию кислорода в воздухе. Жидкий кислород и холодные пары кислорода могут вызвать обморожение кожи с травмами, подобными ожогам. Попадание открытых участков кожи в контакт с неизолированными узлами может вызвать прилипание кожи и повреждение при попытке отрыва. В таком случае поврежденные участки нужно обильно поливать теплой водой и ни в коем случае не протирать кожу. Обращаться к медперсоналу. Длительная ингаляция газообразного кислорода вызывает поражение органов дыхания и легких.
Там, где обращаются с жидким кислородом, необходимо исключить попадание кислорода в соприкосновение с неподходящими материалами, например, сталью, которая становится хрупкой при низкой температуре, и автомобильной резиной. Определенные марки стали, в т.ч. углеродистая сталь и некоторые другие материалы непригодны для использования при низких температурах, так как они теряют свою ударостойкость и становятся очень хрупкими. Обычно при низких температурах можно использовать нержавеющую сталь, алюминий и медь, а также их сплавы.
При работе с жидким кислородом необходимо употреблять надлежащие перчатки, защитные очки, защитную обувь и защитные средства для тела. Инструмент и одежда должны быть свободными от масла и жира. Ни один узел, применяемый с кислородом, не должен соприкасаться с маслом или жиром. Посторонние лица не должны заходить в зоны с повышенной концентрацией кислорода в воздухе. После работы в помещении с повышенной концентрацией кислорода в воздухе необходимо хорошо проветрить одежду.
Источник
Цель урока: изучить физические и химические
свойства кислорода, дать общее понятие об
оксидах, реакциях горения; рассмотреть
практическую значимость и применение; доказать,
что кислород – один из важнейших элементов на
Земле.
Задачи урока:
Образовательные:
- Расширить представления обучающихся о
кислороде. - Познакомить со свойствами и применением
кислорода. - Совершенствовать умения составлять уравнения
химических реакций.
Воспитательные:
- Формировать умения работать в парах у каждого
обучающегося, считаться с мнением соседа и
отстаивать свою точку зрения корректно, выполняя
упражнения. - Воспитывать бережное отношение к своему
здоровью, окружающей природе, учить понимать
прекрасное, ценить произведения искусства.
Развивающие:
- Способствовать продолжению развития
устойчивого интереса к химической науке и
практике. - Совершенствовать навыки самостоятельной
работы, развивать умения наблюдать,
формулировать высказывания. - Способствовать развитию исследовательских
навыков, соблюдая правила техники безопасности. - Совершенствовать умения обобщать и делать
выводы.
Планируемые результаты:
- личностные: готовность и способность
учащихся к саморазвитию, самоопределению;
ответственное отношение к учению; способность
ставить цели и строить жизненные планы;
формирование коммуникативной культуры, ценности
здорового и безопасного образа жизни; - метапредметные: уметь ставить цель и
планировать пути её достижения, выбирая более
рациональные способы решения данной проблемы;
учиться корректировать свои действия в связи с
изменением создавшейся ситуации; уметь
создавать, применять и преобразовывать знаки и
символы, модели и схемы для решения учебных и
познавательных задач; уметь осознанно
использовать речевые средства в соответствии с
задачей коммуникации для выражения своих мыслей
и потребностей; уметь организовывать совместную
работу со сверстниками в парах; уметь находить
информацию в различных источниках; владеть
навыками самоконтроля, самооценки; - предметные:
- знать: основные химические понятия
“катализаторы”, “оксиды”, “реакции горения”,
“реакции окисления”; физические и химические
свойства кислорода; области применения
кислорода. - уметь: отличить кислород от других газов;
составлять уравнения реакций горения веществ в
кислороде; записывать химические формулы
оксидов и давать им названия; объяснять, как
происходит круговорот кислорода в природе.
- знать: основные химические понятия
Тип урока: урок формирования умений и навыков.
Форма работы: фронтальная,
групповая,
работа в парах, игровая.
Методы обучения: словесный,
частично-поисковый,
наглядный, демонстрационный, интерактивный.
Приемы обучения: постановка проблемных
вопросов.
Оборудование: компьютер, проектор,
презентация “Свойства и применение кислорода.
Круговорот кислорода в природе”, колбы, пинцет,
ложки для сжигания веществ, спиртовка.
Реактивы: уголь, сера, красный фосфор,
железная пластина, вода, известковая вода.
ХОД УРОКА
І. Организационный момент. (1 мин.)
(Слайд № 1)Учитель: Добрый день! Прошу
всех садиться. Тема сегодняшнего урока
“Свойства и применение кислорода”.
(Слайд № 2) Мы с вами рассмотрим физические и
химические свойства кислорода, сформулируем
общие понятия об оксидах, реакциях горения,
окисления; ознакомимся с практической
значимостью и применением кислорода; а также
докажем, что кислород – один из важнейших
элементов на Земле.
ІІ. Актуализация знаний. (7 мин.).
Работа с карточками. От 2 до 4 обучающихся
получают задание на карточках и выполняют его у
доски.
(Слайд № 3) Фронтальный опрос “А ну-ка,
химики”.
Учитель: Но перед тем как приступить к
изучению новой темы, вам следует ответить на
следующие вопросы:
Химический знак кислорода? Ответ: О
Относительная атомная масса кислорода? Ответ:
16.
Химическая формула кислорода? Ответ: О2.
Относительная молекулярная масса кислорода? Ответ:
32.
В соединениях кислород обычно какой
валентности? Ответ: II.
Расскажите о нахождении кислорода в природе. Ответ:
Кислород — самый распространенный химический
элемент в земной коре. Кислород — самый
распространенный на Земле элемент, на его долю
приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное
количество связанного кислорода — 85,5% (по
массе), в атмосфере содержание свободного
кислорода составляет 21% по объёму и 23% по массе.
Более 1500 соединений земной коры в своем составе
содержат кислород. Кислород входит в состав
многих органических веществ и присутствует во
всех живых клетках. По числу атомов в живых
клетках он составляет 20,9%, по массовой доле —
около 65 %.
Перечислите способы получения кислорода в
лаборатории? Ответ: В лаборатории
кислород получают следующими способами:
1) Разложение перманганата калия. 2KMnO4 =
K2MnO4+MnO2+O2
2) Разложение перекиси водорода. 2H2O2
= 2H2O + O2
3) Разложение бертолетовой соли. 2KClO3 =
2KCl + 3O2
8. Перечислите способы получения кислорода в
промышленности. Ответ: В промышленности
кислород получают:
1) Электролиз воды. 2H2O = 2H2 + O2
2) Из воздуха. ВОЗДУХ давление, -183oC=O2
(голубая жидкость).
В настоящее время в промышленности кислород
получают из воздуха. В лабораториях небольшие
количества кислорода можно получать нагреванием
перманганата калия (марганцовка) KMnO4.
Кислород мало растворим в воде и тяжелее воздуха,
поэтому его можно получать двумя способами:
(Слайд № 4). 9. Установите соответствие
между способом получения кислорода и уравнением
химической реакцией. Работа в парах.
| Способы получения кислорода | Уравнения химических реакций |
| А. Разложение перманганата калия. Б. В. Разложение бертолетовой соли. Г. Электролиз воды. Д. Из воздуха. | 1) 2KClO3 = 2KCl + 3O2 2) 2H2O2 = 2H2O + O2 3) ВОЗДУХ = O2 4) 2KMnO4 = K2MnO4 + MnO2 + O2 5) 2H2O = 2H2 + O2 |
Ответ: А-4; Б-2; В-1; Г-5; Д-3.
10. Что называют катализаторами? Где эти
вещества применяются? Ответ: Вещества,
которые ускоряют химические реакции, но сами при
этом не расходуются, называют катализаторами.
Катализаторы широко применяют в химической
промышленности. С их помощью удается повысить
производительность химических процессов,
снизить себестоимость выпускаемой продукции и
более полно использовать сырье.
(Слайд № 5). На какой диаграмме распределение
массовых долей элементов отвечает
количественному составу (NH4)3PO4? Ответ:
4.
ІІІ. Изучение нового материала. (12 мин.)
(Слайд № 6) Учитель: Физические свойства. Кислород
– бесцветный газ, без вкуса и запаха, относительно
малорастворим в воде (в 100 объемах воды при
температуре 20?С растворяется 3,1 объема
кислорода). Кислород немного тяжелее воздуха: 1л
кислорода при нормальных условиях весит 1,43 г, а 1л
воздуха — 1,29г. (Нормальные условия – сокращенно:
н.у. – температура 0oС и давление 760 мм.рт.ст.,
или 1 атм. 0,1 МПа). При
давлении 760 мм.рт.ст. и температуре -183oС
кислород сжижается, а при снижении температуры
до -218,8oС затвердевает.
(Слайд № 7) Химические свойства. Техника
безопасности (провести инструктаж!)
Кислород при нагревании энергично реагирует
со многими веществами, при этом выделяются
теплота и свет. Такие реакции называют реакциями
горения. Если опустить в сосуд с кислородом O2
тлеющий уголек, то он раскаляется добела и
сгорает, образуя оксид углерода (IV) СO2.
Чтобы определить, какое образовалось вещество, в
сосуд наливают известковую воду — раствор
гидроксида кальция Са(ОН)2. Она мутнеет, так
как при этом образуется нерастворимый карбонат
кальция СаСO3:
CO2 + Ca(OH)2 = CaCO3 + H2O
Видеодемонстрация №1 “Горение угля в
кислороде”
https://files.school-collection.edu.ru/dlrstore/695aa82a-e84a-fa4d-7b04-16d28ded2fbb/index.htm
(Слайд № 8) Сера горит в O2 ярким синим
пламенем с образованием газа с резким запахом —
оксида серы (IV)
S + O2 = SO2
Видеодемонтсрация №2 “Горение серы в
кислороде”
https://files.school-collection.edu.ru/dlrstore/600cd365-f9f2-ae10-56e4-98ee0af7e4c6/index.htm
(Слайд № 9) Горение фосфора в кислороде
Видеодемонстрация №3 “Горение фосфора в
кислороде”
https://files.school-collection.edu.ru/dlrstore/f83beda5-449d-d3dc-442c-a474a89eeca6/index.htm
Опыт следует проводить под тягой. Следует
соблюдать правила обращения с нагревательными
приборами. Не допускать попадания горящего
фосфора на рабочую поверхность стола. Не вдыхать
выделяющийся дым фосфорного ангидрида.
Фосфор Р сгорает в O2 ярким пламенем с
образованием белого дыма, состоящего из твердых
частиц оксида фосфора (V).
4P + 5O2 = 2P2O5
(Слайд № 10) Горение железа в кислороде
Видеодемонстрация №4 “Горение железа в
кислороде”
https://files.school-collection.edu.ru/dlrstore/deb6e939-f8c8-fea7-fe24-7b2c80013fd7/index.htm
В кислороде горят и такие вещества, которые
обычно считают негорючими, например железо. Если
к тонкой стальной проволоке прикрепить спичку,
зажечь ее и опустить в сосуд с кислородом, то от
спички загорится и железо. Горение железа
происходит с треском и разбрасыванием ярких
раскаленных искр — расплавленных капель
железной окалины Fe3O4. В этом соединении два атома
железа трехвалентны и один двухвалентен. Поэтому
реакцию горения железа в кислороде можно
выразить следующим уравнением:
3Fe + 2O2 = FeO * Fe2O3 или Fe3O4
(Слайд № 11) Взаимодействие вещества с
кислородом относится к реакциям окисления.
(Слайд № 12) Горение — это химическая реакция,
при которой происходит окисление веществ с
выделением теплоты и света.
(Слайд № 13) В большинстве случаев при
взаимодействии веществ с кислородом образуются
оксиды.Оксиды — это сложные вещества,
которые состоят из двух элементов, одним из
которых является кислород.
(Слайд № 14) Известны химические элементы,
которые непосредственно с кислородом не
соединяются. К ним относятся золото Au и некоторые
другие. Оксиды этих элементов получают косвенным
путем.
(Слайд № 15) Применение кислорода. Основано
на его химических свойствах. В больших
количествах кислород используют для ускорения
химических реакций в разных отраслях химической
промышленности и в металлургии. Например, при
выплавке чугуна для повышения
производительности доменных печей в них подают
воздух, обогащенный кислородом.
(Слайд № 16) При сжигании смеси ацетилена или
водорода с кислородом в специальных горелках
температура пламени достигает 3000oС. Такое
пламя используется для сварки металлов. Если
берут кислород в избытке, то пламенем можно
резать металл.
(Слайд № 17) Жидкий кислород применяют в
ракетных двигателях.
(Слайд № 18) В медицине кислород служит для
облегчения затрудненного дыхания. В этом случае
кислородом заполняют специальные подушки.
Кислородные маски необходимы в высотных полетах,
в космосе и при работе под водой.
Кислород расходуется в громадных количествах
на многие химические реакции, например на
сжигание топлива.
(Слайд № 19) Из сказанного видно, что очень
много кислорода расходуется на разнообразную
деятельность человека, тратится на процессы
дыхания человека, животных, растений, а также на
процессы гниения. Человек при дыхании в течение 1
мин в среднем употребляет 0,5 дм3 кислорода,
в течении суток — 720 дм3, а в год — 262,8 м3
кислорода, что все жители земного шара (5
миллиардов) в течение года для дыхания
используют 1578 миллиардов кубических метров
кислорода. Если такой объем кислорода при
нормальном давлении поместить в железнодорожные
цистерны, то поезд был бы протяженностью более 300
млн км, что равняется расстоянию до Солнца и
обратно.
(Слайд № 20) Но все же общая масса кислорода в
воздухе заметно не изменяется. Это объясняется
процессом фотосинтеза, происходящим в зеленых
растениях на свету. В результате этого процесса
выделяется кислород. С фотосинтезом вы уже
знакомились в курсе ботаники. Упрощенно процесс
фотосинтеза изображают так:
6CO2 + 6H2O = C6H12O6
+ 6O2.
Так в природе происходит непрерывный
круговорот кислорода.
В целях сохранения кислорода в воздухе вокруг
городов и крупных промышленных центров
создаются зоны зеленых насаждений. Специальная
служба систематически контролирует содержание
кислорода в воздухе. При необходимости применяют
меры по устранению загрязнения воздуха.
Физкультминутка. (1 мин.)
IV. Закрепление знаний. (6 мин.)
(Слайд № 21) Задание №1. “Правда или ложь? Если
знаешь – разберешь”
Для кислорода верны следующие утверждения:
а) Кислород – бесцветный газ, без вкуса и
запаха.
б) Кислород немного легче воздуха.
в) В кислороде горят и такие вещества, которые
обычно считают негорючими, например железо.
г) Известны химические элементы, которые
непосредственно с кислородом соединяются. К ним
относятся золото Au и некоторые другие.
д) Применение кислорода основано на его
физических свойствах.
е) Непрерывный круговорот кислорода
непосредственно связан с таким процессом, как
фотосинтез.
Ответ: а; в; е.
(Слайд № 22) Задание №2. “Скорая помощь”
Вставьте пропущенные вещества в уравнениях
реакций:
а) …….. + Ca(OH)2 = CaCO3 + H2O
б) S + ……. = SO2
в) ….. + 2O2 = FeO * Fe2O3 или Fe3O4
Ответ: а)CO2 б)O2 в) 3Fe
(Слайд № 23) Задание №3. “Мозговой штурм”
Расставьте коэффициенты в уравнениях реакций.
а) CO2 + H2O = C6H12O6 + O2
б) P + O2 = P2O5
(Слайды № 24-25) Задание №4. “Ассоциации”
С каким применением кислорода ассоциируется
данное изображение?
1) в металлургии;
2) для резки металлов;
3) в авиации для дыхания;
4) в авиации для двигателей;
5) для сварки металлов;
6) на взрывных работах;
7) в медицине.
(Слайд № 26) V. Домашнее задание. (1 мин.)
Параграф 20, 21; №6-9 (с.60). Решите задачи 1-2 (с.60).
Творческое задание: подготовить сообщение
№10 с. 60 “Что делается в вашей местности для
поддержания определенного содержания кислорода
в воздухе? В чем может заключаться ваше участие в
этой деятельности?”
(Слайд № 27) VI. Рефлексия. (1 мин.)
Учитель:
- Сегодня я узнал…
- было трудно…
- я понял, что…
- я научился…
- я смог…
- было интересно узнать, что…
- меня удивило…
- мне захотелось…
VII. Подведение итогов урока. (1 мин.)
(Слайд № 28)
В чём горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без….
Обучающиеся: кислорода
(Слайд № 29) Учитель: Правильно. Спасибо за
урок! До свидания!
Литература
[1] Горковенко М. Ю. Поурочные разработки по
химии 8 класс к учебникам О. С. Габриеляна, Л. С.
Гузея, Г. Е. Рудзитиса. – М: “ВАКО”, 2004;
[2] Радецкий А. М., Горшкова В. П. Дидактический
материал: химия 8-9 классы — М: Просвещение, 1997.
[3] Химия: неорганическая химия: учебник для 8
класса общеобразовательных учреждений/ Г. Е.
Рудзитис, Ф.Г. Фельдман. – М: “Просвещение”, 2014 г.
Интернет-ресурсы
- https://files.school-collection.edu.ru/
- https://www.e-osnova.ru/
Источник
