Оксид азота 2 это какой оксид химические свойства

Уравнения окислительно-восстановительных реакций оксидов азота…
Азот образует несколько оксидов:
- солеобразующие оксиды:
- N2O3 – оксид азота (III)
- NO2 – оксид азота (IV)
- N2O4 – димер оксида азота (IV)
- N2O5 – оксид азота (V)
- несолеобразующие оксиды:
- N2O – оксид азота (I)
- NO – оксид азота (II)
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Оксид азота N2O (I)
Строение молекулы линейное:
– +
N=N=O
N2O (I) – бесцветный газ со слабым запахом и сладковатым вкусом.
- растворяется в воде, но не реагирует с ней;
- разлагается при слабом нагревании:
2N2O → 2N2+O2 - реагирует с водородом со взрывом:
N2O+H2 → N2+H2O - получают разложением нитрата аммония:
NH4NO3 → N2O+2H2O - применяют в смеси с кислородом в качестве “веселящего газа”, как средство общего наркоза в медицине, а также для получения азидов:
N2O+NaNH2 → NaN3+H2O
Оксид азота NO(II)
Молекула имеет вид:
·N=O
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
- Бесцветный газ, без запаха.
- Малорастворим в воде.
- Легко окисляется на воздухе с образованием диоксида азота:
2NO+O2=2NO2. - Взаимодействует с другими окислителями (CrO3,Cl2, KMnO4).
- Реагирует с активными металлами, водородом:
K+NO=KNO
2NO+2H2=N2+2H2O
NO(II) содержится в выхлопных газах автомобилей с двигателями внутреннего сгорания – проходя через каталитический конвертор, состоящий из нагретых до высокой температуры керамических ячеек, оксиды азота восстанавливаются, а СО окисляется:
2NO+2CO → N2+2CO2
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
В промышленных целях NO(II) получают каталитическим окислением аммиака (в роли катализатора используется платина):
4N-3H3+5O20 → 4N+2O-2+6H2O
В лабораторных условиях NO(II)получают действием разбавленной азотной кислотой на медь:
3Cu0+8HN+5O3 = 3Cu+2(NO3)2+2N-2O↑+4H2O
Монооксид азота используют для получения азотной кислоты.
Оксид азота N2O3(III)
Строение молекулы:
Связь N+-O- образована по донорно-акцепторному механизму.
Оксид азота N2O3(III) при н.у. является темно-синей жидкостью. При низких температурах (ниже -100°C) кристаллизуется.
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Соли азотистой кислоты – нитриты NaNO2, KNO2 являются устойчивыми соединениями, проявляя, как кислотные, так и восстановительные свойства, поскольку атом азота в них имеет “среднее” значение степени окисления (+3).
Оксид азота NO2(IV)
Строение молекулы:
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный “полуторный” характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
Оксид азота NO2(IV) – смешанный оксид, ему соответствуют две кислоты: азотистая и азотная, поэтому, реакция взаимодействия с водой имеет следующий вид:
2N+4O2+H2O = HN+3O2+HN+5O3
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
На воздухе NO2 взаимодействует с водой с образованием только азотной кислоты:
4N+4O2+O20+2H2O ↔ 4HN+5O3-2
Оксид азота NO2(IV) взаимодействует с растворами щелочей с образованием воды и двух солей – нитрата и нитрита:
2N+4O2+2NaOH = NaN+3O2+NaN+5O3+H2O
В избытке кислорода образуется только нитрат натрия:
4N+4O2+4NaOH+O20 = 4NaN+5O3-2+2H2O
При температуре ниже 22°C молекулы оксида азота NO2(IV) легко соединяются попарно (димеризуются), в результате чего образуется бесцветная жидкость, превращающаяся в кристаллы при дальнейшем охлаждении до температуры ниже -10,2°C.
В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
Оксид азота N2O5(V)
Строение молекулы:
Связи N+-O- образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
- Аммиак
- Азотная кислота
Источник
Оксиды азота
При описании свойств азота отмечалось, что при непосредственном взаимодействии азота с кислородом образуется только оксид азота (II) NO. Однако существуют оксиды азота со всеми возможными степенями окисления (от +1 до +5).
N2O – оксид азота (I), «веселящий газ»
При обычной температуре N2O – бесцветный газ со слабым приятным запахом и сладковатым вкусом; обладает наркотическим действием, вызывая сначала судорожный смех, затем – потерю сознания.
Способы получения
1. Разложение нитрата аммония при небольшом нагревании:
NH4NO3 = N2O↑ + 2Н2О
2. Действие HNO3 на активные металлы
10HNO3(конц.) + 4Са = N2O↑ + 4Ca(NO3)2 + 5Н2О
Химические свойства
N2O не проявляет ни кислотных, ни основных свойств, т. е. не взаимодействует с основаниями, с кислотами, с водой (несолеобразующий оксид).
При Т > 500’С разлагается на простые вещества. N2O – очень сильный окислитель. Например, способен в водном растворе окислить диоксид серы до серной кислоты:
N2O + SO2 + Н2О = N2↑ + H2SO4
NO – оксид азота (II), монооксид азота.
При обычной температуре NO – бесцветный газ без запаха, малорастворимый в воде, очень токсичный (в больших концентрациях изменяет структуру гемоглобина).
Способы получения
1. Прямой синтез из простых веществ может быть осуществлен только при очень высокой Т:
N2 + O2 = 2NО – Q
2. Получение в промышленности (1-я стадия производства HNO3).
4NH3 + 5O2 = 4NО + 6Н2О
3. Лабораторный способ – действие разб. HNO3 на тяжелые металлы:
8HNO3 + 3Cu = 2NO + 3Cu(NO3)2 + 4Н2О
Химические свойства
NO – несолеобразующий оксид (подобно N2О). Обладает окислительно-восстановительной двойственностью.
2NO + SO2 + Н2О = N2O↑ + H2SO4
2NO + 2H2 = N2 + 2Н2О (со взрывом)
2NO + O2 = 2NO2
10NO + 6KMnO4 + 9H2SO4 = 10HNO3 + 3K2SO4 + 6MnSO4 + 4Н2О
NO2 – оксид азота (IV), диоксид азота
При обычной температуре NO2 – красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
Способы получения
I. Промышленный – окисление NO: 2NO + O2 = 2NO2
II. Лабораторные:
действие конц. HNO3 на тяжелые металлы: 4HNO3 + Сu = 2NO2↑ + Cu(NO3)2 + 2Н2О
разложение нитратов: 2Pb(NO3)2 = 4NO2↑ + O2↑ + 2РbО
Химические свойства
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами – они всегда окислительно – восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот – азотной и азотистой:
2NO2 + Н2О = HNO3 + HNO2
Если растворение происходит в присутствии O2, то образуется одна кислота – азотная:
4NO2 + 2Н2О + O2 = 4HNO3
Аналогичным образом происходит взаимодействие NO2 со щелочами:
в отсутствие O2: 2NO2 + 2NaOH = NaNO3 + NaNO2 + Н2О
в присутствии O2: 4NO2 + 4NaOH + O2 = 4NaNO3 + 2Н2О
По окислительной способности NO2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO2 восстанавливается до свободного азота:
10NO2 + 8P = 5N2 + 4P2O5
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
2NO2 + 7Н2 = 2NH3 + 4Н2О
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
2NO2 + 2N2H4 = 3N2 + 4Н2О + Q
N2O3 и N2O5 – неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-100С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
2N2O5 = 4NO2 + O2
Источник
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
N2 + O2 → 2NO — 180,9 кДж
и тотчас же реагирует с кислородом:
2NO + O2 → 2NO2.
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
3Cu + 8HNO3 (30 %) → 3Cu(NO3)2 + 2NO↑ + 4H2O.
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
FeCl2 + NaNO2 + 2HCl → FeCl3 + NaCl + NO↑ + H2O;
2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O.
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
4NH3 + 5O2 → 4NO + 6H2O.
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
2NO + O2 → 2NO2
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
2NO + Cl2 → 2NOCl (нитрозилхлорид).
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
2SO2 + 2NO → 2SO3 + N2↑.
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
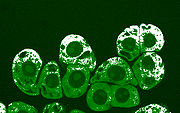
Оксид азота (белый) в цитоплазме клеток хвойных пород деревьев через час после механического воздействия.
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Оксид азота может синтезироваться несколькими путями. Растения используют неферментативную фотохимическую реакцию между NO2 и каротиноидами. У животных синтез осуществляют семейство NO-синтаз (NOS). NOS-ферменты – члены гем-содержащего суперсемейства ферментов, названных монооксигеназами. В зависимости от структуры и функций, NOS могут быть разделены на три группы: эндотелиальные (eNOS), нейрональные (nNOS) и индуцибельные (iNOS). В активный центр любой из NO-синтаз входит железопорфириновый комплекс, содержащий аксиально координированный цистеин или метионин. Хотя все изоформы NOS катализируют образование NO, все они являются продуктами различных генов, каждая из них имеет свои особенности как в механизмах действия и локализации, так и в биологическом значении для организма. Поэтому указанные изоформы принято также подразделять на конститутивную (cNOS) и индуцибельную (iNOS) синтазы оксида азота. cNOS постоянно находится в цитоплазме, зависит от концентрации ионов кальция и кальмодулина (белок, являющийся внутриклеточным посредником переноса ионов кальция) и способствует выделению небольшого количества NO на короткий период в ответ на стимуляцию рецепторов. Индуцибельная NOS появляется в клетках только после индукции их бактериальными эндотоксинами и некоторыми медиаторами воспаления, такими как гамма-интерферон, фактор некроза опухоли и др. Количество NO, образующегося под влиянием iNOS, может варьировать и достигать больших количеств (наномолей). При этом продукция NO сохраняется длительнее. Характерной особенностью NO является способность быстро (менее чем за 5 секунд) диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и легко (без участия рецепторов) проникать в клетки-мишени. Внутри клетки он активирует одни энзимы и ингибирует другие, таким образом, участвуя в регуляции клеточных функций. По сути, монооксид азота является локальным тканевым гормоном. NO играет ключевую роль в подавлении активности бактериальных и опухолевых клеток путем либо блокирования некоторых их железосодержащих ферментов, либо путем повреждения их клеточных структур оксидом азота или свободными радикалами, образующимися из оксида азота. Одновременно в очаге воспаления накапливается супероксид, который вызывает повреждение белков и липидов клеточных мембран, что и объясняет его цитотоксическое действие на клетку-мишень. Следовательно, NO, избыточно накапливаясь в клетке, может действовать двояко: с одной стороны вызывать повреждение ДНК и с другой – давать провоспалительный эффект. Оксид азота способен инициировать ангиогенез (образование кровеносных сосудов). В случае инфаркта миокарда оксид азота играет положительную роль, т.к. индуцирует новый сосудистый рост, но при раковых заболеваниях тот же самый процесс вызывает развитие опухолей, способствуя питанию и росту раковых клеток. С другой стороны, вследствие этого улучшается доставка оксида азота в опухолевые клетки. Повреждение ДНК под действием NO является одной из причин развития апоптоза (запрограммированный процесс клеточного «самоубийства», направленный на удаление клеток, утративших свои функции). В экспериментах наблюдалось дезаминирование дезоксинуклеозидов, дезоксинуклеотидов и неповрежденной ДНК при воздействии раствора, насыщенного NO. Этот процесс ответственен за повышение чувствительности клеток к алкилирующим агентам и ионизирующему излучению, что используется в антираковой терапии.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
В 1998 году трое американцев – Фурчготт, Игнарро и Мюрад – были удостоены премии Нобелевского комитета по физиологии «за открытия, касающиеся окиси азота как сигнальной молекулы в сердечно-сосудистой системе».
Применение
Получение NO является одной из стадий получения азотной кислоты .
Wikimedia Foundation.
2010.
Источник
Оксиды азота. Общая характеристика, химические свойства.

Данный урок посвящен оксидам азота, которые при взаимодействии с водой образуют кислоты, и соответственно, являются солеобразующими, – NO2 и N2O5.
NO2 представляет собой типичный кислотный оксид, который обладает высокой химической активностью, и при взаимодействии с неметаллами (сера, фтор, водород) ведет себя как сильный окислитель; также применяется при производстве серной кислоты (нитрозный метод), окисляя сернистый газ в олеум (SO3), и азотистой кислоты (HNO2).
N2O5 – это высший оксид азота, очень летуч, взаимодействует с органическими веществами, поэтому его нужно хранить в стеклянной посуде (!Важно! плавиковая кислота (HF) наоборот хранится в полимерной таре по причине того, что разъедает стекло), легко разлагается до ядовитого NO2 со взрывом; используется при получении азотной кислоты (HNO3).
Важно знать, что все оксиды азота токсичны!
Более детально изучить химические свойства предлагаю при помощи таблицы, в которой собраны все необходимые реакции для сдачи ЕГЭ.
Солеобразующие оксиды азота | ||
1) Формула | NO2 | N2O5 |
2) Характеристика | NO2 (Nitrogen dioxide, диоксид азота)– красно – бурый газ, ядовит, с характерным острым запахом; Хорошо растворяется в воде; | N2O5 (Dinitrogen pentoxide, пентаоксид азота)– бесцветные, летучие кристаллы, взрывчатые; Хорошо растворяется в воде; |
3) Получение в лаборатории | 1) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 (200-470 C); 2) Me + 4HNO3(к) = Me(NO3)2 + 2NO2 + 2H2O (Me= правее водорода); | 1) 2HNO3(к) + P2O5 = N2O5 + 2HPO3 (-10 C); 2) 4AgNO3 + 2Cl = 4AgCl + 2N2O5 + O2; |
4) Получение в промышленности | NO+ O2 = NO2 (на воздухе – мгновенно); | 2NO2 + O3 = N2O5 (-78 C); |
5) Химические свойства | 1) Разложение: 2NO2 = 2NO + O2 (140-600 C) 2) C кислотами: 2NO2 + 4HCl = 2NOCl + Cl2 + 2H2O; 2NO2 + 8HI = N2 + 4I2 + 4H2O; 2NO2 + 2H2S = N2 + 2S + 2H2O (350 C); 3) С металлами: 2NO2 + Na = NaNO3 + NO (22 C); 2NO2 + 4Cu = N2 + 4CuO (600 C); 2NO2 + 4Zn = 4ZnO + N2; NO2 + K = KNO2; 4) С неметаллами: NO2 + O2 ≠ В присутствии воды реакция идет (образование HNO3): 4NO2 + O2 + 2H2O = 4HNO3; 4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O; 2NO2 + O3 = N2O5 + O2; 2NO2 + 2C = N2 + 2CO2 (t); 2NO2 + 7H2 = 2NH3 + 4H2O (kat.: Pt, Ni); 10NO2 + 8P = 5N2 + 4P2O5 (150 C); 2NO2 + 2S = N2 + 2SO2 (150 C); 2NO2 + F2 = NO2F (нитронил фтористый); 2NO2 + F2 + H2O = 2HNO3 + 2HF; 5) С солями: 3NO2 + CaCO3 = Ca(NO3)2 + NO + CO2 (+Q); 2NO2 + KГ = KNO3 + NOГ (Г= Cl, Br); 14NO2 + 16FeSO4 + 8H2SO4 = 8HNO3 + 8Fe2(SO4)2 + 3N2 + 4H2O; 5NO2 + KMnO4 + 2H2SO4 + H2O = 5HNO3 + MnSO4 + KHSO4 6) С оксидами: 2NO2 + H2O = HNO3 + HNO2; 2NO2 + SO2 = N2 + 2SO3 (22 C) 2NO2 + SO2 = SO3 + NO (t) 7) C основаниями: 2NO2 + 2KOH = KNO3 + KNO2 + H2O | 1) Разложение: N2O5 = 4NO + O2 (взрыв); 2) С кислотами: N2O5 + 3H2S = 3H2SO4 + 4N2 + 4O2; 3) С металлами: N2O5 + 3Zn = 3ZnO + O2 + N2 (t) N2O5 + 5Cu = N2 + 5CuO (500 C) N2O5 + Na = NaNO3 + NO2 4) С неметаллами: N2O5 + O2 ≠ N2O5 + I2 = I2O5 + N2 5) С солями: 2N2O5 + 2KI = I2 + 2NO2 + 2KNO3 6) С оксидами: N2O5 + H2O = 2HNO3 + Q N2O5 + 3SO2 = 3SO3 + O2 + N2 N2O5 + Al2O3 = 2Al(NO3)3 (40 C) N2O5 + CaO = Ca(NO3)2 7) С основаниями: N2O5 + 2NH4OH = 2NH4NO3 + H2O N2O5 + 2KOH = 2KNO3 + H2O |
6) Применение | 1) Используется при производстве H2SO4 и HNO3; 2) Окислитель в жидком ракетном топливе; 3) Вместе с другими оксидами азота образует «лисий хвост» – выбросы химического производства, и из выхлопных труб автомобилей; 4) Токсичен, вызывает отек легких. | 1) Применение ограничено из-за взрывоопасной природы оксида азота (V); 2) Используется в качестве нитрующего агента (в органической химии). |
Следующее занятие будет посвящено задачам по этой теме.
Если возникнут вопросы, пиши в коменты)
Солеобразующие оксиды азота. Задачи с объяснениями.
Источник
