Перечислите химические свойства воды какие из
Nurjan Isaeva
11 мая · 2,4 K
Автор вопроса считает этот ответ лучшим
На сайте https://tvoiklas.ru/ представлены уроки географии, биологии и истории на… · tvoiklas.ru
- Химические:
а) реагирует со многими металлами с выделением кислорода;
б) разлагается на кислород и водород при действии электрического тока;
в) реагирует со многими оксидами неметаллов;
г) реагирует с некоторыми оксидами металлов.
- Физические:
а) высокая теплопроводность (теплоёмкость) и низкая теплоотдача;
б) несжимаемость;
в) способность к поверхностному натяжению;
г) жидкость без цвета, вкуса и запаха;
д) сцепление – водородные связи удерживают молекулы воды вместе;
е) высокая удельная температура парообразования и конденсации;
ж) способность растворять многие вещества;
з) гидроксид водорода может находиться в трёх состояниях: в жидком – вода, парообразном – водяной пар и твёрдом – лёд. При этом лёд имеет более низкую плотность;
и) при замерзании расширяется и т.д.
- Биологические
а) сохраняет объём и тургор клеток и тканей;
б) обеспечивает
охлаждение благодаря испарению с поверхности тела,
- доставку питательных веществ и кислорода ко всем клеткам тела,
- буферизацию (поддержание кислотности) внутренней среды,
- регуляцию температуры тела,
- преобразование пищи в энергию,
- усвоение питательных веществ клетками,
- вывод шлаков и отходов, появившиеся в процессе жизнедеятельности и целый ряд других функций.
Биологически вода это жизнь!!! Без воды и не туды и не сюды)) у воды много не обьяснимых функций, как она достигает самых верхних листьев дерева ведь у деревьев нет насосов))
Физические свойства воды: лед, вода, пар, ещё есть 4-ое но я не знаю вода бывает в виде плазмы, может это молния, при раскатах молнии вода делится на водород, и озон,
Химические свойства воды: растворяет практически любой состав, даже вода налитая в стакан, растворяет стекло но очень медленно, при взаимодействии с металлами вступает в реакцию и вызывает ВОДОРОД,
Если вода – это жидкость, то что находится между её атомами?
Сусанна Казарян, США, Физик
Межатомное и межмолекулярное пространство заполнено только электромагнитными полями. Источниками полей являются электронные оболочки, магнитные поля и тепловые движения атомов и молекул. Доминирующими источниками теплового (инфракрасного) излучения для газов являются поступательные движения, для жидкостей – вращательные, а в твердых телах – вибрации молекул.
Прочитать ещё 2 ответа
Почему вода имеет свойство замерзать?
Всем трям, то есть здравствуйте. 🙂 Я по жизни оптимист, натуралист, огородник-г…
Известно, что теплота пораждает движение молекул. Каждая молекула воды связана одновременно с четырьмя другими молекулами, но пока вода находится в жидком состоянии, тепловое движение молекул относительно друг друга не даёт воде принимать какую-либо форму.
При температуре ниже 0°С связь между молекулами начинает преобладать и энергия теплового движения уже недостаточно для того, чтобы препятствовать стремлению молекул принять статичную форму – вода замерзает, появляется твёрдый лёд.
Прочитать ещё 2 ответа
Как можно охарактеризовать физические и химические свойства кислорода?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Кислород (или Oxygenium)????
Химические свойства:
✅Сильный окислитель
✅Реагирует практически со всеми элементами
✅Образует оксиды
✅Окисляет простые и сложные неорганические вещества
✅Окисляет органические вещества
✅Характерна реакция горения
Физические свойства:
????Газ без цвета и запаха
????Мало растворим в воде
????Немного тяжелее воздуха
????Плотность 1,4г/л
????Температура кипения -183°C
????Температура плавления -216°C
????Атомы кислорода образуют такие вещества,как O ₂(кислород) и О ₃ (озон)
Какими свойствами обладают воздух и вода?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Свойства воздуха????
✅Он прозрачен
✅Бесцветный
✅Не имеет запаха
✅При нагревании расширяется
✅При охлаждении сжимается
✅Сохраняет тепло
✅Сжимаем и упруг
✅Легче воды
✅Не имеет вкуса
✅Состоит из смеси газов
????Свойства воды ????
✅Прозрачная
✅Не имеет запаха
✅Обладает текучестью
✅Бесцветна
✅Является растворителем
✅Расширяется при нагревании
✅Сжимается при охлаждении
✅Из жидкого состояния может перейти в газообразное
✅Из жидкого состояния может перейти в твёрдое
✅Принимает форму сосуда
Источник
Оксид водорода (H2O), гораздо более известный всем нам под названием “вода”, без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом – в виде льда, в жикдом, собственно вода, в газообразном – в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. – это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см3;
- вода – хороший растворитель.
Строение молекулы воды
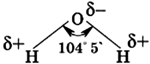
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода – положительный. Таким образом, молекулу воды можно рассматривать, как диполь.

Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
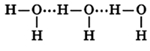
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры – чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии – образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода “охотно” вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
2Na+2H2O = 2NaOH+H2↑
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
3Fe+4H2O=FeO → Fe2O3+4H2↑
C+2H2O → CO2+2H2↑ - с основными оксидами при н.у. вода реагирует с образованием оснований:
CaO+H2O = Ca(OH)2
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
CO2+H2O = H2CO3
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества – в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества – в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества – в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды – такой “слоеный пирог” называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
- Жесткость воды
- Пероксид водорода (H2O2)
Источник

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перечислите физические свойства воды.( БИЛЕТ № 17)
Укажите границы гидросферы.( БИЛЕТ № 17)
АДАНИЯ № 13
Гидросфера – водная оболочка земного шара, расположенная в нижней части атмосферы, на поверхности земной коры и в ее толще, представляющая совокупность океанов, морей и водных объектов суши (рек, озер, болот, подземных вод, снежного покрова и ледников). По своим границам гидросфера совпадает с биосферой в понимании В.И. Вернадского.
Вода — оксид водорода — одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, — она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода — хороший растворитель. Молекула воды имеет угловую форму :атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н20 содержатся ассоциированные молекулы, т. е. соединенные в более сложные агрегаты (Н2О)x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н20—Н2S — Н2Sе) аномально высокая теплоемкость [4,18 кДж/(г • К)]. С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения – кристаллогидраты.
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH(бурно)
2K + 2H2O = H2 + 2KOH(бурно)
3Fe + 4H2O = 4H2 + Fe3O4(только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O = H2 + CO(при сильном нагревании)
CH4 + 2H2O = 4H2 + CO2(при сильном нагревании)
2) Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
3) Вода реагирует со многими оксидаминеметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
| SO2 | + | H2O | = | H2SO3 |
| сернистая кислота |
| SO3 | + | H2O | = | H2SO4 |
| серная кислота |
| CO2 | + | H2O | = | H2CO3 |
| угольная кислота |
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
| CaO | + | H2O | = | Ca(OH)2 |
| гидроксид кальция (гашеная известь) |
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мы уже встречались с такими оксидами. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называетсякристаллогидратом. Например:
| CuSO4 | + | 5 H2O | = | CuSO4.5H2O | |||||
| вещество белого цвета (безводный сульфат меди) | кристаллогидрат (медный купорос), синие кристаллы |
Приведем другие примеры образования гидратов:
H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Особая реакция воды – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
Дата добавления: 2014-11-18; Просмотров: 2269; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
- II Общие закономерности химических процессов
- II. В дневнике для практических работ составить формулы молочных и постоянных зубов.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
- II. Укажите, верно или неверно.
Источник
Благодаря своим уникальным физическим и химическим
свойствам, часто аномальным, вода сделала возможной жизнь на Земле. Так в чем
состоят эти уникальные характеристики?
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно
много тепла, чтобы нагреться, и потребуется много времени, чтобы потерять
накопленное тепло и остыть. Вот почему она используется в системах охлаждения
(например, в автомобильных радиаторах или для охлаждения промышленного
оборудования). Эта характеристика объясняет также то, почему в прибрежных (или
озерных) регионах температура воздуха мягче: в этих местах, когда времена года
меняются, температура воды «смягчает» температуру воздуха, так как она уменьшается
или увеличивается медленнее.

При ответе на вопрос: какие физические свойства воды
определяют ее особое биологическое значение, первым делом нужно вспомнить, что
она имеет высокое поверхностное натяжение. Это означает, что после наливания на
гладкую поверхность она имеет тенденцию образовывать сферические капли, а не
растекаться в тонкую пленку. И это свойство во многом объясняет высокую
биологическую активность воды. Без гравитации капля ее была бы совершенно
сферической. Поверхностное натяжение позволяет растениям поглощать воду,
содержащуюся в почве, через корни. И поверхностное натяжение делает кровь такой
«проникающей» через ткани нашего организма.
Вода обычно находится в жидком состоянии, но может легко
стать твердой или газообразной. Чистая вода переходит из жидкой в твердую, то
есть замерзает при 0° С, а на уровне моря она кипит при 100 ° С (чем выше
уровень, тем ниже температура, при которой вода начинает кипеть). Значения
кипения и замерзания воды берут в качестве контрольной точки для калибровки
термометров: в градусах Цельсия 0 ° по шкале Цельсия — это точка замерзания, а
100 ° — это точка кипения.
При замерзании вода расширяется, то есть ее плотность
уменьшается, а объем остается неизменным: поэтому лед плывет по поверхности или
лопается бутылка, наполненная водой и помещенная в морозильник.

Вода является особым природным ресурсом, поскольку она
является единственным на Земле веществом, которое можно найти во всех трех
физических состояниях в зависимости от температуры окружающей среды: жидкой,
твердой (лед) и газообразной (пар).
Химические свойства воды
Химическая формула молекулы воды — H2O: два атома водорода
(H2) связаны с одним атомом кислорода (O). Электроны атома (частицы с
отрицательным зарядом) устанавливают связи между собой. Кислород способен
держать их ближе к нему, чем водород. Молекула эта оказывается заряженной
отрицательно вблизи атома кислорода и положительно вблизи атомов водорода.
Поскольку противоположности притягиваются, молекулы воды имеют тенденцию
соединяться вместе, как магниты.
Вода может растворять многие вещества
Воду называют универсальным растворителем, поскольку она
может растворять больше веществ, чем любая другая жидкость. И нам очень с этим
повезло: если бы не это химическое свойство, мы не могли бы выпить чашку
горячего подслащенного чая, потому что сахар остался бы на дне чашки. Вот
почему воды рек, ручьев, озер, морей и океанов, которые выглядят чистыми на
первый взгляд, на самом деле содержат огромное количество растворенных
элементов и минералов, выделяемых камнями или атмосферой.
Везде, где течет вода, над землей, под землей или внутри
нашего тела, вода растворяет в себе и несет чрезвычайно большое количество
различных веществ. Таким образом, она выполняет драгоценную задачу: переносить
иногда на большие расстояния вещества, с которыми она сталкивается на своем
пути. Причем, с водой при обычных климатических условиях не реагирует
большинство этих веществ.

Чистая вода, как и дистиллированная вода, имеет рН 7
(средний). Морская вода в основном щелочная, имеет рН около 8. Чистая вода
реагирует с немногими веществами, например, серой, некоторыми солями и
металлами. Также возможен гидролиз (распад) воды при реакции с какими-то
химическими веществами.
Вода может содержать огромное количество взвешенных частиц
разных веществ, в т.ч. и радиоактивных. Именно этим и объясняется превращение
чистой воды в радиоактивную. И в наш век вездесущей атомной энергетики глубокая
и своевременная дезактивация воды – уже глобальная проблема.
Физико-химические свойства воды
То, какими свойствами обладает чистая вода, во многих
случаях зависит от водородных связей внутри ее молекул. При сравнении этих
свойств со свойствами атомов или не связанных с водородом молекулярных
жидкостей с аналогичными размерами молекул некоторые особенности воды
заслуживают внимания:
- Точка плавления льда исключительно высока среди гидридов шестой основной группы.
- Во время таяния льда при атмосферном давлении объем вещества уменьшается на 8,2%. Это аномальное сокращение объема, ведь большинство веществ расширяется во время плавления. Снижению температуры замерзания способствует увеличение давления.
- Зависимость молярного объема жидкой воды от давления и температуры показывает крайности. Плотность жидкой воды имеет максимум при 3,98 ° С.
- Коэффициент теплового расширения α жидкой воды на порядок меньше по сравнению с другими молекулярными жидкостями. Изотермическая сжимаемость χT показывает, что для молекулярной жидкости вода довольно несжимаема.
- Динамическая вязкость воды выше, чем у сопоставимых, не связанных водородом жидкостей. Более того, зависимость вязкости от давления аномальна: вязкость уменьшается с давлением и достигает минимума около 60 МПа (это давление эквивалентно толще воды в 6 км).
- Поверхностное натяжение воды выше, чем у других жидкостей, включая большинство других жидкостей, связанных водородом. В диапазоне температур от 0 до 130°С вода жидкая.
- Теплопроводность увеличивается с ростом температуры. Жидкая вода обладает высокой удельной теплоемкостью при постоянном давлении, которое изменяется незначительно до 100°C.
- Энтальпия испарения воды аномально высока. Аналогично удельной теплоемкости, она почти в четыре раза выше, чем для других сопоставимых жидкостей, не связанных с водородом. Эта разница приписывается водородной связи. Кроме того, энтальпия испарения воды очень велика по сравнению с энтальпией таяния.
Тот факт, что вода увеличивается в объеме при замерзании,
приводит ко многим последствиям в природе. Именно вода и ее свойство легко
проникать в расщелины скал, когда она замерзает, приводит к разрушению скал.
Постепенно происходит физическое и химическое выветривание скальных пород. И, в
конечном итоге, физические свойства и химические функции воды сформировали
почву на нашей планете.
Тот факт, что вода имеет самую высокую плотность при 4°С, а
не в точке замерзания, имеет важное значение для термического расслоения и
циркуляции воды в природе. Это химико-физическое свойство воды приводит к
замерзанию водоемов от их поверхности в направлении дна. Это важно не только
для жизни внутренних водоемов, но и для океанов. Если бы самые холодные районы
океанов должны были замерзать снизу-вверх, то солнечной энергии, полученной за
время лета, было бы достаточно только для оттаивания самого верхнего слоя. Так
осуществляется круговорот энергии и материи, которая опирается на циркуляции
океанов частично или даже полностью.
Огромная удельная теплоемкость воды ответственна за его
способность хранить огромное количество энергии. Таким образом, водные потоки,
например, Гольфстрим, способны нести огромное количество тепла из более теплых
климатических зон в более холодные. Таким образом, океаны работают как огромные
термостаты. Не только климат Земли, но и температурное регулирование живых
организмов зависит от высокой теплоемкости воды. Это способствует, например,
поддержанию постоянной температуры тела у теплокровных организмов. Кроме того,
относительно высокая теплопроводность воды предотвращает серьезные локальные
колебания температуры.
Абсолютно чистая вода имеет электрическую проводимость 0,03
мкСм / см это связано с автопротолизом. Электропроводность, однако, на реальных
водоемах значительно выше, из-за растворенных ионных компонентов. Вода, будучи
сильным диэлектриком (водный диэлектрик – константа), является одним из самых
лучших растворителей для солей и газов, которые способны к сольволизу с
последующей диссоциацией (например, CO2).
Еще одна особенность воды, которая важна для
гидрологического цикла — ее энтальпия испарения. С этим тесно связана летучесть
воды. Она определяет количество воды, которое переходит в газовую фазу и может
транспортироваться в атмосферу.
Таким образом, можно сделать вывод, что вода уникальна в
физическом и химическом плане. Особые свойства воды сделали ее колыбелью и
абсолютным условием жизни на Земле. Зная основные характеристики этого
вещества, можно делать вывод: благодаря каким своим химическим и физико-химическим
свойствам вода стала жидкой основой жизни.
Источник
