Пищевая добавка е500 состав
Пищевая добавка E 500 (другое написание Е–500) — незаменимый помощник человека со времен древних цивилизаций. С ее помощью смягчают воду и чистят посуду, отбеливают вещи и лечат изжогу, нейтрализуют запахи и готовят рассыпчатое печенье.
За европейским кодом скрывается обычная сода.
Название продукта
Официально добавка носит название натрия карбонаты и включает группу соединений:
- карбонат натрия E 500(i) или кальцинированная сода;
- гидрокарбонат натрия Е 500(ii), известный как пищевая сода;
- смесь солей карбоната и гидрокарбоната натрия E 500(iii), кристаллическая сода.
Международный синоним — Sodium carbonates.
В немецком языке добавка обозначена Natriumkarbonat, французский вариант — carbonat de sodium.
Сода — общее техническое название продукта.
Тип вещества
Добавка Е 500 относится к группе веществ, облегчающих технологию производства продуктов.
Ее используют как агент, препятствующий слеживанию и комкованию, разрыхлитель, регулятор кислотности.
Пищевые натрия карбонаты с химической точки зрения подразделяют на следующие виды:
- натрий углекислый моногидрат, декагидрат и безводный E 500(i);
- натрий двууглекислый (натрий бикарбонат) Е 500(ii);
- натрий сесквикарбонат E 500 (iii).
Все они представляют собой кислые соли угольной кислоты и натрия.
Промышленное производство добавки Е 500 основано на аммиачном методе получения (или способ Сольвэ, по имени бельгийского химика, первым предложивший данную технологию). Раствор хлорида натрия насыщают газообразным аммиаком и диоксидом углерода. Выпавший остаток гидрокарбоната натрия отфильтровывают и очищают.
Для получения кальцинированной соды гидрокарбонат натрия обезвоживают путем нагревания до 160º C.
Свойства
| Показатель | Стандартные значения |
| Цвет | белый |
| Состав | карбонат, гидрокарбонат натрия; формулы: добавка Е 500(i) безводная — Na2CO3; Е 500(ii) — NaHCO3; Е 500(iii) — Na2СO3•10Н2O и Nа2СO3•Н2O |
| Внешний вид | кристаллический или гранулированный порошок, бесцветные кристаллы |
| Запах | отсутствует |
| Растворимость | хорошо в воде; не растворяется в этаноле |
| Содержание основного вещества | не менее 99% (Е 500i, ii); от 35 до 38,6% (Е 500iii водный); от 46,4 до 50% (Е 500iii безводный) |
| Вкус | солоновато-щелочной |
| Плотность | 2,16 г/см3 |
| Другие | рН от 8,0 до 8,6 (1% водный раствор гидрокарбоната натрия); безводные формы гигроскопичны; гидрокарбонат натрия при нагревании выше 60ºC распадается на карбонат, воду и углекислый газ |
Упаковка
Добавку E 500 расфасовывают в полиэтиленовые мешки толщиной от 0,08 мм и заваривают или завязывают шпагатом из натуральных волокон для обеспечения защиты от влаги.
Наружной упаковочный тарой служат:
- мешки из синтетических волокон, мешочной ткани или крафт-бумаги;
- бочки из полиэтилена (евробарабан);
- барабаны картонные навивные;
- ящики из гофрированного картона.
В розничную продажу добавка Е 500 обычно поступает в картонных коробках или пластиковых банках с завинчивающейся крышкой.
Применение
Натрия карбонаты разрешены к применению во всех странах.
В России технические условия использования вещества регулирует ГОСТ 32802-2014.
Добавка E 500 широко применяется в пищевой промышленности самостоятельно или в смеси с карбонатом аммония (Е 503).
В основном ее используют как разрыхлитель в производстве мучных кондитерских изделий. Натрия карбонаты при нагревании высвобождают углекислый газ. Это способствует увеличению объема теста, улучшению вкусовых качеств готового изделия.
В качестве разрыхлителя теста добавка разрешена в продуктах для детского питания.
Другое направление применения стабилизатора Е 500 — регулирование уровня кислотности. Натрия карбонаты создают неблагоприятные условия для деятельности патогенных микроорганизмов, продлевают срок годности, усиливают действие консервирующих добавок.
Натрий углекислый внесен в перечень сырья для производства колбас, мясного хлеба, копченых и вареных изделий из свинины.
Добавку используют в производстве сухого молока, продуктов на основе шоколада и какао (не более 70 г/кг сухого вещества) для защиты от слеживания и комкования.
Карбонаты натрия применяют в технологии щелочного удаления кожицы с определенных плодов: груш, яблок, персиков, помидоров, картофеля и других. Обработка проводится в специальных вращающихся барабанах. По окончании процесса щелочь нейтрализуют кислотой, чаще лимонной.
Одним из основных потребителей натрия карбонатов является фармацевтическая отрасль.
Стабилизатор E 500 обладает выраженными антацидными, антибактериальными качествами. В качестве вспомогательного вещества используют в антибиотиках и противотуберкулезных препаратах. На основе натрия карбонатов изготавливают лекарственные формы для борьбы с широким рядом заболеваний:
- растворы для капельных инфузий при гипертонической болезни, аритмии, коррекции метаболического ацидоза;
- таблетки для лечения бронхо-легочных воспалений (ощелачивают бронхиальную слизь, разжижают мокроту);
ректальные суппозитории с антимикробным эффектом; - растворы для промывания ожогов, полосканий полости рта при стоматите, лечения конъюктивита.
Производители косметических средств оценили противовоспалительные и отбеливающие свойства натрия карбонатов. Добавка Е 500 входит в состав:
- специальных зубных паст (например, «Новый Жемчуг Сода Бикарбонат») как отбеливающий компонент с легкими абразивными свойствами;
- очищающих лосьонов для проблемной кожи (останавливают воспалительный процесс, подсушивают акне);
- масок для жирной кожи (нормализуют работу сальных желез).
Добавку E 500 используют в ваннах для коррекции веса.
Гидрокарбонат натрия (E 500ii) разрешен для розничной продажи.
Польза и вред
Польза добавки обусловлена ее химическими свойствами.
Вещество имеет уровень рН от 8 до 9 единиц, то есть является щелочью — эффективным нейтрализатором сильных кислот. Бикарбонат натрия способен на некоторое время устранить боль, вызванную гиперацидностью желудочного сока при гастрите, язвенной болезни.
По этой же причине натрия карбонаты выступают сильными антидотами при отравлении различными кислотами. Водный раствор снимает боль при химических ожогах.
Добавка Е 500 проявляет антисептические и муколтические свойства, что позволяет использовать ее в народной медицине для обработки ран, лечения ангины и грибковых поражений, разжижения мокроты, смягчения кашля.
Перед употреблением овощей и фруктов полезно положить их на несколько минут в раствор пищевой соды. Натрия карбонаты нейтрализуют действие химических веществ, которыми были обработаны плоды.
Суточное потребление добавки E 500 неограничено. Меру при этом соблюдать необходимо. Продукт относится к 3 классу опасности (умеренно опасный).
Большие дозы натрия карбонатов могут вызвать нежелательные эффекты:
- повышение кровяного давления;
- боли в животе, вздутие;
- отеки за счет способности задерживать воду. По этой причине беременным женщинам употребление пищевой соды нежелательно;
- снижение уровня калия в организме, как следствие — аритмию, усталость, мышечные судороги;
- аллергические реакции (сыпь, зуд) при индивидуальной непреносимости.
Особую осторожность должны соблюдать люди, имеющие заболевания почек и сердца.
Пищевая добавка цитрат кальция (Е333) может нанести вред организма только при превышении допустимой нормы кальция в организме.
Не секрет, что пектин благоприятно влияет на человеческий организм. Подробнее об этом веществе читайте в нашей статье.
Что такое бензойная кислота и как ее получают? Об этом мы рассказали здесь.
Основные производители
В России крупнейшим производителем добавки Е 500 является АО «Башкирская содовая компания», образованная в 2013 году путем слияния двух предприятий: ОАО «Сода» и ОАО «Каустик» (город Стерлитамак). Компания практически полностью удовлетворяет потребность отечественного рынка.
В мировом производстве натрия карбонатов лидируют китайские поставщики. На их долю приходится более 50% от общего объема продукции.
Ведущие мировые производители:
- Eastern United Nanjing Chemical Industries Group Co. Ltd.(Китай);
- Solvay, старейший производитель соды. Предприятия расположены в Испании и Болгарии, заключено партнерское соглашение с китайским заводом Tianjin Soda Ash Plant;
- Brunner Mond (Великобритания, имеет заводы в Кении и Нидерландах);
- Soda Sanayii AS (Турция).
Интересный факт! В ряде европейских стран добавку E 500 используют для приготовления варенья их цитрусовых плодов, включая кожуру. Бикарбонат натрия размягчает корку, снижает горечь, способствует лучшему развариванию плодов. В итоге получается густая желеобразная консистенция, схожая с мармеладом. Продукт отличается высокими вкусовыми качествами и длительным сроком хранения.
Источник
Пищевая добавка Е500(i) (карбонат натрия) — относится к добавкам препятствующим слёживанию и комкованию, разрыхлителям и регуляторам кислотности искусственного происхождения, используется в технологических целях в процессе производства пищевых продуктов. Карбонат натрия — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворим в воде; нерастворим в этаноле. В промышленности в основном получают из хлорида натрия по методу Солвэ.
Пищевая добавка Е500 включает в себя 3 родственных соединения — натриевые соли угольной кислоты (Sodium salt of carbonic acid):
- Е500(i) Карбонат натрия (Sodium Carbonate, кальцинированная сода);
- Е500(i) Гидрокарбонат натрия (Sodium Hydrogen Carbonate, бикарбонат натрия, натрий двууглекислый, пищевая или питьевая сода);
- Е500(iii) Смесь карбоната и гидрокарбоната натрия (Sodium Sesquicarbonate, секвикарбонат натрия, декагидрат карбоната натрия, кристаллическая сода).
Нахождение в природе
Природный источник — в грунтовых рассолах, рапе соляных озёр. Минералы — натрон, нахколит, трона, натрит (сода), термонатрит.
Получают прокаливанием гидрокарбоната натрия из природных залежей, соляных рассолов.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 году в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
.
До начала ⅩⅨ века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1 000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Na2SO4 + 2C → Na2S + 2CO2
Сульфид натрия реагирует с карбонатом кальция:
Na2S + CaCO3 → Na2CO3 + CaS
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата, поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
2NaCl + H2SO4 → Na2SO4 + 2HCl
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140–160 °C, при этом он переходит в карбонат натрия:
2NaHCO3 °t→ Na2CO3 + H2O + CO2 ↑
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 году в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 000 тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 °C подаётся диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 °C. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всём мире — 84 % (2000 год).
Источник
Гидрокарбонат натрия
Описание
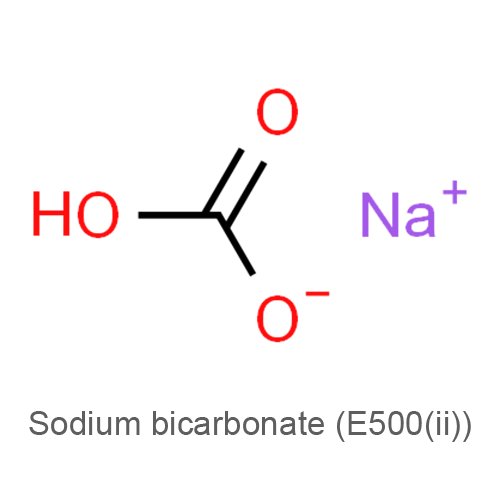
Пищевая добавка Е500(ii) (гидрокарбонат натрия) — относится к добавкам препятствующим слёживанию и комкованию, разрыхлителям и регуляторам кислотности искусственного происхождения, используется в технологических целях в процессе производства пищевых продуктов. Гидрокарбонат натрия — натриевая кислая соль угольной кислоты с химической формулой NaHCO3. В обычном виде — мелкокристаллический порошок белого цвета, хорошо растворим в воде; нерастворим в этаноле.
Пищевая добавка Е500 включает в себя 3 родственных соединения — натриевые соли угольной кислоты (Sodium salt of carbonic acid):
- Е500(i) Карбонат натрия (Sodium Carbonate, кальцинированная сода);
- Е500(i) Гидрокарбонат натрия (Sodium Hydrogen Carbonate, бикарбонат натрия, натрий двууглекислый, пищевая или питьевая сода);
- Е500(iii) Смесь карбоната и гидрокарбоната натрия (Sodium Sesquicarbonate, секвикарбонат натрия, декагидрат карбоната натрия, кристаллическая сода).
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
NH3 + CO2 + H2O → NH4HCO3
NH4HCO3 + NaCl → NaHCO3 ↓ + NH4CL
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
2NH4CL + Ca(OH)2 → 2NH3 ↑ + CaCl2 + 2H2O
Польза
Карбонаты натрия, благодаря способности нейтрализовать сильные кислоты, могут устранить боль, вызванную гиперацидностью желудочного сока при гастрите, язвенной болезни. Снижает болевые ощущения при нарушении целостности слизистой желудка (гастрит, язва), при тяжёлых пищевых отравлениях, в том числе алкогольных.
При наружном применении карбонаты натрия действуют как антисептик. Нейтрализует патогенную микрофлору, в том числе бактерии, грибки и вирусы.
Проявляет микролитические свойства, что позволяет использовать её в народной медицине для разжижения мокроты, смягчения кашля.
Вред
При чрезмерном употреблении карбоната натрия возможны следующие явления: затруднение дыхания, обморок, резкая желудочная боль. Добавка Е500 негативно влияет на печень, может стать причиной появления сыпи на лбу, руках и голове.
LD50 4 220 мг/кг.
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3.
Применение
Широко применяется в хлебопекарной, кондитерской промышленности и в домашнем хозяйстве в качестве разрыхлителя сдобного, песочного и другого теста, содержащего большое количество сахара и жира; стабилизатора сухих молока и сливок, сгущённого молока, продуктов, содержащих какао-порошок, в том числе шоколадных, маргаринов, в том числе низкожирных, плавленого и твёрдых сортов сыра, продуктов переработки мяса и др.; регулятора кислотности томатных концентратов (поддержание pH не выше 4,3), а также джемов, желе и цитрусовых мармеладов в количестве, необходимом для поддержания pH 2,8–3,5. Внесение в сливочное масло в процессе обработки 0,05–0,1 % питьевой соды повышает сохранность масла, увеличивая его рН.
Используется также для подщелачивания яичного меланжа, в производстве плавленых сыров в качестве регулятора кислотности. Добавляется к молоку для повышения его термостойкости. В виде 10 %-го раствора применяется для нейтрализации кислоты (катализатора инверсии сахарозы) после завершения процесса получения инвертного сиропа.
Гидрокарбонат натрия по ГОСТ 2156-76 Е «Натрий двууглекислый. Технические условия» внесён в перечень сырья в ГОСТ 18236-85 «Продукты из свинины варёные. Технические условия»; ГОСТ 18255-85 «Продукты из свинины копчено-варёные. Технические условия»; ГОСТ 18256-85 «Продукты из свинины копчено-запечённые. Технические условия».
Другие сферы применения
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту, пищевкусовой промышленности.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке. Но сейчас многие врачи не рекомендует применять питьевую соду из-за возможного возникновения побочных нежелательных эффектов, например, из-за «кислотного рикошета».
Иногда применяется внутривенно — с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий.
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приёме внутрь повышается риск алкалоза и развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl-, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Отёки, артериальная гипертензия, при приёме состояние больного может ухудшиться, анурия или олигурия, при этих заболевания повышается риск избыточной задержки натрия в организме.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как не очень эффективное, но совершенно безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путём протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Правовой статус
В Российской Федерации, Евросоюзе, на Украине и в большинстве стран мира пищевая добавка Е500(ii) разрешена для применения в пищевой промышленности.
Гигиенические нормы
ДСП не ограничено.
Опасности по ГН-98: предельно допустимая концентрация в воздухе рабочей зоны 5 мг/м3, класс опасности 3.
Codex: разрешён в качестве регулятора кислотности в 4 стандартах на пищевые продукты в количестве 2 г/кг или GMP; в качестве стабилизатора в 17 стандартах на пищевые продукты в количестве от 0,15 до 50 г/кг или GMP.
В Российской Федерации разрешён в продукты из какао и шоколада в количестве до 70 г/кг от сухого обезжиренного вещества в пересчёте на карбонаты кальция (п. 3.1.1. СанПиН 2.3.2.1293-03); в сухое молоко и другие пищевые продукты согласно ТИ в количестве согласно ТИ индивидуально или в комбинации с другими карбонатами (п. п. 3.1.7, 3.2.22 СанПиН 2.3.2.1293-03); для розничной продажи (п. 2.5 СанПиН 2.3.2.1293-03).
Характеристика
- E500(ii)
- Название вещества:
Гидрокарбонат натрия - Английское название:
Sodium bicarbonate - Категория:
- Происхождение:
- Опасность:
- Синонимы:
E500(ii) food additive, Е500(ii), NS number 500(ii), Е-500(ii), E number 500(ii), sodium hydrogen carbonate, baking soda, bicarbonate of soda, sodium salt of carbonic acid, Natriumhydrogenkarbonat, Natriumbikarbonat, Natron, hydrocarbonat de sodium - Состояние:
порошок - Растворимость:
хорошо растворим в воде; нерастворим в этаноле - Плотность:
2,159 г/см3 - Цвет:
белый - Формула:
NaHCO3 - CAS:
144-55-8 - PubChem:
516892
Схема

Подробнее по теме
Ознакомьтесь с дополнительной информацией о пищевой добавке E500(ii):
- Отзывы
- Вопросы
Источник
