При каком объемном соотношении метана и хлора основным продуктом реакции является
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
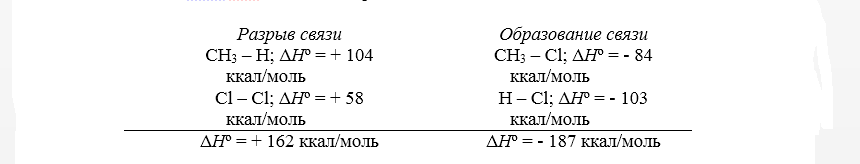
Рисунок 2. Хлорирование метана
Замечание 1
Суммарный тепловой эффект $Delta underline{H}^circ = – 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
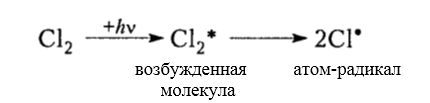
Рисунок 3. Хлорирование метана
рост цепи
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
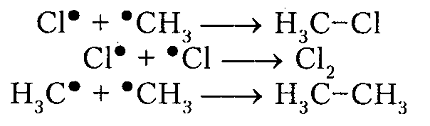
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
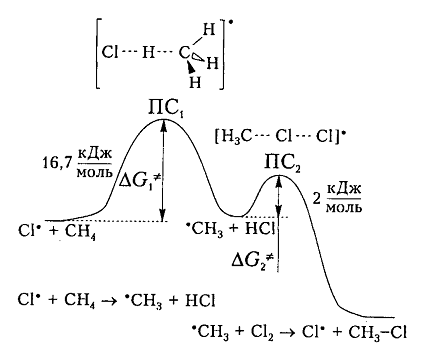
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи – связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах – плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
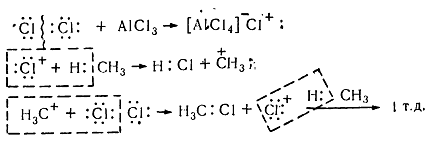
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Источник
Радикальный механизм хлорирования метана
Закономерности радикального хлорирования метана
Ионный механизм хлорирования метана
Одной из характерных особенностей насыщенных углеводородов является их способность активно вступать в реакцию с таким химическим элементом как хлор. Молекулярный хлор обладает невысокой способностью вступать в реакцию с алканами, поэтому они хлорируются катионами или атомами хлора, обладающими большей активностью. Для осуществления процесса распада хлорной молекулы на атомы необходимо затратить энергию, составляющую 242,8 кДж/моль. Подобная диссоциация может быть легко проведена при обычных температурных условиях под воздействием ультрафиолетового света. В ходе процесса молекула хлора, поглощая ультрафиолет, получает энергию в 293,0 кДж/моль. Реализация термической диссоциации хлорной молекулы на атомы должна происходить в условиях достаточно высоких температур – около 300ºC. Затраты энергии на диссоциацию молекулы для получения ионов хлора составляют порядка 1130,2 кДж/моль. Анализируя энергетические показатели разнообразных вариантов хлорирования можно сделать вывод о том, что наиболее предпочтительным способом хлорирования насыщенных углеводородов является процесс, проводимый на свету.
Процесс хлорирования алканов по сравнению с фторированием представляет собой процесс менее экзотермический, сопровождаемый выделением теплоты в количестве 108,8 кДж/моль. Осуществление хлорирования алканов фотохимическим способом проходит с применением рассеянного света, по причине того, что воздействие прямого света при проведении реакции приводит к взрыву. В ходе реакции хлорирования происходит постепенное замещение в алканах атомами хлора атомов водорода. Для реакций данного вида характерно образование в их результате хлорпроизводных насыщенных углеводородов.
Таким образом, нагревая до 200ºC смесь метана и хлора или подвергая её воздействию ультрафиолетового света, обладающего длиной волны подходящей величины, запускается реакция, сопровождаемая достаточно сильным выделением теплоты:
Для расчёта теплового эффекта, получаемого в ходе хлорирования метана, находящегося в газовой фазе, на первой стадии до состояния CH3Cl и HCl применяется закон Гесса.
Величина суммарного теплового эффекта ∆Hº равна 25 ккал/моль. Рассматриваемые показатели позволяют сделать вывод о полной вероятности проведения процесса хлорирования метана, причём сопровождающий реакцию тепловой эффект никак не связан со скоростью её протекания, определяемой количеством свободной энергии активации.
Радикальный механизм хлорирования метана
Осуществление реакции хлорирования метана, сопровождаемой нагревом и облучением, а также участием в ней инициаторов, способствующих образованию радикалов, реализует механизм радикально-цепного типа SR (Семенов), состоящий из следующих трёх базовых стадий:
инициирования цепи, или её зарождения
рост цепи
рекомбинация или обрыв цепи
Под воздействием света (hv) или под воздействием температуры молекула хлора Cl2 обретает избыточную энергию и переходит в возбуждённое состояние, которое заканчивается её распадом на два атома, являющиеся по своей природе радикалами. Взаимодействие или столкновение атома-радикала хлора с другими молекулами метана CH4 приводит к отщеплению от них водородных атомов, при котором образуется метильный радикал ●CH3. В свою очередь он отщепляет от следующей молекулы атом хлора Cl2 и т.д. Образование одного радикала, таким образом, инициирует многократное повторение стадии, при которой растёт цепь. Для протекающей реакции длина кинетической цепи определяется в соответствии с количеством подобных повторений. Для процесса хлорирования число повторений может достигать 10 и более тысяч.
Энергетическая диаграмма взаимодействия метановой молекулы и атома хлора изображена на рисунке.
Закономерности радикального хлорирования метана
Согласно общетеоретическим положениям, взаимодействие атомов хлора и молекулы метана будет происходить исключительно в случае равенства их свободной энергии величине энергии активации (или энергетического барьера), составляющего 16,7 кДж/моль. Сама по себе свободная энергия, как правило, немного больше простой разницы между энергией разрыва существующей в молекуле связи C–H (+425 кДж/моль), и образования связи нового вида H-Cl (-431 кДж/моль), которая составляет -6 кДж/моль. По этой причине взаимодействие реагирующих частиц запускается не каждым столкновением между ними, а только обладающими достаточной энергией для преодоления барьера.
Возникновение дополнительной активационной энергии связано с нагревом либо облучением молекул. В возбуждённом состоянии молекулы движутся с достаточно высокой скоростью, что позволяет при столкновении превратить их кинетическую энергию в энергию потенциальную. В переходном состоянии ПС1, соответствующем первой вершине кривой энергетической диаграммы, практически одновременно происходят разрыв старых связей C-H и образование связей нового вида H-Cl в активированном комплексе, который сформировался. Метильный радикал, образуемый в ходе реакции, обладает достаточной потенциальной энергией и впоследствии взаимодействует с молекулой хлора Cl2 сравнительно легко. Энергия, необходимая для активации данной стадии относительно не высока и составляет всего 2 кДж/моль. Окончательное образование соединения CH3Cl осуществляется в находящемся в переходном состоянии ПС2 активированном комплексе, сформировавшемся повторно.
Процесс хлорирования алканов и метана в частности, протекающий при температурах такой величины, представляет собой процесс, плохо поддающийся управлению. Обычно он не прекращается на стадии формирования соединения хлористого метила CH3Cl и способен протекать далее с получением промежуточных соединений – хлористого метилена, хлороформа и тетрахлорометана.
Ионный механизм хлорирования метана
Реакция хлорирования, осуществляемая в кислой среде в присутствии способствующих её протеканию по ионному механизму катализаторов (ими обычно являются кислоты Льюиса SbF5, AlCl3), обладает электрофильным характером (Se). Сущность процесса реагирования молекулы хлора с электроноакцепторного хлорида алюминия, в химическом плане, состоит в значительной поляризации связи C-C, являющейся до этого неполярной, приводящей к образованию электрофильного агента после её диссоциации. При отсутствии катализаторов хлорирование, происходящее по ионному механизму, практически не может осуществляться, по причине того, что для гетеролитического расщепления на анион и катион молекулы хлора необходима значительная энергия – порядка 1130 кДж/моль.
Цепной ионный электрофильный механизм (Se), по которому осуществляется хлорирование в присутствии катализаторов насыщенных углеводородов, изображен на рисунке:
Под воздействием катализатора происходит гетеролитический распад молекулы хлора, сопровождаясь возникновением ионной комплексной пары [AlCl4] – Cl +, из-за того, что алюминий соединён с атомами хлора, имеющими отрицательный электрический заряд, и нуждается в электронах. По этой причине алюминием от атома хлора Cl2 отщепляется пара электронов, сопровождаясь одновременным образованием катиона хлора, взаимодействующего впоследствии с молекулой метана гетеролитично разрывая связь C-H. Результатом данного процесса является образование метильного карбкатиона, который затем реагирует с хлорной молекулой, образуя, в конце концов, хлористый метил и катион хлора, взаимодействующий впоследствии со следующей молекулой. Ионные реакции, у которых промежуточными частицами являются ионы с положительным зарядом, имеют название реакций электрофильных.
По причине того, что для диссоциации хлорных молекул на ионы необходима значительная энергия, хлорирование углеводородов в насыщенном состоянии в присутствии катализаторов должно сопровождаться нагревом реакционной смеси.
Источник
Схема производства хлорметанов термическим хлорированием метана представлена на рис. 12.2. Метан и хлор смешивают с рециклом хлористого метила, хлористого метилена, хлороформа и вводят в реактор термического хлорирования 1. [c.394]
Этан, также как и метан, при хлорировании дает несколько хлорпроизводных, из которых наиболее широко применяются хлористый этил, дихлорэтан, трихлорэтан и гексахлорэтан. Из перечисленных углеводородов в промышленных условиях только хлористый этил получается путем термического хлорирования этана. Дихлорэтан производится в основном из этилена. Трихлорэтан и гексахлорэтан готовят путем хлорирования дихлорэтана. [c.120]
Для термического хлорирования метана существуют реакторы и других конструкций. На рис. 4 изображен более совершенный хлоратор. В начальный период аппарат разогревают, сжигая метан в топке 8. По достижении требуемой температуры в аппарате через смеситель 1 и трубу 2 подают смесь метана и хлора, которые проходят по центральной трубе 4 сверху вниз, а затем по реакционной камере 6 (между стенками реактора и центральной трубой-диффузором 4) — снизу вверх. Продукты реакции через слой фарфоровой насадки 3 (кольца с развитой поверхностью) выходят через штуцер в верхней крышке аппарата. [c.32]
Хлорирование метана протекает с большой скоростью. При температуре 400—450° в зависимости от отношения хлора к метану время контакта составляет 5—10 сек. При изучении кинетики реакции термического хлорирования метана Пиз и Вольц [6] установили, что первым продуктом хлорирования метана является хлористый метил. Скорость хлорирования хлористого метила оказалась выше скорости хлорирования метана. [c.370]
Хлористый водород и соляная кислота могут быть получены разными способами. В частности, они образуются в качестве побочного продукта в ряде органических синтезов, таких как термическое хлорирование хлористого метила для получения более высокохлорированных метанов — метиленхлорида, хлороформа и четыреххлористого углерода. [c.182]
Термическое хлорирование применяется чаще всего для получения хлоридов низших углеводородов. Наиболее трудно вступает во взаимодействие с хлором метан. Его хлорируют при температуре 400—460 °С повышение температуры хлорирования сверх 500 °С может привести к взрывной реакции [c.176]
Термическое хлорирование метана [24], этана и фотохимические процессы взаимодействия хлора с метаном и водородом [12] при температурах ниже 300 °С и в присутствии кислорода описываются следующим уравнением [c.42]
Тетрахлор метан. Бесцветная тяжелая низкокипящая негорючая жидкость. Термически малоустойчив. Практически ие смешивается с водой. Химически пассивен, разлагается только концентрированными щелочами. Неполярный апро-тонный растворитель. Получение — хлорирование углеводородов см. также 98 , 120 , 208 [c.101]
Хлорирование метана протекает с образованием всех возможных хлор-метанов, но проводится главным образом с целью получения хлористого метила и метиленхлорида. Хлорирование осуществляется при высоких температурах (400—450° С) за счет термического инициирования. При молярном соотношении хлора и метана преимущественно образуется не только хлористый метил, как это можно ожидать по уравнению реакции, а сложная смесь хлоридов примерно с равными количествами хлористых метила и метилена, со значительным содержанием хлороформа и примесью четыреххлористого углерода. Состав смеси хлоридов в зависимости от молярного соотношения компонентов реакции при 440° С приводится в табл. 101 и 102. [c.364]
Хлорированию подвергают жидкие (парафиновые, нафтеновые и ароматические) и газообразные (метан, этан, пропан и др.) углеводороды. Для получения хлорированных углеводородов применяют термическое, фотохимическое каталитическое хлорирование и хлорирование, инициируемое радикалами. [c.325]
Важным фактором во всех реакциях хлорирования с использованием окислов урана в качестве исходных материалов является реакционная способность применяемого окисла. Реакционноспособная двуокись урана может быть получена, например, восстановлением высших окислов метаном, аммиаком или этиловым спиртом при температуре ниже 750° или термическим разложением таких соединений урана (IV), как сульфат, оксалат или бензоат. Полученная таким путем двуокись урана представляет собой серо-черный пирофорный порошок, легко окисляющийся на воздухе. Двуокись урана кофейно-коричневого цвета, получающаяся восстановлением или термическим разложением при температуре выше 800°, гораздо более инертна. [c.371]
В табл. 66 приводятся результаты термического хлорирования, полученные Хэссом. На о оновании рИ С. 35 можно определить оптимальное молярное отношение хлор метан, необходимое для получения целевого продукта прямым хлорированием метана [66а]. [c.168]
Метан можно хлорировать фотохимичесх и или термически в паровой фазе и фотохимически в жидкой фазе. Пр1. проведении хлорирования метана при 360° в длинном канале между графитовыми поверхностями, отстоящими одна от другой на 0,8 мм, горение и пиролиз устраняются. В другом методе фотохимическое хлорирование в паровой фазе ведется при 60° между гладкими некаталитическими поверхностями, отстоящими друг от друга на 5 мм. Получающаяся смесь поступает в облучаемый сосуд с четыроххлористым углеродом, где хлорирование завершается. Для получения частично хлорированных метанов первую стадию можно опустить и реагенты сразу вводят в освещенный жидкий четырех-хлористый углерод [4]. [c.57]
Термическое хлорирование. Термическое хлорированпе применяется для получения моно- и полихлоридов низших углеводородов. Активация хлора в атом методе достигается нагреванием его в процессе реакции. Энергия активации хлора при термическом хлорировании составляет 20 000 кал моль, тогда как при каталитическом 12 000 кал моль. [23]. Многочисленными исследованиями установлено, что метан, этан, пропан и бутаны вступают в реакцию с хлором уже прн температуре около 250°. [c.363]
Подобно метану могут подвергаться хлорированию и друтае алканы Хлорирование углеводородов проводится в промышленных масштабах в паровой и жидкой фазах различными способами при нагревании до 400-500 с (термическое хлорирование), в присутствии катштизаторов (каталитическое хлорирование) при специальном освещении реагирующих компонентов (фотохимическое хлорирование). [c.24]
Хлорирование хлористого метила представляет интерес, так как оно показывает кумулятивную природу хлорирования метана Pease и Walz например показали, что хлористый метил подвергается термическому хлорированию приблизительно с вдвое большей скор остью, чем метан. Продукты хлорирования [c.766]
В нашей стране наибольшие количества метана используются в качестве бытового газа. Применение метана для органического синтеза — одна из труднейших задач, так как метан наиболее пассивен из всех парафиновых углеводородов. Однако эта задача в настоящее время принципиально (а в ряде случаев н практически) разрешена. Метан может быть превращен путе.м термического крекинга или под действием тлеющих разрядов в зысокореакционноспособный углеводоро д — ацетилен. Можно каталитически окислить метан до муравьиного альдегида или муравьиной кислоты хлорированием метана могут быть получены хлористый метил, хлористый метилен, хлороформ, четырех-хлористый углерод, а нитрованием — нитрометан. Метан также используется для промышленного синтеза синильной кислоты. Важный путь использования метана — конверсия его в окись углерода и водород (исходная смесь для синтеза метанола, син-тина и синтола), протекающая при действии на метан паров воды при высокой температуре в присутствии катализаторов. Наконец, большие количества метана используются для получения сажи (термическое разложение метана на углерод и водород), В Советском Союзе этим путем ежегодно получают сотни тысяч тонн сажи, предназначенной в качестве наполнителя для синтетического каучука и для других целей. [c.32]
При хлорировании метана целевыми продуктами обычно являются метиленхлорид, хлороформ, тетрахлорметан или их смеси. При целевом синтезе метиленхлорида мольное отношение метана к хлору берут равным л 4 1, возвращая непревращенный метан и хлорметан на реакцию. При целевом получении хлороформа мольное соотношение СН4 С1г составляет 0,8 1, причем непревращенный метан и СН3С1 возвращают на реакцию, получая наряду с хлороформом метиленхлорид и тетрахлорметан. Хлорирование метана ведут как чисто термическим путем при 500—550°С, так и термокаталитическим при 350— 400 °С. [c.113]
Подготовка исходных реагентов. Жидкий хлор испаряется в аппарате 1, проходит подогреватель 2, расходомер 3 и смешивается с органическим реагентом. Подготовка последнего, в зависимости от его свойств и условий реакции, может быть различной. Газообразные исходные вещества подаются через расходомер 4, смешиваются с рециржулирующим газом и проходят теплообменник 5, где подогреваются за счет тепла горячих реакционных газов. В случае хлорирования метана до хлористого метилена надобность в этом теплообменнике отпадает и метан подается на реакцию холодным. Жидкие галогенпроизводные при их хлорировании, совмещенном с термическим расщеплением, или пиролизе предварительно испаряют в специальном испарителе и затем нагревают в теплообменнике 5. [c.164]
Калибровка значительно упрощается и чувствительность термических детекторов увеличивается, если все органические вещества, выходящий из хроматографической колонки, до их поступления в детектор переводят в какое-либо одно химическое соединение. Углеводороды и их производные можно сжиганием перевести в СОг и воду или каталитическим восстановлением — в метан и воду. Эти реакции проводят непосредственно в потоке газа-носителя. При поглощении воды в осушительной колонке только углекислый газ или метан поступает в детектор, где и определяется. Хлорированные углеводороды сжигают над платиновым катализатором и полученную соляную кислоту измеряют кулонометрически (см. раздел Г, V, г). Таким образом, единственными сведениями, необходимыми для калибровки, являются сигнал детектора на индивидуальное вещество и эмпирическая формула для негорючих элюируемых компонентов. Чувствительность термических детекторов несколько улучшается, поскольку через детектор проходит большее число молекул, чем имеется в исходной пробе, вследствие более низкого молекулярного веса продуктов реакции. Чувствительность, к сожалению, ловышается не прямо пропорционально числу новых молекул. Изменение тем не менее значительно и должно быть учтено при выборе этого метода. Кроме того, углекислый газ и метан являются постоянными газами, [c.68]
Смотреть страницы где упоминается термин Метан термическое хлорирование:
[c.15]
Основные хлорорганические растворители (1984) — [
c.36
,
c.37
]
Источник
