Сколько и каких орбиталей содержится в атоме углерода
Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.

Атом углерода
Положение углерода в периодической таблице Менделеева:
- шестой порядковый номер;
- четвёртая группа;
- второй период.
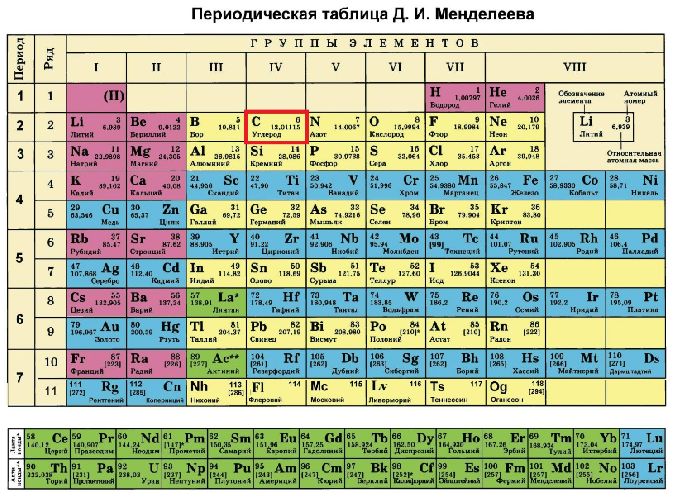
Рис. 1. Положение углерода в таблице Менделеева.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
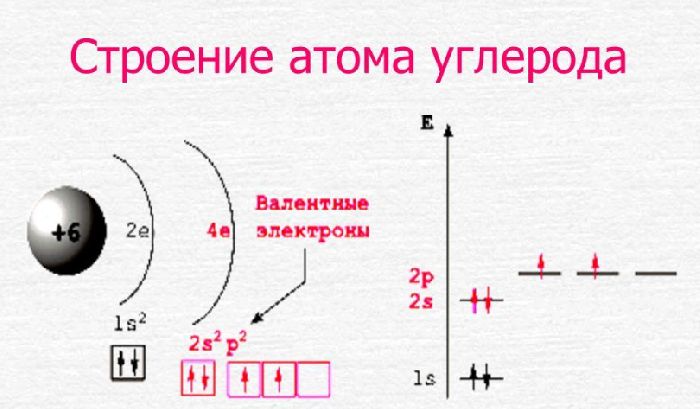
Рис. 2. Строение атома углерода.
Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
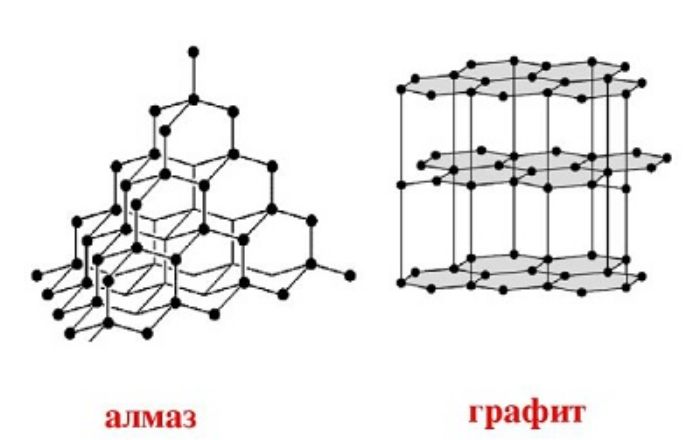
Рис. 3. Кристаллические решётки графита и алмаза.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
- С + О2 → СО2;
- 2С + О2 → 2СО.
Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
- 2H2SO4 + C → CO2 + 2SO2 + 2H2O;
- 4HNO3 + C → CO2 + 4NO2 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Тест по теме
Оценка доклада
Средняя оценка: 4.1. Всего получено оценок: 268.
Источник
| Я не химик, а медсестра. Зашла на ваш сайт потому, что он называется: “химия и жизнь” и надеюсь получить ответ на свой вопрос из лечебной практики: Скажите пожалуйста, почему при растворении препарата амбробене для ингаляций в мин. воде Есентуки №17, раствор побелел. Раньше этого не происходило!!! Видимо поменялся состав амбробене? Но состав в инструкции тот-же. Конечно, в инструкции прописано разводить физ. р-ром, но для усиления муколитиаза в бронхах все же использовали мин. воду – и было все хорошо. А сейчас, когда раствор побелел, я его боюсь и не могу использовать не зная можно ли? Здравствуйте,Наталья Владимировна! Не думаю, что поменялся состав препарата. А вот в состав минеральной воды “Ессентуки” входят соли калия, кальция, магния, натрия и др. Возможно при взаимодействии с препаратом образовался небольшой осадок, за счет нерастворимых кальциевых солей. Думаю нужно проконтролировать качество минеральной воды. Добавил: Наталья Владимировна является ли 2-этилбутан изомером гексана Молекула 2-этилбутана теоретически является изомером гексана, т.к. имеет одинаковый качественный и количественный состав. Но правильно эту молекулу называть 2-метилпентан, исходя из правил номенклатуры ИЮПАК, согласно которой сначала выбирают самую длинную углеводородную цепь, затем нумеруют ее с того края ,где ближе расположен заместитель(радикал). Радикал в этой молекуле СН3 – метил и длинная углеводородная цепь насчитывает 5 атомов углерода, поэтому пентан. Добавил: marina Здравствуйте. Вопрос по электролизу фосфата калия (электроды графитовые): анод не растворим, соль кислородсожержащей кислоты, а калий в ряду напряжений до алюминия, значит, на катоде выделяется водород, а на аноде кислород. Но как ведут себя ионы калия в р-ре (образуется ли KOH) и тогда какое молекулярное уравнение? Или рассуждение неверное? Я прикрепила решение. Заранее спасибо) При электролизе фосфата калия электролизу подвергается вода. На катоде разряжается вода и образуется Н2. На аноде разряжается вода и образуется О2. Фосфат калия остается в растворе в виде соли. Гидроксида калия не образуется. Добавил: марина В нашей фирме обслуживает скважины, производит Канализация загородного дома. В Сервисе имеется к продаже ОБЕЗВОЖИВАТЕЛИ ОСАДКА И УТИЛИЗАЦИЯ, Силосы для хранения сыпучих продуктов, Промышленные смесители, Сжигание осадков сточных вод, Водоприемный колодец, Ершовая загрузка, Канализационные насосные станции (КНС), ОДЪЕМНЫЕ УСТРОЙСТВА И МЕТАЛЛОКОНСТРУКЦИИ Ангары, Павильоны, ВОДООЧИСТНОЕ ОБОРУДОВАНИЕ Биологическая очистка хоз.бытовых сточных вод, ПОДЪЕМНЫЕ УСТРОЙСТВА И МЕТАЛЛОКОНСТРУКЦИИ Ангары, Павильоны, ОЧИСТКА ЛИВНЕВЫХ СТОЧНЫХ ВОД Маслобензотделители, НАСОСНОЕ И КОМПРЕССОРНОЕ ОБОРУДОВАНИЕ (Грунфос, КСБ, Вило, КИТ, Взлёт, ТВП) Запорная арматура, ВОДОПОДГОТОВКУ Сорбционная фильтрация, а также все для автомойки Автомойки на базе песчанно-гравийной фильтрации. У нас вы найдете ЛОС, а также Нефтеуловители, мы можем произвести Обустройство скважин под ключ. Бурение артезианских скважин, Оценка запасов подземных вод, Монтаж водоснабжения. Диагностика скважин : [url=https://cpdisa.ru ] Обслуживание скважин[/url] Еще нет ответа на этот вопрос. Добавил: HauplE |
Источник
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и фтора:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
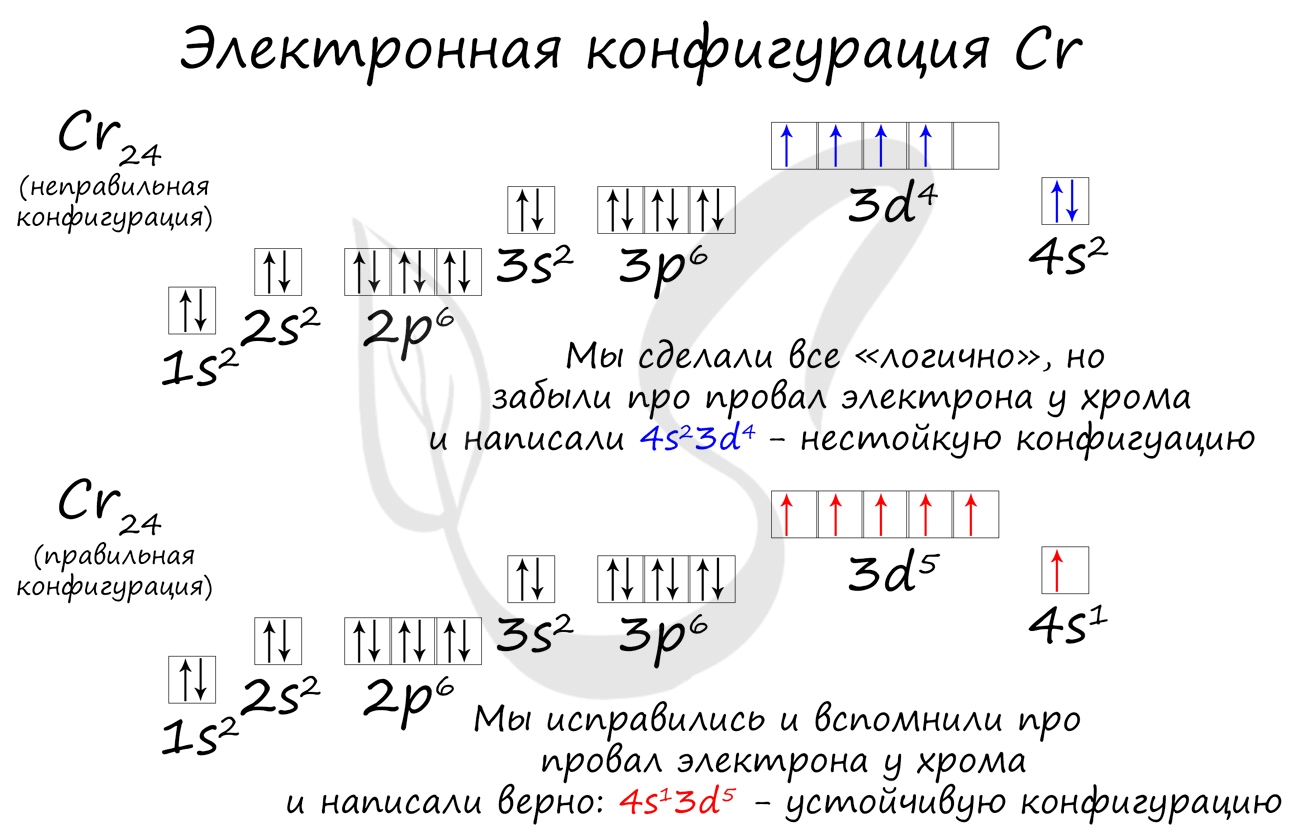
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

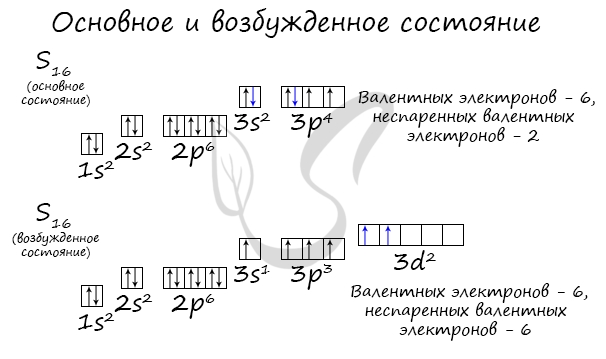
Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.

По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Ali Elaidy
17 июня 2019 · 159
TutorOnline – одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов. Наша цель… · tutoronline.ru
Атом углерода в органических соединениях имеет валентность четыре. Это объясняется с позиции теории гибридизации. Атом углерода переходит в возбужденное состояние 2s1 2p3. Одна s орбиталь и три p орбитали смешиваются, образую четыре гибридныеиорбитали, одинаковые по форме и энергии. Эти гибридные орбитали далее участвуют в образовании химических… Читать далее
Почему именно углерод является главным органическим элементом на планете Земля?
ALBA synchrotron, postdoc
Вообще, как мы тут недавно обсуждали в другом вопросе, практически любой вопрос “почему” в науке в конце концов приводит к ответу “таковы законы природы в нашей Вселенной”, который хоть и верен, но не слишком конструктивен:)
В частности, законы природы сложились так, что углерод с точки зрения химии оказался самым “никаким” элементом. Ему глубоко пофиг, с кем образовывать ковалентную связь – с другим углеродом, с водородом, с кислородом, с азотом. За счёт этого ему удаётся строить длинные и сложные, но при этом довольно стабильные молекулы. Для других элементов это не так. Кислород или азот образуют прочные связи с водородом, но не друг с другом (построение длинных цепочек азот-азот – вообще самый модный метод синтеза взрывчатки). Связь бор-бор по прочности близка к связи углерод-углерод, зато связь бор-водород очень слабая, а бор-кислород наоборот очень прочная.
Прочитать ещё 1 ответ
Может ли магнитное или электрическое поле покидать пределы горизонта событий черной дыры, в отличие от фотонов и других элементарных частиц?
Горизонт событий это изгиб пространства. Это легко представить бутылочным горлышком. Ничего не вырывается оттуда, потому-что само пространство “стягивается” на горизонте событий. Так же через это бутылочное горлышко черная дыра может испускать “избытки” материи. Чтобы магнитное поле было за пределами горизонта событий, оно должно пронизывать изгиб пространства насквозь, т.е. проще говоря телепартироваться. Гравитационная сила сильнее магнитной. Т.е. гравитация это более базовое пространство уже на котором формируется магнитное пространство. Однозначно эти две силы являются материальными но в более сложных измерениях, чем наше человеческое существование, т.е. чем наша естественная природа. Замечу, что это один из лучших вопросов и так же отмечу, что человечество до сих пор не знает что такое магнитное поле и строит только теории.
Прочитать ещё 2 ответа
Как определяют тип гибридизации электронных орбиталей в молекуле (с примерами)?
ALBA synchrotron, postdoc
Концепция гибридизации – это на самом деле весьма искусственно введённое приближение, цель которого состоит исключительно в том, чтобы сохранить стандартный язык двухцентровых химических связей и одновременно использовать идеи квантовой механики при качественном описании строения молекул. Поэтому в основном при разговоре о гибридизации идут от конца к началу: сначала смотрят на геометрию готовой молекулы, а потом ищут, какая должна быть гибридизация атомных орбиталей, чтобы эту геометрию получить. Для этого используется тот факт, что линейная комбинация решений уравнения Шредингера также является его решением.
Возьмём, например, метан. Реальные связывающие орбитали в нём выглядят примерно так:
В каждой из четырёх связывающих молекулярных орбиталей есть вклад от всех пяти атомов. Для того, чтобы говорить об отдельных связях, можно построить такие линейные комбинации этих молекулярных орбиталей, чтобы ненужные вклады взаимно уничтожились и получились четыре новые орбитали, в образовании каждой из которых участвует только один атом углерода и один атом водорода. Но при этом оказывается, что вклад от углерода уже не описывается чистыми 2s или 2p атомными орбиталями, а тоже оказывается их линейной комбинацией. Вот такую линейную комбинацию и называют гибридной атомной орбиталью. В случае метана оказывается, что каждая гибридная орбиталь является линейной комбинацией одной 2s-орбитали и трёх 2p-орбиталей, поэтому говорят об sp3-гибридизации.
Объясните чайнику: если до Большого взрыва Вселенная была бесконечно мала, то как называлось то пространство, которое ее окружало?
PhD, senior scientist AI, неандерталец
Разум цепляется за привычное. Например, мы привыкли, что все тела падают вниз. Привыкли настолько, что в Англии, на родине Ньютона, еще в девятнадцатом веке огромной общественной популярностью пользовалась книга, в которой «доказывалось», что Земля — плоская, ведь иначе мы бы с нее упали. Раз она плоская, у нее должен быть край. Однако, путешествие Магеллана показало — если плыть все время на запад, то снова приплывешь в Европу, только уже с востока. Итак, Земля — шар, а с тем, что люди на другой стороне ходят «вверх ногами», придется смириться, хоть это и противоречит «здравому смыслу».
Ну, «здравый смысл» с тех пор кое-как примирился с законом всемирного тяготения, но теперь есть новая задача — понять, как Вселенная может быть ограниченной в объеме и при этом не иметь «краев» и чего-то «вне». Что ж, лучшая аналогия — это старые игры, где, выходя за конец экрана, какой-нибудь пэкмен, или диггер, или змейка, или Марио оказывались с противоположного. Для них, таким образом, края экрана не существовало.
Ограниченная по объему трехмерная вселенная — это нечто подобное. Представьте себе: вы находитесь в комнате, у которой как будто две двери в противоположных стенах. Вы открываете дверь и видите такую же комнату и себя со спины, открывающего дверь в следующей стене, за которой видна еще одна комната и еще один вы, и так далее. И за спиной у вас скрипнула дверь — на самом деле та же самая, потому что дверь — одна. И происходит это не потому, что существует бесконечное число вас, а потому что вселенная зациклена сама на себя — просто свет делает несколько кругов по этой вселенной прежде чем достичь ваших глаз. Если в этой нашей вселенной сделать скорость света, к примеру, один метр в секунду, то вы будете видеть себя в другой комнате уже с задержкой в несколько секунд. Теперь добавим еще двери, точнее, одну дверь двум другим стенам комнаты. А теперь — люк в полу и потолке с теми же эффектами.
А теперь — уберем стены, пол и потолок! И увидим многократные копии себя же через равные промежутки пространства. Хотя на самом деле эти копии настолько же реальны, насколько ваше отражение в зеркале — то, что мы видим в зеркале отраженную комнату, отнюдь не значит, что есть еще одна комната.
Поздравляю! Вот вы и очутились во вселенной с ограниченным объемом, но без краев и чего-то «вне». Это лишь один из вариантов, тороидальный. В сферической вселенной вы бы видели размытый образ себя во всем поле зрения — причем, считая, что угол обзора у нас 180°, вы бы видели в упор свой затылок, а в нижнем краю зрения — макушку, в верхнем — подошвы обуви, а по бокам — уши. Но это уже мелочи.
Почему так не происходит в нашей Вселенной? Дело в том, что она расширяется, и достаточно удаленные ее участки улетают от нас быстрее скорости света. В общем, даже если вселенная конечна, свет, испущенный нами или отраженный от нас, просто не имеет возможности к нам возвратиться. Это — большой вариант комнаты.
А теперь рассмотрим противоположный сценарий. Будем сжимать нашу комнату без стен. Вот нам уже в ней неуютно. Вот вы в нее уже не помещаетесь, вас прижимает носом к своему собственному затылку, который вы видите перед собой, и вы чувствуете затылком, как к нему прижало ваш же нос. Вот комната становится размером с атомное ядро… И вот мы приходим в состояние «сразу» после Большого Взрыва. «Сразу» заключено в кавычки, потому что время — это тоже лишь измерение пространства. Так что нет не только «вне» вселенной, но и «до» Большого Взрыва. Ну, то есть, в одной из моделей.
Вот, как-то так.
Прочитать ещё 60 ответов
Что такое водородная связь?
Водородная связь – это связь между водородом и наиболее электроотрицательным элементом.
Например: S, N, O.
Её можно обнаружить во вторичной структуре белка.
По отдельности водородные связи слабы, но за счёт того, что в белке они образуются в огромных количествах, суммарно их вклад в поддержание вторичной структуры очень велик.
Прочитать ещё 1 ответ
Источник
