Сколько и каких орбиталей содержится в атоме углерода на внешнем электронном уровне
Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.

Атом углерода
Положение углерода в периодической таблице Менделеева:
- шестой порядковый номер;
- четвёртая группа;
- второй период.
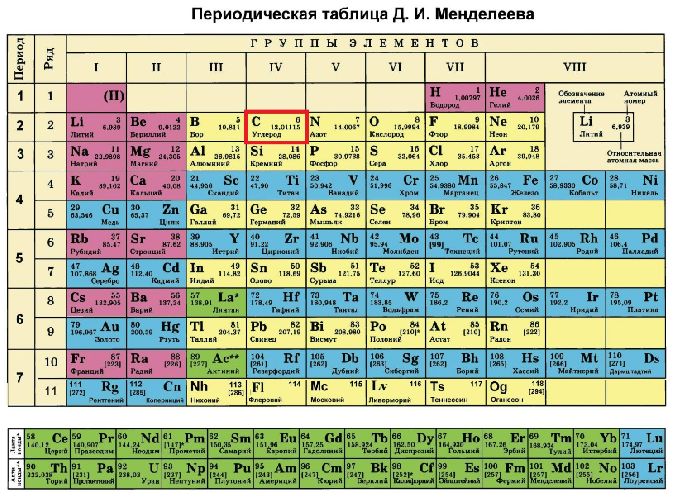
Рис. 1. Положение углерода в таблице Менделеева.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
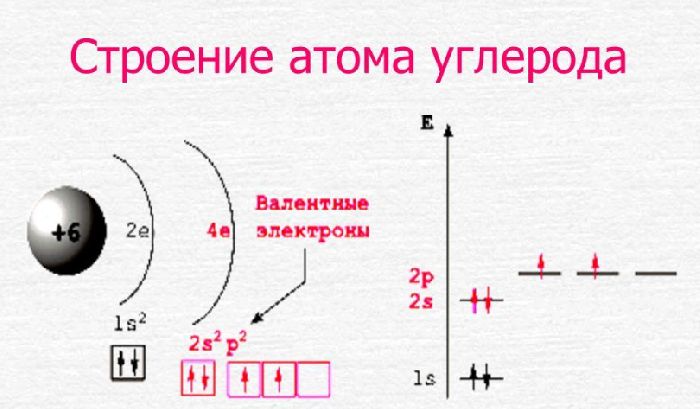
Рис. 2. Строение атома углерода.
Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
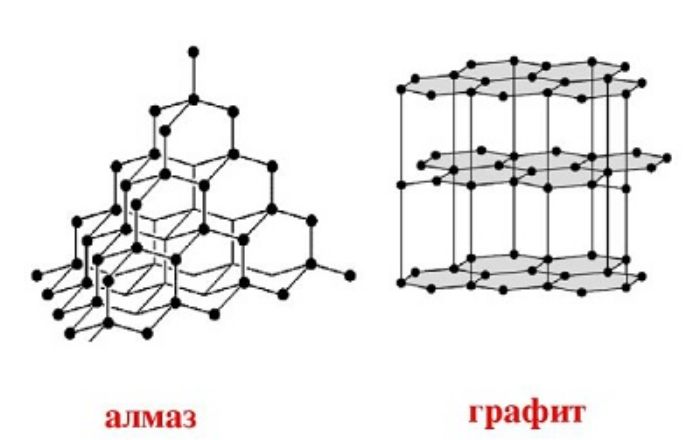
Рис. 3. Кристаллические решётки графита и алмаза.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
- С + О2 → СО2;
- 2С + О2 → 2СО.
Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
- 2H2SO4 + C → CO2 + 2SO2 + 2H2O;
- 4HNO3 + C → CO2 + 4NO2 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Даниил Шкарин
5/5
Оценка доклада
Средняя оценка: 4.1. Всего получено оценок: 307.
Источник
Характеристика атома углерода по положению в периодической системе
Рассмотрение особенностей строения атома углерода и его электронного состояния является основополагающим для правильного понимания теории химического строения. Рассмотрим сначала положение углерода в периодической системе (ПС). Для удобства характеристики элемента по ПС можно использовать следующий алгоритм:
Порядковый номер элемента (№) определяет его заряд ядра (зарядное число Z), а следовательно, количество протонов N
(обозначение протона —
) и общее количество электронов N
(обозначение электрона —
) в ядре. Для углерода порядковый номер равен 6, следовательно, ядро атома углерода состоит из 6 протонов и 6 электронов. Схематически это рассуждение можно записать следующим образом: №
.
Атомная масса элемента, или массовое число изотопа (A) равно сумме масс протонов и нейтронов (обозначение нейтрона — ) в ядре, следовательно, по разности можно вычислить количество нейтронов N. Для углерода атомная масса равна 12 а.е.м., следовательно, количество нейтронов в атоме углерода равно 6. Схематическая запись: аем.
Номер периода, в котором находится элемент в ПС, численно равен главному (радиальному)квантовому числу n и определяет число энергетических уровней в атоме. Иногда встречается другое обозначение главного квантового числа — (по Зоммерфельду). Углерод находится во втором периоде ПС, следовательно, имеет два энергетических уровня, главное квантовое число равно 2. Схематическая запись: № пер. = 2 => n = 2.
Номер группы, в которой расположен элемент в ПС, соответствует числу электронов на внешнем энергетическом уровне. Углерод расположен в IV группе главной подгруппы, следовательно, на внешнем энергетическом уровне у него 4 электрона. Схематическая запись: № гр. = IV => Nвалентных = 4.

Подводя итог, можно сказать, что в основном (невозбужденном) состоянии на внешнем энергетическом уровне атома углерода находятся 4 валентных электрона, при этом s-электроны образуют электронную пару, и 2 р-электрона не спарены.
Для валентного электронного слоя атома углерода главное квантовое число n равно 2, орбитальное квантовое число l равно 0, что соответствует s-орбитали и равно 1 для р-орбиталей; магнитное квантовое число m = –l, 0, +l; то есть m = 0 (при l = 0) и m = –1, 0, 1 (при l = 1).
Определение
Атомной орбиталью (АО) называется графическое трехмерное изображение электронной плотности, то есть область пространства, в которой вероятность нахождения электрона максимальна.
В органических соединениях атом углерода всегда четырехвалентен, это значит, что в образовании химической связи участвуют все 4 валентных электрона. Но в образовании связи участвуют только неспаренные электроны! Чтобы объяснить несоответствие между понятием валентности и электронным строением атома углерода, следует применить модель возбужденного состояния атома углерода , допускающая переход электрона с 2s- на 2р-подуровень:
В этом случае энергия, затрачиваемая на переход электрона, компенсируется энергией, высвобождаемой при образовании двух дополнительных связей. Однако такая модель предполагает нахождение электрона на четырех «чистых» орбиталях — одной s и трех р.
Тогда в возбужденной состоянии атома энергия s-орбитали должна быть меньше энергии образования р-орбиталей. На самом деле это не совсем так. Как показывают исследования, энергия всех четырех образующихся в результате «перескока» электрона орбиталей примерно одинаковая, соответственно, и энергии образования связей в молекуле с одинаковыми гетероатомами (например, атомами водорода в метане) тоже примерно равны, причем энергия каждой из вновь образующихся орбиталей больше, чем энергия «чистой» s-орбитали, но меньше, чем энергия «чистой» р-орбитали.

Источник
Атомная орбиталь
Все химические свойства веществ, то есть способность вступать в химические реакции, определяются строением электронных оболочек атомов. Электрон — главная элементарная частица для химии, так как именно благодаря обмену электронами могут образовываться новые химические соединения. Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех других частиц, он одновременно является и частицей, и волной. Говоря научным языком, имеет двойственную природу. С одной стороны, обладая малой массой (почти в 2 тыс. раз меньше, чем масса протона и нейтрона), электрон проявляет свойства частицы. С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако». В этой области пространства электронная плотность достаточно велика. Этим объясняются волновые свойства электрона. Дуализм электрона подтверждается экспериментально. Так, например, для потока электронов, как и для световых волн, характерны явления интерференции (наложения) и дифракции (огибание препятствия).

Определение
Атомная орбиталь — это область пространства, в которой вероятность нахождения электрона максимальна.

На каждой орбитали могут максимально размещаться два электрона, обладающие равной энергией, но отличающиеся особым свойством, спином.

Если очень условно уподобить электрон детской игрушке — волчку, то электроны с разными спинами будут соответствовать волчкам, вращающимся в разные стороны. Графически орбиталь принято изображать в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз. Стрелки, направленные в противоположные стороны, означают электроны с двумя противоположными спинами.
Электронные орбитали имеют определенную форму и энергию. Ряд орбиталей, обладающих равной или близкой энергией, образует энергетический уровень (слой). Номер уровня обозначают числом (n = 1, 2, 3…) или заглавной латинской буквой (K, L, M и дальше по алфавиту). Различают первый (n = 1 или K), второй (n = 2 или L), третий (n = 3 или M) и т. д. энергетические уровни, вплоть до бесконечности ( означает, что электрон улетает из атома, и атом превращается в ион). Уровень с номером n включает ровно орбиталей, на которых может разместиться максимально электронов. Номер энергетического уровня называют главным квантовым числом.
Таким образом, на первом энергетическом уровне могут максимально находиться 2 электрона, на втором — 8, на третьем — 18 и т. д.
Формы атомных орбиталей
Каждый энергетический уровень делится на энергетические подуровни, которые образованы орбиталями, имеющими одинаковую форму и равную энергию. По форме различают s-, p-, d- и f-орбитали. s-орбитали имеют форму шара, иными словами, электрон, находящийся на такой орбитали (его называют s-электроном), большую часть времени проводит внутри сферы. s-орбиталь, находящуюся на первом энергетическом уровне, обозначают 1s, на втором — 2s и т. д.

р-орбитали имеют форму объемной восьмерки (см. рис. б и в). Следует подчеркнуть, что любая орбиталь является объемной. Они могут быть направлены по одной из трех координатных осей (обозначаются ,, ), поэтому на каждом энергетическом уровне (кроме первого, где есть только s-орбиталь) существуют три р-орбитали, обладающие одинаковой энергией. Формы d- и f-орбиталей намного сложнее. На рисунке видно, что существует 5 форм d-орбиталей и 7 форм f-орбиталей. На каждой из орбиталей, как вы помните, могут размещаться не более двух электронов, следовательно, s-подуровень максимально вмещает 2 электрона, p — 6, d — 10, f — 14.

Орбитали одной и той же формы, но находящиеся на разных энергетических уровнях (например, 1s, 2s и 3s-орбитали), отличаются по энергии. Чем больше номер уровня, тем выше энергия орбитали и тем больше ее размер.
Рассмотрим три первых энергетических уровня. На первом уровне (n = 1) есть только 1s-подуровень (одна 1s-орбиталь), на котором максимально могут находиться два электрона (2 = 2×1). Второй энергетический уровень включает два подуровня: 2s- подуровень (одна 2s- орбиталь) и 2p-подуровень (три 2p-орбитали), всего четыре орбитали, на которых может находиться до 8 электронов (8 = 2×22). В состав третьего уровня (максимально 18 электронов) входят три подуровня: 3s- (одна орбиталь), 3p- (три орбитали) и 3d- (пять орбиталей), всего 9 орбиталей, содержащих не более 18 электронов (18 = 2×32).
| Номер энергетического уровня (n) | Подуровни и их схематичное изображение | Максимальное число электронов на энергетическом уровне () | |||
|---|---|---|---|---|---|
| s- | p- | d- | f- | ||
| 1 | 2 | ||||
| 2 | 8 | ||||
| 3 | 18 | ||||
| 4 | 32 | ||||
Электроны занимают уровни и орбитали последовательно, в порядке увеличения энергии. Сначала заполняется первый энергетический уровень, после его завершения — второй и т. д.
Принципы построения электронной конфигурации элемента
Количество электронов в атоме элемента равно его порядковому номеру.
Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням.

Разместим уже известные нам орбитали на энергетической диаграмме. Каждую незаполненную орбиталь мы обозначим пустым квадратиком (вертикальная ось показывает направление возрастания энергии).
Для полного описания электронного строения атома надо знать, как именно распределены электроны по энергетическим уровням. Перечень энергетических уровней, заполненных электронами, называют электронной конфигурацией атома.
При заполнении орбиталей электронами используют следующие правила.
Принцип минимума энергии
Орбитали заполняются в порядке увеличения энергии, снизу вверх. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией.
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
Принцип Паули
На каждой орбитали может находиться не более двух электронов. Если два электрона находятся на одной орбитали, то они обладают противоположными спинами (стрелки направлены в разные стороны). Такие электроны называют спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.
Правило Хунда (Гунда)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Обратите внимание, что 4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь. Это означает, что в первую очередь электроны заполнят 4s-подуровень и лишь затем 3d-подуровень. Для удобства запоминания порядка заполнения энергетических подуровней лучше воспользоваться следующей схемой: в каждой отдельной строке написать возможные типы орбиталей для каждого уровня, провести стрелки под углом 45 и «расселять» электроны по подуровням, ориентируясь по стрелкам сверху вниз.

Запись электронной конфигурации атома
Подробные электронные конфигурации атомов изображают двумя способами:
графически, с помощью квадратиков со стрелками (часто называют энергетическими диаграммами);
в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.

Рассмотрим порядок заполнения электронами энергетических уровней, воспользовавшись периодической системой. Число электронов в атоме элемента, как вы помните, равно заряду его ядра, а следовательно, и порядковому номеру элемента в периодической системе. Так, например, в атоме водорода (N = 1) содержится всего один электрон, а в атоме кислорода (N = 8) — восемь. В каждом периоде периодической системы электронная оболочка атома каждого последующего элемента повторяет строение электронной оболочки предыдущего элемента с добавлением одного электрона.
Число заполненных энергетических уровней в атоме равно номеру периода, в котором расположен элемент.
Электронные конфигурации некоторых элементов
Первый энергетический уровень вмещает максимально два электрона. Поэтому первый период состоит лишь из двух элементов — водорода и гелия. Простейший из атомов — водород, H. Он содержит один электрон, который занимает орбиталь с самой низкой энергией — 1s-орбиталь. Электронная конфигурация атома водорода. В атоме гелия первый энергетический уровень полностью завершен.


У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.

В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.

В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).

Определение
Элементы, в атомах которых происходит заполнение предвнешнего энергетического уровня, называют переходными.
Такие элементы расположены в побочных подгруппах периодической системы. Начиная с элемента галлия заполнение четвертого уровня продолжается.
Химические свойства элементов определяются не всеми электронами, а только внешними, обладающими наибольшей энергией.
Внешние электроны называют валентными, и их количество, как правило, равно номеру группы, в которой расположен элемент.
Их атом может отдавать в результате химических реакций, они обуславливают его химические свойства. У элементов главных подгрупп валентными являются электроны внешнего энергетического уровня. Число валентных электронов равно номеру группы, в которой находится элемент. Например, водород, натрий и калий, расположенные в первой группе, имеют по одному валентному электрону, а элементы четвертой группы — углерод и кремний — по четыре. Как вы помните, элементы, входящие в одну и ту же подгруппу, обладают сходными химическим свойствами. Это объясняется тем, что они имеют сходные электронные конфигурации, т. е. являются электронными аналогами. Полностью завершенные внутренние энергетические уровни не оказывают существенного влияния на химические свойства.
Элементы, в атомах которых валентные электроны расположены на s-подуровне, называют s-элементами, p-подуровне — p-элементами, d-подуровне — d-элементами, а f-подуровне — f-элементами.
s-элементы расположены в начале периодов, а р-элементы — в конце. В короткопериодном варианте периодической системы f-элементы (лантаноиды и актиноиды) вынесены за пределы таблицы. Малые периоды и главные подгруппы состоят лишь из s- и р-элементов. Все d- и f-элементы расположены в побочных подгруппах.
В длиннопериодном варианте s-, p-, d- и f-элементы занимают отдельные поля.
Именно конфигурация валентных электронов определяет то, является ли элемент металлом или неметаллом, с какими другими элементами он может взаимодействовать и какова его валентность. При заполнении орбиталей электронами конфигурация валентных электронов периодически повторяется, что приводит к периодическому изменению химических свойств элементов.
Пример
Записать электронную конфигурацию и энергетическую диаграмму атома серы, указав распределение электронов по уровням и подуровням.
Сера расположена в третьем периоде и VI (6) группе, порядковый номер — 16.

Значит, в атоме серы всего 16 электронов, которые расположены на трех энергетических уровнях (т. к. номер периода = 3), причем на последнем (валентном) уровне находится 6 электронов (т. к. номер группы = 6). В соответствии с принципом минимума энергии расположим электроны по подуровням.
Электронная конфигурация атома серы тогда выглядит следующими образом: .
«Проскок» или «провал» электрона
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди, исходя из вышенаписанного, должна иметь вид: Cu . Однако в действительности один из двух 4s-электронов «проваливается» на 3d-подуровень, и атом меди имеет следующую конфигурацию: .

Для элементов IБ-подгруппы характерна конфигурация внешнего слоя: .
Для элементов Cr и Mo характерна конфигурация внешнего слоя: .
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Возбужденное состояние атома
Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома.
Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень.
Определение
Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома.
Возбужденное состояние атома является неустойчивым, и через некоторое время электрон теряет энергию, перейдя на энергетическую орбиталь с меньшей энергией, испустив при этом квант света.
Определение
Состояние, которое требует для повышения энергии электрона наименьших энергетических затрат, называют первым возбужденным состоянием. Состояние, при котором все валентные электроны являются неспаренными, называют максимально возбужденным состоянием.
Например, для атома хлора возможны три возбужденных состояния, обозначенные на рисунке как Cl*, Cl**, Cl***, причем последнее является максимально возбужденным состоянием. У атомов в возбужденном состоянии меняется число валентных электронов и, соответственно, возможная степень окисления.

Источник
