Сравните свойства фенола и бензола какой реакцией это можно подтвердить
Среди мыслительных приемов обучения химии важное место занимает сравнение. Процесс сравнения активизирует познавательную деятельность, развивает абстрактное мышление, сознательное и прочное усвоение знаний. Данный прием состоит из сопоставления, когда выделяются признаки, по которым проводится сравнение, и собственно сравнения, устанавливающего сходство и различие между объектами.
Предметы или явления можно сравнивать по одному или нескольким признакам. В процессе сравнения школьники изучают не только внешние признаки, но и свойства. Сравнение помогает проследить предметы и явления в изменении и развитии.
Сравнивая предметы и явления друг с другом, учащиеся выделяют частные и общие, существенные и несущественные признаки. На выделении общих и существенных признаков основано обобщение. Именно оно ведет к образованию понятий, к познанию закономерных связей и отношений.
Сравнение дает возможность определить новые стороны объектов, их связи, такие черты предметов и явлений, которые не воспринимаются при изучении их в отдельности. В процессе сравнения ученики проникают в сущность объектов, без посторонней помощи замечают неощутимые с первого взгляда свойства, постигают особенности явлений.
При сравнении объектов необходимо соблюдать следующие требования:
Для сравнения следует отбирать объекты, имеющие определенную связь между собой. Например, можно сравнивать строение и химические свойства бензола и фенола; бензола и анилина; бензола, фенола и анилина; строение и свойства водородных соединений в периоде (СН4, NH3, Н2О, НF) и в подгруппе (HF, НСl, НВr, НI).
Необходимо четко определять признаки (свойства) , по которым сравниваются объекты. Так, сравнивать физические свойства металлов можно по плотности, электрической проводимости, теплопроводности и т. п.
Перечень признаков должен быть по возможности более полным, исчерпывающим. Например, для сравнения пространственного строения молекул начальных представителей предельных, этиленовых, ацетиленовых и ароматических углеводородов выделяют совокупность признаков: тип гибридизации, валентный угол, межъядерное расстояние, форма молекул.
Успех учения во многом зависит от того, обладают ли ребята умением определять сходное и различное. Им обязательно нужно научиться замечать сходное там, где с внешней стороны явления сильно отличаются друг от друга, и находить различие в тех случаях, когда ярко внешнее сходство.
Парадоксально, но факт: школьники часто не могут изменить способ действия при выполнении заданий и все делают по шаблону, но в то же время не применяют усвоенные действия там, где это необходимо, потому что не умеют устанавливать сходство. Этим объясняется значительная часть ошибок, допускаемых при обучении химии. Например, ребята затрудняются ответить на вопрос, в чем сходство и различие реакций нейтрализации при взаимодействии растворимых и нерастворимых оснований с кислотами с точки зрения теории электролитической диссоциации, утверждая, что различия между ними не существует, т. к. в обоих случаях сущность реакций сводится к образованию слабодиссоциирующего вещества – воды. Однако составление уравнений таких реакций в сокращенной ионной форме помогает им установить и сходство, и различие.
Как предупредить подобные ошибки? Как можно их устранить, если они уже допущены? Практика показывает, что легче всего различаются противоположные явления. Психологические исследования доказывают, что противопоставление различных по содержанию понятий и правил предохраняет их в дальнейшем от смешения.
Использовать на занятиях противопоставление можно различными способами. В первом случае два понятия (или правила) подаются для сопоставления одновременно. Во втором – сначала изучается одно понятие, а затем после прочного его усвоения вводится второе – как противопоставление первому. Однако есть еще возможность после достаточно хорошего усвоения обоих понятий провести их сравнение. Какой из этих путей наиболее эффективен?
Источник
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: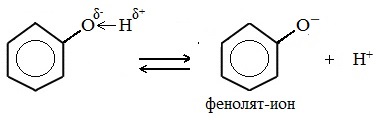
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: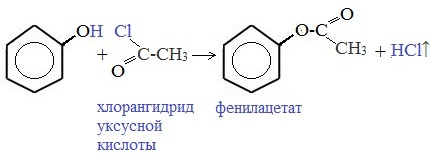
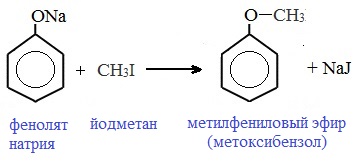
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
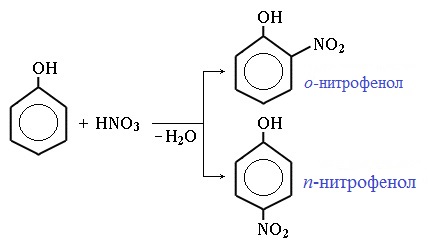
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):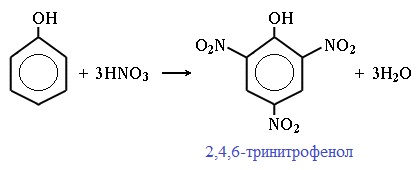
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):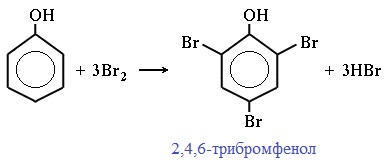
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: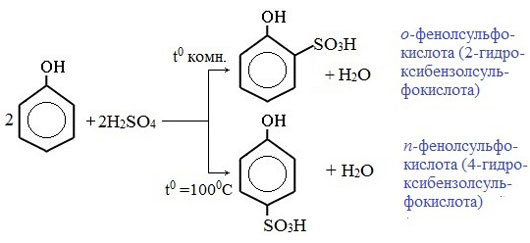 Реакции присоединения
Реакции присоединения
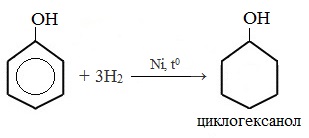
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
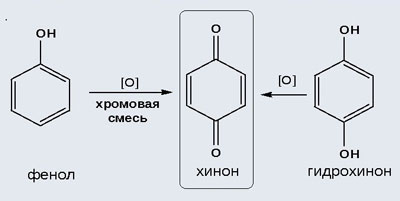
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! – обнаружение фенола
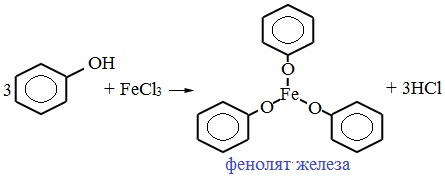
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:

Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Источник
Реакции фенола по бензольному кольцу
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения (SE) в ароматическом кольце
(часть I. Электрофильные реакции).
Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
Пикриновая кислота – кристаллическое вещество желтого цвета. Первый синтетический краситель тканей. Тривиальное название дано за горький вкус (от греч. pykros – горький). Соли пикриновой кислоты – пикраты калия и аммония – сильные взрывчатые вещества. Из пикриновой кислоты ранее получали боевое отравляющее вещество – хлорпикрин. В период русско-японской войны (1904-1905) пикриновая кислота использовалась японской армией в артиллерийских снарядах в качестве взрывчатки, названной шимоза (по имени инженера Масатики Симосэ).
Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
Данная реакция протекает количественно (почти на 100%) и позволяет обнаружить фенол даже при очень малых концентрациях (до
10-4 моль/л).
Поэтому она используется не только для качественного, но и для количественного определения фенола.
Видеоопыт “Взаимодействие фенола с бромной водой”.
Конденсация с альдегидами и кетонами. Практическое значение имеют реакции конденсации фенола с формальдегидом H2C=O и с ацетоном (CH3)2C=O.
Эти реакции идут по типу электрофильного замещения в бензольном кольце. Электрофильным реагентом является альдегид или кетон за счёт пониженной электронной плотности (частичного положительного заряда δ+) на атоме углерода в полярной карбонильной группе >Cδ+=Oδ–. Фенольный гидроксил как электронодонорный заместитель (+M-эффект) ориентирует электрофильное замещение в орто- и пара-положения бензольного кольца.
- Фенол с формальдегидом H2C=O при конденсации образуют фенолоформальдегидные смолы.
Фенолоформальдегидные смолы – относительно недорогие полимерные вещества, широко используемые на практике в качестве связующего компонента в стеклопластиках, древесно-волокнистых (ДВП) и древесно-стружечных плитах (ДСП), в клеях БФ-2, БФ-6 и др.
В основе процесса образования фенолоформальдегидных смол лежит реакция поликонденсации, то есть конденсации, приводящей к образованию полимеров.
Поликонденсация фенола с формальдегидом ведется при нагревании в присутствии катализатора (кислоты или основания) и включает ряд последовательных реакций:

Для фенола эта реакция идёт как электрофильное замещение (SE) в бензольном кольце,
а для формальдегида – как нуклеофильное присоединение (AdN) по связи Сδ+=Oδ–.

и так далее . . .
Образование линейного фенолоформальдегидного полимера схематически можно записать в следующем виде:
Формальная схема образования полимера (управляемая анимация)
Формальная схема образования полимера
В избытке формальдегида и при нагревании в щелочной среде в реакции участвуют как орто-, так и пара-положения молекул фенола. При этом образуется сетчатый полимер . Подробнее >>
. Подробнее >>
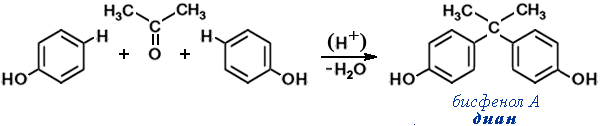
- Конденсация фенола с ацетоном (CH3)2C=O (реакция Дианина) имеет важное практическое значение как способ получения бисфенола А — необходимого полупродукта в производстве эпоксидных смолЭпоксидные смолы — олигомеры, содержащие эпоксидные группы и способные под действием отвердителей образовывать сшитые полимеры. Наиболее важные представители — продукты поликонденсации эпихлоргидри-на с бисфенолом А (дианом). и поликарбонатов,Поликарбонаты — сложные полиэфиры угольной кислоты и двухатомных спиртов или фенолов общей формулы
(-O-R-O-CO-)nНаибольшее практическое значение имеют ароматические поликарбонаты, в первую очередь, поликарбонат на основе бисфенола А (диана). широко применяемых в различных областях промышленности, науки и техники.
Подробнее

Реакции I и II — электрофильное замещение в бензольном кольце фенола с участием пространственно более доступного пара-положения. Кислотный катализ активирует электрофильные реагенты, превращая их в карбокатионы:
Бисфенол А называют “дианом” в честь русского химика А.П. Дианина, впервые получившего это соединение и открывшего конденсацию фенолов с кетонами.
Эпоксидные смолы получают при взаимодействии диана с эпихлоргидриномСхема синтеза эпихлоргидрина.
Подробнее >>
Поликарбонаты образуются при поликонденсации диана и фосгена (дихлорангидрида угольной кислоты):

Источник
Конкурс “Я иду на урок”
Урок-обобщение
10 КЛАСС
Цель. Сформировать представление о
том, что свойства гидроксигруппы в соединении
могут меняться в зависимости от характера
связанного с ней углеводородного радикала и что
свойства самого радикала также меняются под
влиянием функциональной группы –ОН.
Вещества. С6Н5ОН (раствор и
расплав), Na, NaOH (р-р), FeCl3, Br2, C6H6,
H2O, KMnO4 (р-р), фенолфталеин.
Девиз урока. Для описания свойств
вещества достаточно знать его электронную
структуру.
ХОД УРОКА
Тестирование. На доске записаны
формулы веществ:
Определите, какое из перечисленных веществ:
1) пентанол; 2) гексанол; 3) двухатомный спирт; 4)
трехатомный спирт; 5) винный спирт; 6) насыщенный
алифатический спирт, R которого содержит 4 атома
С; 7) взаимодействует со спиртами с образованием
сложных эфиров; 8) дает качественную реакцию на
многоатомные спирты.
(Ответы. 1 – г; 2 – е; 3 – в; 4 – д; 5 – б; 6 – л; 7 –
м; 8 – п.)
Задание у доски. Составить
структурные формулы гидроксильного
производного бензола СН3С6Н4ОН и его изомеров. На
какие две группы их можно разделить?
Объяснение нового материала
1. Фенолы и ароматические спирты.
Какое определение можно дать веществам, исходя
из составленной схемы? К каким классам
органических веществ они относятся и почему?
Разберем более подробно свойства фенола.
2. Физические свойства фенола.
С6Н5ОН – бесцветное
кристаллическое вещество, tпл =
40,9 °С, плохо растворим в воде (8% при 20 °С).
Демонстрационный эксперимент Сравнение
растворимости бензола и фенола в воде
Бензол практически нерастворим в воде, его
растворимость при 20 °С равна 0,07%. Получается,
что фенол в 100 раз более растворим в воде, чем
бензол. В чем причина такого отличия?
Вывод. Растворимость фенола
обусловлена наличием водородной связи между
гидроксильной группой фенола и молекулой воды:
3. Химические свойства фенолов.
Сходен ли фенол с предельными одноатомными
спиртами? Как это сходство повлияет на
химические свойства фенола?
а) Рассмотрим реакции фенола по ОН-группе:
Кислотные свойства у фенола выражены сильнее,
чем у спирта С2Н5ОН. Фенол – слабая
кислота (карболовая).
б) Реакция фенола по бензольному кольцу:
4. Взаимное влияние атомов в молекуле.
Сравним подвижность атомов водорода
гидроксильных групп фенола С6Н5ОН и
спирта ROH. В каком случае атом Н в гидроксигруппе
более подвижен? Почему?
Бензольное кольцо в феноле обладает
электроноакцепторными свойствами. Оно смещает
электронную плотность атома кислорода в свою
сторону. При этом увеличивается электронная
плотность в бензольном ядре (особенно в орто- и
параположениях). Электронная пара связи О–Н
сильнее притягивается к атому кислорода. Поэтому
связь О–Н становится менее прочной и легче
происходит отщепление водорода в виде протона.
Напротив, в спиртах алкильные группы R обладают
электронодонорными свойствами, т. е.
способностью отталкивать электронную плотность.
В результате электронная плотность связи О–Н
возрастает, связь упрочняется.
Вывод. Органические радикалы R
соединений ROH следующим образом влияют на
подвижность гидроксильного протона: алкильные
группы C2H5 –, CH3 – в спиртах
уменьшают подвижность протона О–Н, тогда как
арильные группы в фенолах, например C6H5
–, такую подвижность увеличивают.
Мы рассмотрели смещение электронной плотности
в молекулах фенола, разобрали его химические
свойства.
Какой вывод о взаимном влиянии атомов в молекуле
фенола можно сделать?
Фенильная группа C6H5 – и гидроксил
–ОН взаимно влияют друг на друга.
Начиная с многоатомных спиртов мы с вами будем
обращать внимание на качественные реакции.
Качественной реакцией на фенол является
взаимодействие с FeCl3:
Закрепление материала темы
1) Почему С6Н6 и С6Н5ОН
обладают разной растворимостью в воде?
2) Как доказать, что С6Н5ОН является
кислотой?
3) Как происходит смещение электронной плотности
в молекуле С6Н5ОН?
4) Какое влияние оказывают радикалы спиртов на
подвижность атома Н в ОН-группе?
5) Дать определение фенолов.
Упражнение. Являются ли
гомологами следующие пары веществ:
Дайте обоснованный ответ в свете теории
строения органических веществ.
Домашнее задание.
Учебник: Рудзитис Г.Е., Фельдман Ф.Г. Химия-10.
М.: Просвещение, 1990. Глава VII, § 3, с. 90–94; задачи 1 и 3,
с. 94.
Л.А.ЕРЕМИНА,
учитель химии школы № 24
(г. Абакан, Хакасия)
Источник
