Свойства вещества зависят не только от того какие атомы
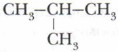
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
Основы новой теории сформулировал в 1861 г. профессор Казанского университета Александр Михайлович Бутлеров.
В химии к тому времени уже значительное распространение получили идеи атомистики. Ранее не разграничивавшиеся четко понятия атома и молекулы получили на международном съезде химиков в 1860 г. свое точное определение. Но ученые еще не придавали значения тому, как строятся молекулы из атомов, и считали, что познать это строение химическими методами невозможно. Были и такие ученые, которые вообще не признавали реального существования атомов и молекул.
А. М. Бутлеров не только считал атомы и молекулы реально существующими частицами вещества, но и пришел к выводу, что атомы в молекулах не находятся в беспорядке, а соединены друг с другом в определенной последовательности, которую можно установить химическими методами и отразить в формуле.
Основную идею своей теории А. М. Бутлеров выразил в следующих словах: «Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением». В более привычной для нас терминологии это означает, что химические свойства молекулы определяются свойствами составляющих ее атомов, их числом и химическим строением молекулы.
Химическое строение, по А. М. Бутлерову, – это последовательность соединения атомов в молекуле, порядок их взаимосвязи и взаимного влияния друг на друга. Соединение атомов в молекулы, указывал А. М. Бутлеров, происходит в соответствии с их атомностью (валентностью).
Основываясь на приведенных выше высказываниях А. М. Бутлерова, сущность теории химического строения можно выразить в следующих положениях:
1. Атомы, в молекулах располагаются не беспорядочно, они соединены друг с другом в определенной последовательности согласно их валентности.
2. Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах, от порядка их взаимного влияния друг на друга.
3. Атомы и группы атомов, входящие в состав молекулы соединения, оказывают друг на друга взаимное влияние, которое в наибольшей мере проявляется для атомов и групп, непосредственно связанных между собой.
4. Химическое строение (структурную формулу) молекулы можно установить при помощи изучения типичных ее превращений. Вместе с тем многие химические свойства соединений выводятся на основании анализа структурных формул.
Рассмотрим на примере известных нам углеводородов первое из этих положений. В какой последовательности соединены атомы в молекуле простейшего углеводорода – метана? Мы уже знаем, что каждый атом Гидрогена в нем соединен с атомом Карбона. Легко понять, что иначе и быть не может. Если, например, предположить, что какие-нибудь два атома Гидрогена связаны друг с другом непосредственно, то, исчерпав при этом свою валентность, они уже не смогут соединяться с другими атомами. Обозначая валентность элементов условно черточками, мы так изображаем порядок связи атомов в молекуле метана:
Чтобы в молекуле этана C2H6 все атомы Карбона и Гидрогена были соединены в одну частицу, очевидно, должны быть связаны между собой атомы Карбона. Затратив на взаимное соединение по единице валентности, атомы Карбона имеют еще по три единицы валентности, за счет которых они и удерживают шесть атомов Гидрогена:
В молекулах пропана C3H8 и бутана C4H10 атомы соединены в таком порядке:
Зная строение углеводородов, мы теперь можем ответить на некоторые из тех вопросов, которые волновали в свое время ученых.
В чем причина многообразия соединений Карбона? Как видим, она заключается в том, что атомы Карбона обладают свойством соединяться друг с другом в цепи.
Нарушается ли валентность элементов в рассмотренных соединениях? Нет, Карбон всюду остается четырехвалентным.
Химические формулы, в которых изображен, порядок соединения атомов в молекулах, называются структурными формулами или формулами строения.
Следует иметь в виду, что подобные формулы отображают только последовательность соединения атомов, но не показывают, как атомы расположены в пространстве. Поэтому, как бы мы ни изобразили структурную формулу пропана:
это будет одна и та же молекула, так как порядок, последовательность соединения атомов не изменяется.
Структурные формулы веществ часто изображают в сокращенном виде, например: CH3–CH2–CH3. В сокращенных структурных формулах черточки обозначают связь атомов Карбона между собой, но не показывают связи между атомами Карбона и Гидрогена.
1 | 2 | 3 |
Источник
Глава 2. Теория строения органических соединений
Теория (от греч. theoria — «исследование») — это система обобщённых знаний, объясняющих те или иные стороны действительности. Ядро любой теории составляют её основные понятия и законы, а суть теории выражают её основные положения. Теория является важным инструментом научного познания, направлена на обобщение, систематизацию, объяснение и предсказание явлений. Изученная и усвоенная теория становится средством добывания новых знаний.
 Повторите из курса 9 класса основные положения теории химического строения. Какое значение они имели для развития химии?
Повторите из курса 9 класса основные положения теории химического строения. Какое значение они имели для развития химии?
К концу 50-х гг. XIX в. органическая химия накопила массу фактов об органических веществах и их свойствах. Методом экспериментального анализа были определены качественный и количественный состав многих природных органических соединений и их молекулярные формулы. Но этот материал не был достаточно систематизирован. Ряд особенностей органических соединений (они рассмотрены в § 1) не находили объяснения на основе имеющихся в то время теоретических представлений, например явление изомерии, открытое ещё в 20-е гг. XIX столетия. Учёных смущало и то, что многие органические соединения имели несколько химических формул. Например, хорошо известной уксусной кислоте приписывали два десятка формул.
В науке насущными стали вопросы: являются ли молекулы органических веществ беспорядочным нагромождением атомов, или же они имеют упорядоченное строение, и можно ли его установить путём экспериментального исследования веществ?
 Большинство химиков середины XIX в. вообще отрицали возможность познать структуру органических веществ. Теории, которая могла бы объяснить структуру молекул, ещё не было. Но база для этого была уже создана. Так, Э. Франкланд ввёл понятие «валентность». Ф.-А. Кекуле и А. Кольбе определили четырёхвалентность углерода и одновременно с А. Купером установили способность углерода образовывать углеродные цепи. Они предложили связи между атомами углерода обозначать чёрточкой (С—С). Но эти учёные отрицали возможность устанавливать истинное строение органических соединений по их химическим превращениям.
Большинство химиков середины XIX в. вообще отрицали возможность познать структуру органических веществ. Теории, которая могла бы объяснить структуру молекул, ещё не было. Но база для этого была уже создана. Так, Э. Франкланд ввёл понятие «валентность». Ф.-А. Кекуле и А. Кольбе определили четырёхвалентность углерода и одновременно с А. Купером установили способность углерода образовывать углеродные цепи. Они предложили связи между атомами углерода обозначать чёрточкой (С—С). Но эти учёные отрицали возможность устанавливать истинное строение органических соединений по их химическим превращениям.
Убеждённым сторонником познаваемости строения органических веществ был А.М. Бутлеров.

К 50-м гг. XIX в. острой стала задача выявления зависимости свойств веществ не только от состава, но и от их строения. Требовалась теория, способная обобщить и систематизировать накопленный материал, объяснить строение органических веществ. Её отсутствие заметно тормозило развитие науки.
Такую теорию в 60-е гг. создал известный русский химик Александр Михайлович Бутлеров, назвавший её теорией химического строения. Основную идею и положения своей теории А.М. Бутлеров сформулировал в 1861 г. в статье «О химическом строении вещества». Под химическим строением он понимал последовательность соединения атомов в молекулах.
При создании теории учёный опирался на известные к тому времени представления о четырёхвалентности атома углерода, способности его атомов соединяться между собой, образуя углеродные цепи, а также на уже разграниченные понятия «атом» и «молекула». А.М. Бутлеров отмечал, что чёткие представления о химической частице и определение понятий «атом» и «молекула» были самым существенным успехом химии, позволившим перейти к выявлению химического строения веществ.
 В создании своей теории А.М. Бутлеров исходил из научных и философских представлений о реальном существовании атомов и молекул, о возможности познания химической связи между атомами. Большое значение имел учёт особенностей элемента углерода и его соединений. Бутлеров доказал, что строение молекулы можно установить опытным путём, изучая превращение вещества, и, наоборот, зная строение молекулы, можно предсказать его свойства. Главным в создании теории было познание внутренней структуры молекул, которую учёный называл «химическим строением». Важной была идея Бутлерова о том, что атомы, соединяясь в молекулу в определённой последовательности и согласно их валентности, взаимно влияют друг на друга. Взаимное влияние атомов изменяет и их собственную природу. Например, вам уже известно, что свойства атома водорода в соединениях НС1, Н2O, NH3 в водных растворах существенно различны. Так же можно сравнить между собой и органические вещества, имеющие одинаковые элементы или группы атомов, но по-разному связанные между собой и влияющие друг на друга.
В создании своей теории А.М. Бутлеров исходил из научных и философских представлений о реальном существовании атомов и молекул, о возможности познания химической связи между атомами. Большое значение имел учёт особенностей элемента углерода и его соединений. Бутлеров доказал, что строение молекулы можно установить опытным путём, изучая превращение вещества, и, наоборот, зная строение молекулы, можно предсказать его свойства. Главным в создании теории было познание внутренней структуры молекул, которую учёный называл «химическим строением». Важной была идея Бутлерова о том, что атомы, соединяясь в молекулу в определённой последовательности и согласно их валентности, взаимно влияют друг на друга. Взаимное влияние атомов изменяет и их собственную природу. Например, вам уже известно, что свойства атома водорода в соединениях НС1, Н2O, NH3 в водных растворах существенно различны. Так же можно сравнить между собой и органические вещества, имеющие одинаковые элементы или группы атомов, но по-разному связанные между собой и влияющие друг на друга.
В основу теории химического строения были положены фундаментальные понятия: «химические частицы (атомы, молекулы)», «валентность», «химическое строение», «изомерия».
Основные положения теории химического строения
1. Атомы в молекулах соединены в определённой последовательности химическими связями. Порядок связи атомов называется химическим строением. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2. Соединение атомов в молекулу происходит в соответствии с их валентностью. Валентность углерода в органических веществах равна IV.
3. Свойства веществ зависят не только от их качественного и количественного состава, но и от того, в каком порядке атомы в молекуле соединены, т. е. от химического строения их молекул.
4. Многие органические вещества способны к изомерии.
5. Порядок связи атомов (химическое строение молекул) можно изучать и устанавливать химическими методами.
6. Атомы или группы атомов в молекуле взаимно влияют друг на друга, что сказывается на реакционной способности молекулы. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой. Это положение в равной степени относится как к органическим, так и к неорганическим веществам.
Следствия теории химического строения
Изомерия — важнейший объект, явленние и понятие теории химического строения.
 Вспомните из курса химии 9 класса, какое явление называется изомерией и что такое изомеры. Приведите примеры изомеров.
Вспомните из курса химии 9 класса, какое явление называется изомерией и что такое изомеры. Приведите примеры изомеров.
Важным положением теории А.М. Бутлерова является объяснение способности многих органических веществ к изомерии, установление причины этого явления. Утверждению этого положения теории способствовало предсказание Бутлеровым существования двух изомеров бутана с общей формулой С4Н10: СН3—СН2—СН2—СН3 (нормальный бутан) и 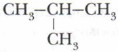 (изобутан) с последующим синтезом предсказанного изобутана.
(изобутан) с последующим синтезом предсказанного изобутана.
Предсказание и синтез изомеров бутана стали блестящим подтверждением правильности теории Бутлерова и выявили её основные функции — объяснение и прогнозирование.
А.М. Бутлеров вскрыл причину изомерии. Она состоит в том, что вещества с одинаковой общей формулой могут иметь разную последовательность соединения атомов в молекуле, то есть различаться химическим строением. Позднее такие соединения были названы структурными изомерами.
Структурная изомерия — это явление существования соединений, имеющих одинаковый качественный и количественный состав, но отличающихся последовательностью связывания атомов в молекуле, а следовательно, строением и свойствами.
Каждой теории химии присущ свой научный язык (символика, номенклатура, терминология). Для изображения структурных изомеров А.М. Бутлеров использовал структурные формулы, которые отражают химическое строение молекул, го есть последовательное соединение их атомов, и подтвердил, что каждое вещество имеет только одну структурную формулу.
Например, вещества с молекулярной формулой С5Н19 можно изобразить следующими структурными формулами, которые отражают строение трёх разных соединений, отличающихся друг от друга физическими и химическими свойствами:
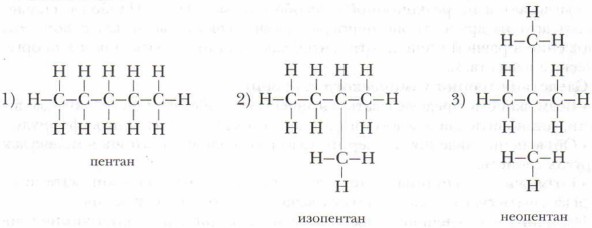
Исходя из этого примера можно сделать следующий вывод.
Структурные формулы отражают только последовательность соединения атомов в молекуле, но не показывают, как эти атомы расположены в пространстве.
Окончание параграфа >>>
Источник
