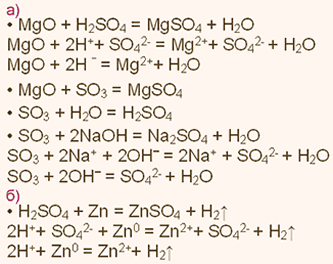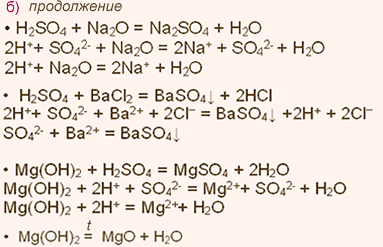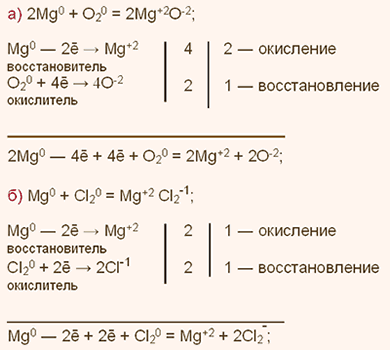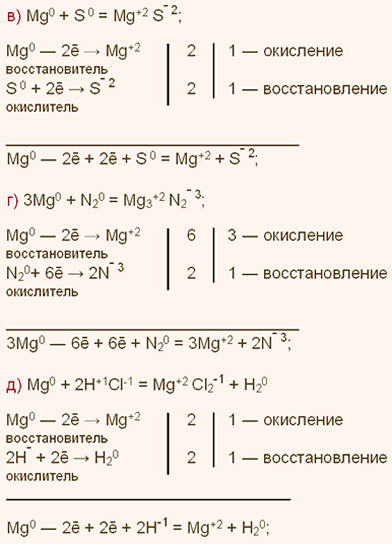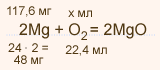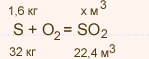У какого элемента наиболее выражены неметаллические свойства фосфор

Анонимный вопрос
19 декабря 2017 · < 100
Перечислите основные свойства металлов. Назовите чем эти свойства обусловлены?
Дипломированный специалист в прикладной математике и физике. Профессиональный химик -… · chemiday.com
Металлы хорошо проводят тепло и электричество – это обусловлено подвижностью электронов в кристаллической решётке металлов.
Металлы блестят (“металлический блеск”) – также обусловлено наличием подвижных, почти свободных электронов в решётке.
Большинство металлов химически активны и легко выступают в роли восстановителя – это обусловлено наличием слабо связанного 1 , 2 или 3-х электронов на внешнем электронном уровне.
Чему равно число электронов во внешнем слое для элементов главных подгрупп?
Книги, звери и еда – это хобби навсегда.
Число электронов во внешнем слое главных подгрупп периодической таблицы Менделеева равно номеру подгруппы, в которой находится элемент, за исключением водорода, имеющего 1 электрон и относящегося иногда одновременно к 1 и 7 группам, и гелия, имеющего 2 электрона и относящегося к 8 группе.
Какое место занимают неметаллы в периодической системе?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Неметаллы в периодической системе расположены в начале главных подгрупп, начиная с третьей группы и конце периодов, т. е. в правой верхней части периодической системы.
какой элемент имеет более выраженные металлические свойства c (z=6) или o (z=11); P (Z=15) или c1 (z=17); f (z=9) или c1? Почему?
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия. · tele.click/real_italy
Прикладной ответ:
1) Углерод (С; 6) vs Натрий (Na; 11). Тут конечно Натрий имеет более выраженные металлические свойства, так как находиться в левой части таблице.
2)Фосфор (P;15) и Хлор (Cl; 17). Атомы находятся в одном периоде, соответственно Фосфор более левей расположился и потому имеет незначительно больше металлических свойств.
3) Фтор (F; 9) и Хлор (Cl; 17). Тут победитель – хлор, поскольку он находиться ниже относительно фтора.
Теоретический ответ и обоснование:
1) При перемещении вдоль периода, слева на право, металлический свойства уменьшаются. Соответственно неметаллические возрастают.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2) При перемещении сверху вниз по группам
металлические свойства элементов усиливаются. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой “шубой” из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
3) Визуально, для быстрой оценки очень удобно представлять таблицу Менделеева в виде прямоугольника, где оранжевая часть отвечает за металлические элементы, а фиолетовая за неметаллические. А направление стрелок указывают на увеличение металлических свойств. Мне в свое время очень помогло разобраться и запомнить данные тенденции. И да, линия смены металлов и неметаллов условная и именно по этому данная табличка не содержит каких-то границ переходных атомов. Используйте с умом.
Как изменяются восстановительные свойства в таблице менделеева?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Что такое восстановительные свойства? ☘️
Это способность атома отдавать электроны????
????При движении по периоду слева направо восстановительные свойства уменьшаются???? Потому что электроотрицательность (способность отбирать электроны) возрастает, и атомы всё неохотнее отдают электроны????
????При движении по группе сверху вниз восстановительные свойства возрастают???? Потому что увеличиваются радиус атома и заряд ядра, а число электронов на внешнем уровне не меняется
Вот полезная табличка. Она показывает, как меняются свойства элементов в таблице Менделеева. С ней точно не запутаетесь????
Источник
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
| ||||||||||||||||||||||||||||||||||||||||
https://Reshebnikxim.narod.ru/ | ||||||||||||||||||||||||||||||||||||||||
Источник
Вариант 1
1. У какого элемента сильнее выражены неметаллические свойства: а) у кислорода или углерода; б) у фосфора или мышьяка? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у кислорода (неметалличность усиливается слева направо по периоду)
б) у фосфора (неметалличность усиливается снизу вверх по группе)
2. Дайте характеристику элемента №11 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Как и почему изменяются свойства химических элементов в периодах? Покажите это на примере элементов 3-го периода.
4. Рассчитайте относительную атомную массу бора, если известно, что доля изотопа 10B составляет 19,6%, а изотопа 11В – 80,4 %. (Ответ: 10,8.)
Вариант 2
1. У какого элемента сильнее выражены металлические свойства:
а) у лития или рубидия; б) у калия или скандия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у рубидия (металличность усиливается сверху вниз по группе)
б) у калия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №7 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула

3. Как изменяются свойства химических элементов в А-группах? Покажите это на примере элементов IIA-группы.
4. Сколько различных видов молекул оксида углерода (IV) можно получить из изотопа углерода 12C и трех изотопов кислорода: 16О, 17О, 18О? Напишите формулы всех оксидов и рассчитайте их молярные массы.
Вариант 3
1. У какого элемента сильнее выражены неметаллические свойства: а) у хлора или йода; б) у серы или кремния? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у хлора (неметалличность усиливается снизу вверх по группе)
б) у серы (неметалличность усиливается слева направо по периоду)
2. Дайте характеристику элемента №12 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Какие общие свойства проявляют элементы одних и тех же групп? Покажите это на примере элементов VIIA-группы.

4. Медь имеет два изотопа: 63Cu и 65Cu. Их доли в природной меди составляют 73 и 27? Соответственно. Рассчитайте среднюю относительную массу меди. (Ответ: 63,5.)
Вариант 4
1. У какого элемента сильнее выражены металлические свойства: а) у бериллия или стронция; б) у натрия или алюминия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у стронция (металличность усиливается сверху вниз по группе)
б) у натрия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №16 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Что общего и каковы различия в строении малых и больших периодов? Покажите это на примере 3-го и 4-го периодов.
Малые периоды состоят из одного ряда (3-й период), большие и двух рядов (4-й период). Свойства элементов меняются строго от металлов к неметаллам в любом периоде. 4-й период содержит на 10 элементов больше, чем 3-й. Эти элементы являются переходными металлами, у них заполняется d-подоболочка предыдущего энергетического уровня.
4. Оксид элемента имеет состав ЭО3. Массовая доля кислорода в этом оксиде составляет 60%. Какой элемент образуется оксид?
Источник
М.А.АХМЕТОВ
11 класс
Продолжение. Cм. в № 12, 16, 17/2008
4.1. Закономерности изменения свойств
химических элементов
А1. Свойства химического элемента и его
соединений находятся в периодической
зависимости от:
1) заряда атома;
2) числа протонов в ядре атома;
3) числа электронов во внешнем электронном
уровне атома;
4) числа нейтронов в его ядре.
А2. Атомы химических элементов, имеющие
одинаковое число электронных слоев, в таблице
Д.И.Менделеева находятся:
1) по диагонали; 2) в одной группе;
3) в одной подгруппе; 4) в одном периоде.
А3. Выберите верное утверждение о
химических элементах:
1) в периодах восстановительные свойства
увеличиваются слева направо;
2) в главных подгруппах восстановительные
свойства увеличиваются сверху вниз;
3) в периодах окислительные свойства
увеличиваются справа налево;
4) в главных подгруппах восстановительные
свойства увеличиваются снизу вверх.
А4. Наименее выражены неметаллические
свойства у:
1) селена; 2) брома;
3) йода; 4) теллура.
А5. Наименьшую энергию надо затратить на
отрыв одного электрона от атома:
1) серы; 2) кремния;
3) кальция; 4) бария.
А6. Число 35,453 в 17 клетке периодической
таблицы означает:
1) массу атома хлора (в атомных единицах массы);
2) среднюю массу природных изотопов хлора с
учетом их распространенности в земной коре;
3) массу молекулы хлора (в атомных единицах
массы);
4) среднюю массу всех известных изотопов хлора.
А7. Электроотрицательность и энергия
ионизации в ряду Te–Se–S–О соответственно:
1) возрастает, возрастает;
2) возрастает, уменьшается;
3) уменьшается, уменьшается;
4) уменьшается, возрастает.
А8. В каком ряду химические элементы
расположены в порядке увеличения их атомных
радиусов?
1) C —> N —> O —> F;
2) Sr —> Ca —> Mg —> Be;
3) Na —> Al —> P —> Cl;
4) Te —> Sb —> Sn —> In.
А9. В ряду химических элементов C —> Mg —> Se
число электронных слоев в их атомах:
1) возрастает от 3 до 5;
2) возрастает от 2 до 4;
3) уменьшается от 4 до 2;
4) уменьшается от 5 до 3.
А10. Не относится к p-элементам:
1) германий; 2) мышьяк;
3) селен; 4) цинк.
4.2. Закономерности изменения свойств
простых веществ
А11. Сильнейший окислитель – это:
1) углерод; 2) азот;
3) кислород; 4) фтор.
А12. Из приведенных щелочных металлов
наименьшей температурой плавления обладает:
1) литий; 2) натрий;
3) калий; 4) рубидий.
А13. Наибольшей температурой кипения
обладает:
1) фтор; 2) хлор;
3) бром; 4) кислород.
А14. Вещество, имеющее наиболее выраженные
металлические свойства, – это:
1) сера; 2) селен;
3) кремний; 4) скандий.
А15. Наиболее выраженными неметаллическими
свойствами обладает:
1) теллур; 2) галлий;
3) железо; 4) кальций.
А16. В ряду водородных соединений неметаллов
PH3 – H2S – HCl:
1) кислотно-основные свойства не изменяются;
2) свойства изменяются от основных, через
амфотерные, к кислотным;
3) свойства изменяются от кислотных, через
амфотерные, к основным;
4) кислотные свойства усиливаются, а основные
убывают.
А17. Бериллий и магний не относятся к
щелочно-земельным металлам, т.к.:
1) их гидроксиды не растворимы в воде;
2) они не являются р-элементами;
3) они относятся к металлам;
4) они относятся к неметаллам.
А18. Наименьшей химической активностью в
ряду галогенов обладает:
1) F2; 2) Cl2; 3) Br2; 4) I2.
А19. Наименьшей химической активностью по
отношению к кислороду обладает простое вещество:
1) азот; 2) белый фосфор;
3) железо; 4) натрий.
А20. Наибольшее межъядерное расстояние в
молекуле:
1) фтора; 2) хлора;
3) брома; 4) йода.
4.3. Закономерности изменения свойств
сложных веществ
А21. Наименьшими восстановительными
свойствами обладает кислота:
1) фтороводородная; 2) хлороводородная;
3) бромоводородная; 4) йодоводородная.
А22. Оксиды, которые проявляют только
кислотные свойства, – это:
1) Na2O, MgO, Cu2O;
2) Аl2О3, SiO2, CuO;
3) P2O5, SO3, С12O7;
4) MgO, CO2, ZnO.
А23. Электроотрицательность кальция меньше
электроотрицательности магния, потому что:
1) относительная атомная масса магния меньше
относительной атомной массы кальция;
2) оба элемента принадлежат ко II группе;
3) число электронов в атоме кальция равно
числу электронов в атоме магния;
4) радиус атома кальция больше радиуса атома
магния при условии, что элементы находятся в
одной группе, главной подгруппе.
А24. Среди гидроксидов II группы выберите
вещество, проявляющее амфотерные свойства:
1) Zn(OH)2; 2) Mg(OH)2;
3) Ca(OH)2; 4) Sr(OH)2.
А25. Выберите наименее сильную кислоту:
1) Н3PO4; 2) HNO3;
3) H3AsO4; 4) H3SbO4.
А26. В ряду галогеноводородов наиболее
сильной кислотой является:
1) HF; 2) HCl; 3) HBr; 4) HI.
А27. В ряду СH4–NH3–H2O–HF
происходит:
1) увеличение прочности химической связи;
2) усиление восстановительных свойств;
3) ослабление кислотных свойств;
4) уменьшение полярности связи.
А28. Высший оксид элемента с порядковым
номером 17 в периодической системе является:
1) основным; 2) кислотным;
3) амфотерным; 4) несолеобразующим.
А29. Высший гидроксид хрома имеет формулу:
1) Cr(OH)2; 2) Cr(OH)3;
3) H2Cr2O7; 4) Cr(OH)4.
А30. Среди летучих водородных соединений
элементов 3-го периода наименьшие кислотные
свойства проявляет:
1) SiH4; 2) PH3; 3) H2S; 4) HCl.
В1. Установите соответствие между
формулой оксида и его характеристикой.
| Ф о р м у л а о к с и д а а) N2O5; б) Na2O; в) Al2O3; г) CO./// | Х а р а к т е р и с т и к а о к с и д а 1) Несолеобразующий; 2) кислотный; 3) амфотерный; 4) основный. |
В2. Установите соответствие между знаками
химических элементов и странами или
континентами, в честь которых они были названы.
| З н а к х и м и ч е с к о г о э л е м е н т а а) Ru; б) Po; в) Fr; г) Ge./// | С т р а н а и л и к о н т и н е н т 1) Россия; 2) Германия; 3) Польша; 4) Румыния; 5) Франция./// |
В3. Установите соответствие между
характеристикой простого вещества или
химического элемента и его символом.
| Х а р а к т е р и с т и к а а) Самый б) самый распространенный элемент на Земле; в) единственный жидкий неметалл; г) единственный жидкий металл./// | С и м в о л э л е м е н т а 1) Si; 2) H; 3) Hg; 4) Br2; 5) O./// |
В4. Установите соответствие между знаком
химического элемента и фамилией ученого.
| З н а к х и м и ч е с к о г о э л е м е н т а а) Rf; б) No; в) Md; г) Es./// | У ч е н ы й 1) Резерфорд; 2) Курчатов; 3) Нобель; 4) Менделеев; 5) Эйнштейн./// |
В5. Установите соответствие между
химическим элементом или простым веществом и его
применением.
| Х и м и ч е с к и й э л е м е н т, п р о с т о е в е щ е с т в о а) Pb; б) Hg; в) U; г) I2./// | П р и м е н е н и е 1) 2) автомобильные аккумуляторы; 3) лазерные диски; 4) ядерная энергетика; 5) измерение температуры./// |
B6. Химические элементы, оксиды которых
проявляют основные свойства, – это:
1) Zn; 2) Cu; 3) Mg; 4) Al; 5) Be; 6) Ba.
В7. Простые вещества, являющиеся твердыми
при обычных условиях, – это:
1) йод; 2) азот; 3) озон;
4) графит; 5) хлор; 6) сера.
В8. Элементы, содержащие два неспаренных
электрона во внешнем электронном слое, – это:
1) С; 2) N; 3) S; 4) Mg; 5) Li; 6) Ti.
B9. Элемент образует два оксида. В одном из
них массовая доля элемента составляет 50%, а в
другом – 40%. Что это за элемент?
В10. Хлор состоит из двух изотопов 35Cl и 37Cl.
Сколько атомов 35Cl приходится на 1 атом 37Cl?
(Ответ округлите до целых.)
Ответы на тестовые задания главы
4
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| 2 | 4 | 2 | 4 | 4 | 2 | 1 | 4 | 2 | 4 |
| А11 | А12 | А13 | А14 | А15 | А16 | А17 | А18 | А19 | А20 |
| 4 | 4 | 3 | 4 | 1 | 4 | 1 | 4 | 1 | 4 |
| А21 | А22 | А23 | А24 | А25 | А26 | А27 | А28 | А29 | А30 |
| 1 | 3 | 4 | 1 | 4 | 4 | 1 | 2 | 3 | 1 |
| В1 | В2 | В3 | В4 | В5 | В6 | В7 | В8 | В9 | В10 |
| 2431 | 1352 | 2543 | 1345 | 2541 | 236 | 146 | 134 | сера | 3 |
Продолжение следует
Источник