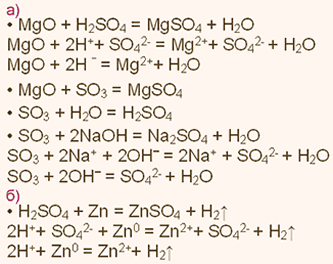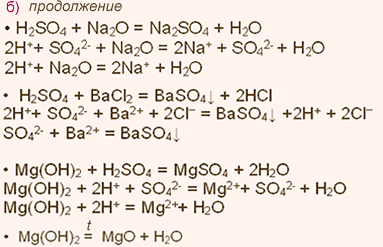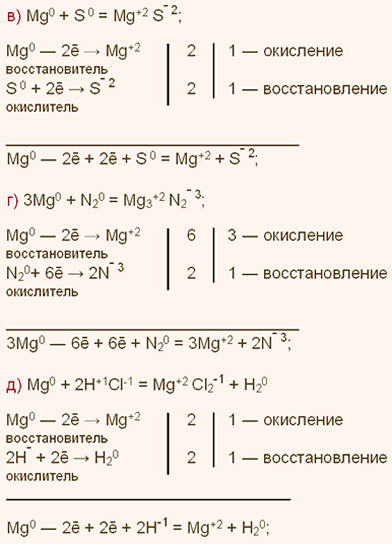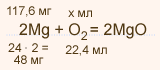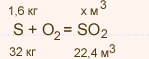У какого элемента неметаллические свойства кремния и серы или у фосфора и мышьяка
Напомню, что в одной из предыдущих частей мы ввели такие понятия как металлические и неметаллические свойства, теперь же пришло время научится отличать металлы от неметаллов по таблице Менделеева.
Многие из Вас, столкнувшись с данным вопросом, могут справедливо заметить, дескать: “Ха, вот глупости. Автор не от мира сего, ведь металлы и неметаллы в таблице Менделеева отмечены разным цветом! Как сейчас помню таблицу Менделеева в учебнике, где неметаллы отмечены красным цветом, а металлы – чёрным и зелёным. Шах и мат.”
Не спешите с критикой
Это всё замечательно, отвечу я, да только учащиеся, что приходят на экзамен по химии, получают чёрно-белый вариант таблицы Менделеева и Ваше возможное замечание окажется неуместно.
Тот самый черно-белый вариант
И прежде чем мы всё-таки ответим на поставленный вопрос, нам необходимо освоить несколько базовых химических понятий, касающихся работы с таблицей Менделеева. Дело в том, что помимо довольно однозначно определяемых периодов и групп, в таблице Менделеева есть место так же и для, так называемым, подгрупп.
С сегодняшнего дня мы начнём различать главную подгруппу (или подгруппу А) и побочную подгруппу (или подгруппу В).
Как же определить к какой подгруппе относится тот или иной химический элемент?
На отношение к той или иной подгруппе химического элемента нам могут указать следующие знаки:
Во-первых, нередко в шапочке, где указан номер группы, к которому относится столбец, есть указание и на подгруппы:
Главная подгруппа – А, побочная – В
Во-вторых, само положение химического символа химического элемента в ячейке указывает на отношение к подгруппе. Так, если химический символ химического элемента смещён относительно центра ячейки влево, то мы имеем дело с элементом главной подгруппы (подгруппы А), если же вправо – то побочной подгруппы (подгруппы В)
Например, в совершенно случайной чёрно-белой таблице Менделеева мы видим, что фосфор относительно центра ячейки смещён влево, это значит, что фосфор – элемент главной подгруппы (подгруппы А) пятой группы.
“адрес” фосфора: P – II (период), VА (группа – подгруппа), 15 (порядковый номер).
Как понятие о подгруппах поможет нам отличать металлы от неметаллов?
А вот как: дело в том, что все элементы побочных подгрупп – это металлы!
Красным выделены все элементы побочных подгрупп первых шести периодов. Все они – металлы.
А через элементы главных подгрупп мы можем провести одну особенную диагональ, которая “отсечёт” металлы от неметаллов.
Данная диагональ проходит через такие неметаллы, как бор (B) – кремний (Si) – мышьяк (As) – теллур (Te) – астат (As).
Зелёным цветом выделены все неметаллы в таблице Менделеева
Таким образом все элементы главных подгрупп, что лежат ниже и левее данной диагонали являются металлами, а все, что лежат выше и правее – неметаллами.
Однако нельзя не заметить, что деление на металлы (Ме) и неметаллы (неМе) всё же несколько условно, а некоторые таблицы, Менделеева, которые Вы можете найти в сети, игнорируют указанные мной правила работы с подгруппами.
В следующей части мы выделим закономерности, согласно которым металлические и неметаллические свойства изменяются в пределах рассматриваемой Периодической системы Менделеева и разберёмся, какое отношение к этому имеет атомный радиус. А на этом у меня всё. Спасибо. Пока.
Источник
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Вариант 1
1. У какого элемента сильнее выражены неметаллические свойства: а) у кислорода или углерода; б) у фосфора или мышьяка? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у кислорода (неметалличность усиливается слева направо по периоду)
б) у фосфора (неметалличность усиливается снизу вверх по группе)
2. Дайте характеристику элемента №11 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Как и почему изменяются свойства химических элементов в периодах? Покажите это на примере элементов 3-го периода.
4. Рассчитайте относительную атомную массу бора, если известно, что доля изотопа 10B составляет 19,6%, а изотопа 11В – 80,4 %. (Ответ: 10,8.)
Вариант 2
1. У какого элемента сильнее выражены металлические свойства:
а) у лития или рубидия; б) у калия или скандия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у рубидия (металличность усиливается сверху вниз по группе)
б) у калия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №7 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула

3. Как изменяются свойства химических элементов в А-группах? Покажите это на примере элементов IIA-группы.
4. Сколько различных видов молекул оксида углерода (IV) можно получить из изотопа углерода 12C и трех изотопов кислорода: 16О, 17О, 18О? Напишите формулы всех оксидов и рассчитайте их молярные массы.
Вариант 3
1. У какого элемента сильнее выражены неметаллические свойства: а) у хлора или йода; б) у серы или кремния? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у хлора (неметалличность усиливается снизу вверх по группе)
б) у серы (неметалличность усиливается слева направо по периоду)
2. Дайте характеристику элемента №12 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Какие общие свойства проявляют элементы одних и тех же групп? Покажите это на примере элементов VIIA-группы.

4. Медь имеет два изотопа: 63Cu и 65Cu. Их доли в природной меди составляют 73 и 27? Соответственно. Рассчитайте среднюю относительную массу меди. (Ответ: 63,5.)
Вариант 4
1. У какого элемента сильнее выражены металлические свойства: а) у бериллия или стронция; б) у натрия или алюминия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у стронция (металличность усиливается сверху вниз по группе)
б) у натрия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №16 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Что общего и каковы различия в строении малых и больших периодов? Покажите это на примере 3-го и 4-го периодов.
Малые периоды состоят из одного ряда (3-й период), большие и двух рядов (4-й период). Свойства элементов меняются строго от металлов к неметаллам в любом периоде. 4-й период содержит на 10 элементов больше, чем 3-й. Эти элементы являются переходными металлами, у них заполняется d-подоболочка предыдущего энергетического уровня.
4. Оксид элемента имеет состав ЭО3. Массовая доля кислорода в этом оксиде составляет 60%. Какой элемент образуется оксид?
Источник
| ||||||||||||||||||||||||||||||||||||||||
https://Reshebnikxim.narod.ru/ | ||||||||||||||||||||||||||||||||||||||||
Источник