У какого элемента сильнее выражены свойства металла у мышьяка или сурьмы
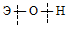
Кроме азота и фосфора в 15-ю группу входят мышьяк, сурьма и висмут (образуя подгруппу мышьяка).
Историческая справка
Мышьяк и сурьма относятся к числу элементов, точная дата открытия которых не установлена. В 1789 г. А. Лавуазье мышьяк и сурьму как самостоятельные элементы включил в список простых веществ.
Первые сведения о металлическом висмуте, его добыче и переработке встречаются в трудах средневекового химика Агриколы (1529). Символ элемента Bi впервые введен в химическую номенклатуру в 1819 г. И. Я. Берцелиусом.
С увеличением радиуса атомов изменяются окислительно-восстановительные свойства: окислительные свойства убывают, восстановительные усиливаются.
Висмут — металл, а мышьяк и сурьма занимают промежуточное положение. Для всех трех элементов характерны степени окисления -3, 0, +3 и +5. Степень окисления +5 наиболее характерна для Sb, менее для As и неустойчива для Bi. Сравнительная окислительно-восстановительная активность мышьяка, сурьмы и висмута в различных состояниях окисления (+3 и +5) может быть выражена следующей схемой:
Важнейшие соединения мышьяка, сурьмы и висмута сходны между собой по строению, ионно-электронной и окислительно-восстановительной характеристикам. Это относится и к водородным, и к кислородным соединениям, и к галогенидам. Кислородсодержащие соединения обычно проявляют кислотный характер.
Мышьяк, сурьма и висмут в природе встречаются преимущественно в соединениях с серой. Среди них наибольшее значение имеют реальгар As4S4, аурипигмент As2S3, лёллингит FeAs2, сурьмяный блеск (антимонит) Sb2S3, висмутовый блеск Bi2S3, мышьяковый цвет As203, сурьмяная охра Sb203, висмутовая охра Bi203.
Получение мышьяка, сурьмы и висмута сводится к их восстановлению из соответствующих оксидов. Обычно в качестве восстановителя используется уголь:
Свойства элементов подгруппы мышьяка. В виде простых веществ мышьяк, сурьма и висмут похожи на металлы, проводят электрический ток и теплоту, но в отличие от настоящих металлов лишены таких свойств, как упругость, пластичность, ковкость и т.п. Эти вещества очень хрупки и легко измельчаются при растирании.
Мышьяк образует два аллотропных видоизменения: металлический мышьяк, устойчивый в твердом состоянии при обычных условиях и при нагревании; желтый мышьяк, отличающийся своей неустойчивостью. Металлический мышьяк при нагревании возгоняется.
Сурьма существует в виде кристаллической и желтой аллотропной модификации. Кристаллическая сурьма образует гексагональные кристаллы (изоморфные кристаллам мышьяка), по внешнему виду напоминает металл, но очень хрупкий. Желтая модификация сурьмы аналогична желтому мышьяку, но еще более неустойчива.
Висмут — относительно мало распространенный элемент. Представляет собой блестящий металл белого цвета с красноватым оттенком. Хрупок, легко измельчается. Проводит электрический ток, но хуже, чем истинные металлы.
С водородом мышьяк, сурьма и висмут образуют соединения общей формулы RH3 (AsH3 — арсин, SbH3 — стибин и BiH3 — висмутин). Арсин и стибин получают при действии кислот на соответствующий оксид в присутствии цинка:
BiH3 получают при растворении сплава Bi с Mg в соляной кислоте:
Аналогично можно получить также AsH3 и SbH3.
В гидридах степень окисления элементов равна -3. Все три гидрида очень нестойки, причем их неустойчивость усиливается от H3As к H3Bi. Арсин разлагается при 300—400°С, SbH3 разлагается при более низкой температуре, a BiH3 разлагается уже при комнатной температуре:
На способности гидридов разлагаться при нагревании основана специфическая качественная реакция Марша, позволяющая устанавливать присутствие этих трех элементов в исследуемом веществе. Метод Марша широко используется в судебно-химических исследованиях при обнаружении мышьяка. В основе этого метода лежит реакция восстановления мышьяка из его соединений до AsH3, который при пропускании через накаленную, наполненную водородом стеклянную трубку разлагается с образованием черно-бурого осадка элементарного мышьяка — мышьякового зеркала:
Водородные соединения элементов подгруппы мышьяка обладают сильными восстановительными свойствами. Так, если подействовать арсином на AgNOs, то образуется металлическое серебро (реакция Гутцайга):
Под действием окислителей мышьяк и сурьма могут окисляться до
+3
Висмут обычно окисляется до Bi, но при действии очень силь-
+5 +5
ных окислителей на соединения Bi можно получить соединения Bi:
По отношению к кислотам мышьяк, сурьма и висмут ведут себя по-разному. С соляной кислотой мышьяк в присутствии кислорода образует AsCl3:
На сурьму разбавленные кислоты не действуют. Концентрированная НС1 растворяет сурьму:
Висмут с разбавленными серной
и соляной кислотами не реагирует. При взаимодействии с концентрированной серной кислотой мышьяк, сурьма и висмут окисляются, образуя соединения со степенью окисления +3:
Концентрированная азотная кислота и хлорноватистая кислота окисляют сурьму и мышьяк до степени окисления +5:
Висмут в концентрированной кислоте пассивируется, а в разбавленной, растворяясь, дает нитрат:
В ряду стандартных электродных потенциалов Sb и Bi располагаются между водородом и медыо, поэтому при взаимодействии с кислотами водород этими элементами не вытесняется.
При взаимодействии с элементами 1-й и 2-й групп образуются солеподобные соединения: арсениды, стибиды (антимониды) и висмутиды, в которых As, Sb и Bi проявляют степень окисления -3. Например:
Действием разбавленных кислот на эти соединения получают соответствующие гидриды по схеме
Степени окисления +3 и +5 мышьяк и его аналоги проявляют кроме кислородных соединений и в галогенидах. Молекулы имеют форму треугольных пирамид с атомом Э в вершине и валентным углом Hal—Э—Hal около 100°. В этих соединениях As, Sb и Bi сохраняют несвязывающую /^-электронную пару. Тригалогениды мышьяка AsHal3 схожи с тригалогенидами фосфора. SbCl3 отличается от них тем, что он растворяется в небольшом объеме воды с образованием прозрачного раствора, который при разбавлении дает нерастворимые оксохлориды SbOCl и Sb^O^Cl^ Простых ионов Sb3+ в растворах не существует. Трихлорид висмута BiCl3 гидролизуется до BiOCl, но эта реакция обратима:
Для галогенидов ЭНа13 характерна склонность к реакциям присоединения с образованием комплексных соединений:
В ряду AsHal3 — SbHal3 — BiHal3 кислотные свойства ослабевают и усиливаются основные. Для всех элементов описаны пентафторнды 3F5, а для сурьмы — еще и хлорид SbCl5. Пентафториды As и Sb — сильные акцепторы фторид-иона, образующие ионы MFg. Тенденция к комплексообразова- нию по схеме
особенно сильно выражена у сурьмы, в меньшей степени — у мышьяка и еще слабее — у висмута. Фториды 3F5 всех трех элементов являются сильными окислителями, причем эта способность увеличивается в ряду AsF5 — SbF5 — BiF5.
Мышьяк, сурьма и висмут образуют оксиды типа Э203 и Э203. Устойчивость состояния с высшей степенью окисления уменьшается с увеличением заряда ядра в ряду As — Sb — Bi, при этом основные свойства оксидов возрастают в ряду As — Sb — Bi. Так, у As203 преобладают кислотные свойства, у Sb203 — основные свойства, a Bi203 обладает отчетливо выраженными основными свойствами.
Оксиды типа Э203 легко образуются при непосредственном взаимодействии элементов с кислородом по схеме
As203 — белый мышьяк. Проявляет преимущественно кислотные свойства. Он взаимодействует с Н20, щелочами и галогеноводородными кислотами:
Sbv03 в воде практически нерастворим, но взаимодействует с НС1 и щелочами.
Взаимодействие As203 и Sb203 со щелочами приводит к образованию тетрагидроксоарсенатов(Ш) К[As(OH) 4] и тетрагидроксоантимонатов(П1) K[Sb(OH)J.
Bi203 в воде не растворяется, со щелочами практически не реагирует, но легко взаимодействует с кислотами, образуя соли:
Оксидам R203 соответствуют гидроксиды типа Э(ОН)3, химические свойства которых изменяются в той же последовательности, что и оксидов.
As(OH)3 амфотерен, с преобладанием кислотных свойств. В свободном состоянии не выделен, в водном растворе ведет себя как слабая кислота H3As03, называемая мышьяковистой кислотой. Соли этой кислоты — арсе- ниты.
Sb(OH)3 также амфотерен, но с преобладанием основных свойств. Кислотно-основная ионизация у этих гидроксидов выражена слабо.
У Bi(OH)3 явно преобладают основные свойства. Следовательно, кислотные свойства в ряду As(OH)3, Sb(OH)3 и Bi(OH)3 ослабевают, а основные усиливаются.
As(OH)3 может быть получен взаимодействием As203 с водой. Поскольку у As(OH)3 преобладают кислотные свойства, то в водном растворе он ведет себя как кислота H3As03:
Равновесие в первой из этих реакций сильно смещено вправо.
Гидроксиды Sb(OH)3 и Bi(OH)3 в воде практически не растворяются. Их обычно получают действием растворов щелочей на соответствующие соли:
Соли мышьяковистой кислоты называются арсенитами и получаются при действии щелочей на As203:
Соли Sb(III) и Bi(III) легко гидролизуются с образованием основных солей, которые в дальнейшем разлагаются до малорастворимых в воде оксо- солей:
Соединения As(III) являются восстановителями; при их окислении получаются соединения As(V). Так, в слабощелочной среде арсениты могут быть окислены свободным иодом до арсенатов:
Производные Sb(III) обладают меньшей восстановительной способностью, а окисление соединений Bi(III) возможно лишь энергичными окислителями в сильнощелочной среде:
Оксид мышьяка(У) As205 непосредственным окислением мышьяка не образуется. Его получают дегидратацией мышьяковой кислоты H3As04:
Sb205 в чистом виде выделить трудно, поскольку в процессе его получения происходят частичная потеря кислорода и образование Sb204.
As.,03 и Sb,05 в обычных условиях — твердые вещества. По своей структуре и свойствам As.;()- напоминает Р205. Так, легко растворяясь в воде, As205 образует мышьяковую кислоту H3As04:
Sb2Os в воде растворим мало, но легко растворяется в щелочах с образованием гексагидроксостибатов(У) типа Me[Sb(OH)6]:
При сплавлении As205 и Sb205 со щелочами образуются арсенаты(У)
+ 1 ‘ +3 ‘ +2
и стибаты(У) типа МсЭ03; МеЭ04 и Ме2Э2От7, которые в своем большинстве полимерны.
Кристаллизацией из водных растворов обычно получают арсенаты типа
+i
Me3As04.
Оксиду As203 соответствует оксоарсенат водорода или мышьяковая кислота tljAsO,, которая слабее фосфорной. Как трехосновная кислота H3As04 образует три типа солей — арсенаты Na3As04, дигидроарсенаты NaH2As04 и гидроарсенаты Na2HAs04.
Оксиду Sb205 соответствует сурьмяная кислота H3Sb04, однако она существует в водных растворах в нескольких формах. Попытка выделить сурьмяные кислоты приводит к образованию осадков неопределенного состава Sb,05wH20.
Соли сурьмяной кислоты (антимонаты) соответствуют обычно гексаги- дроксосурьмяной кислоте, формула которой H[Sb(OH)G], отвечает гидратированной метаформе HSb03 -3H20.
В свободном состоянии не получены и висмутовые кислоты.
Подобно фосфатам, большинство арсенатов и антимонатов труднорастворимы в воде.
Соединения Bi(V) могут быть получены при действии сильных окислителей на Bi(OH)3 в концентрированном растворе NaOH. Состав образующихся
+ 1
полимерных висмутатов отвечает формуле МеВЮ3. Висмутаты рассматривают как соли невыделенной в свободном состоянии висмутовой кислоты.
+5 +5 +5
Окислительная способность в ряду As — Sb — Bi усиливается, поэтому если мышьяковая п сурьмяная кислоты и их соли такие свойства проявляют лишь в кислой среде, то производные Bi окислительные свойства проявляют как в кислой, так и в щелочной среде:
Для элементов подгруппы мышьяка характерны сернистые соединения, обычно нерастворимые в воде и разбавленных кислотах.
As2S3и As2S5 нерастворимы в концентрированной HCI, но концентрированная HN03 растворяет их:
Сульфиды этих элементов проявляют определенную аналогию свойств оксидов Э203 и Э205. Так, при взаимодействии сульфидов со щелочами образуются соли тиокислот, г.е. кислот, в которых кислород (О2 ) заменен на серу (S2 ) (например, вместо (NH4)3AsO,j можно получить (NH4)3AsS4):
Аналогично протекают процессы для сульфидов сурьмы.
В противоположность им Bi2S3 с растворимыми сульфидами почти не реагирует. Тиоарсениты и тиоантимоииты в твердом состоянии устойчивы, но соответствующие им тиокислоты обычно распадаются. Тиосоли, содержащие As(V) и Sb(V), называются соответственно тиоарсенатами и тиоан- тимонатами. В отличие от своих солей тиокислоты неустойчивы и разлагаются на сульфиды и сероводород:
Некоторые тиоарсениты и тиоарсенаты применяются для борьбы с вредителями сельского хозяйства.
Качественные реакции на арсенит-ион As03 , арсенат-ион As04~, ион сурьмы(Ш), ион висмута(Ш) следующие:
Мышьяк и все его соединения очень ядовиты! Несмотря на это, некоторые соединения находят применение в медицине.
Арсенит калия (калия арсенит) KAsO., получают по уравнению реакции
Его применяют как тонизирующее средство при малокровии и истощении нервной системы.
Гидроарсенат натрия (натрия арсенат кристаллический) Na2HAs04 получают окислением As20;! азотной кислотой, затем образовавшийся As205 обрабатывают карбонатом натрия:
Применяют Na2HAs04 в виде 0,5—1%-ного раствора при малокровии и неврозах. As.,03 используют для лечения кожных заболеваний, малокровии, неврастении. В стоматологии применяют для некротизации пульпы.
Нитрат висмута (основной нитрат висмута) обычно является смесью нескольких основных солей:
Его используют в качестве антисептика при желудочно-кишечных заболеваниях. Висмут входит в состав многих органических соединений, широко применяемых в медицине: ксероформа, дерматола и др.
Источник
Задание 47.
Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов?
Решение:
+23V 1s22s22p63s23p63d34s2; +33Аs 1s22s22p63s23p63d104s24p3.
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Мышьяк с водородом образует газообразный гидрид AsH3 – арсин, где мышьяк проявляет отрицательную степень окисления -3, так как атом мышьяка способен присоединять три электрона до полного заполнения внешнего энергетического уровня:
Задание 48.
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Решение:
Марганец в своих соединениях проявляет степень окисления +2, +3, +4, +6, +7.
Формулы оксидов, отвечающих этим степеням окисления:
MnO – оксид марганца (II);
Mn2O3 – оксид марганца(III);
MnO2 – оксид марганца(IV);
MnO3 – ; оксид марганца(VI);
Mn2O7 – оксид марганца(VII).
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Mn(OH)4 + 4HCl = MnCl4 + 4H2O;
Mn(OH)4 + 4NaOH = Na4MnO4 + 4H2O
Задание 49.
У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
Решение:
Электронные формулы хрома и селена:
+24Cr 1s22s22p63s23p63d54s1; +34Se 1s22s22p63s23p63d104s24p4.
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Задание 50.
Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
Решение:
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2p6). Элементы хлор, сера, азот и углерод находятся соответственно в VIIА-, VIА-, VА-, IVА- группах и имеют структуру внешнего энергетического уровня s2p5, s2p4, s2p3, s2p2. Следовательно, низшая степень окисления хлора, серы, азота и углерода равны соответственно -1, -2, -3 и -4.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
Задание 51.
У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
Решение:
Фосфор и сурьма находятся в VА- группе и имеют следующие электронные формулы:
+15Р 1s22s22p63s23p3; +51Sb 1s22s22p63s23p63d104s24p64d105s25p3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Водородное соединение сурьмы (SbH3 – стибин) обладает более сильными восстанови-тельными свойствами, чем водородное соединение фосфора (РН3 – фосфин). Это объясняется тем, что в группах с ростом порядкового номера элемента закономерно возрастают радиусы атомов элементов и, соответственно ионные радиусы. Ион Sb3- имеет больший диаметр, чем ион Р3-, поэтому иону сурьмы значительно легче отдать электроны (из-за большего радиуса иона требуется меньше энергии на отрыв электрона).
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
Прочность связей определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Если прочность связей Э — О и О — Н близки или равны , то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
где Э – элемент (металл или неметалл); n+ – положительная степень окисления элемента.
а) Ва(ОН)2 будет более сильным основанием, чем Mg(OH)2, так как эти элементы стоят во IIА- группе главной подгруппе, а в группе у элементов с увеличением порядкового номера увеличиваются размеры атомов (ионов), что уменьшает прочность связей Ва2+ с ОН-, чем у Mg2+ с ОН-.
б) Ca и Fe – элементы большого ряда четвёртого периода периодической системы химических элементов, поэтому с ростом порядкового номера элемента будет наблюдаться рост эффективного заряда, что приводит к уменьшению размеров атома (радиус атома железа будет намного меньше, чем радиус атома кальция). Из-за чего связь между Са2+ и ОН- будет значительно меньше, чем между Fe2+ с ОН-, значит, Са(ОН)2 будет проявлять сильнее основные свойства, чем Fe(ОН)2.
в) Стронций – типичный р-элемент IIА- группы, а кадмий – d-элемент IIВ- группы и у их атомов на внешнем энергетическом уровне содержатся по два электрона, поэтому они в своих соединения будут проявлять степень окисления +2. У кадмия порядковый номер (48) значительно больше, чем у стронция (38), поэтому радиус иона кадмия (Cd2+) имеет большее численное значение, чем у иона стронция (Sr2+), значит, связь между ионами Cd2+ и ОН- будет прочнее, чем связь между Sr2+ и ОН-, Sr(OH)2 будет проявлять меньше основных свойств чем Cd(ОН)2.
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н < < ЕЭ—О (высокая степень окисления), а по основному типу (I), если ЕО—Н >> ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
где Э – элемент (металл или неметалл); n+ – положительная степень окисления элемента. Таким образом, исходя из степени окисления атомов соответствующих элементов, можно уверенно считать, что, если элемент образует два гидроксида, то более сильным основанием будет тот гидроксид, в котором степень окисления элемента имеет меньшее численное значение.
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.
Источник
