У какого оксида наиболее выражены основные свойства

Основные оксиды, перечень, список, физические и химические свойства.
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
Основные оксиды Видеоурок “Основные оксиды”
Какие оксиды основные? Список и перечень основных оксидов
Физические свойства основных оксидов
Получение основных оксидов
Химические свойства основных оксидов
Химические реакции основных оксидов
Основные оксиды:
Основные оксиды – солеобразующие оксиды металлов, которым соответствуют основания. Как правило, металлы в них проявляют степень окисления +1 или +2.
В свою очередь оксидами называют неорганические химические соединения, состоящие из двух химических элементов, одним из которых является кислород. Кислород в оксидах проявляет степень окисления -2. Все оксиды делятся на солеобразующие и несолеобразующие.
К солеобразующим оксидам помимо основных оксидов также относят кислотные и амфмотерные оксиды. Соответственно кислотным оксидам соответствуют кислоты, амфотерным оксидам – амфотерные основания.
К основным оксидам относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
@ https://youtu.be/Lnq-gD6c83A
Какие оксиды основные? Список, примеры и перечень основных оксидов:
Физические свойства основных оксидов:
Общим физическим свойством для всех основных оксидов является то, что они представляют собой твердые вещества. В то время как другие: внешний вид, цвет, плотность, температуры плавления и кипения, молярная масса, твердость и пр. различаются.
| Название оксида: | Химическая формула: | Внешний вид: |
| Оксид бария | BaO | бесцветные кристаллы |
| Оксид калия | K2O | твердое бесцветное или бледно-желтое вещество |
| Оксид кальция | CaO | белое кристаллическое вещество |
| Оксид лития | Li2 O | бесцветные кристаллы |
| Оксид магния | MgO | твердое белое вещество |
| Оксид меди II | CuO | твердое черное вещество |
| Оксид натрия | Na2O | бесцветные кристаллы |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
Получение основных оксидов:
Основные оксиды получаются в результате:
- 1. окисления металлов кислородом (кроме благородных):
2Ba + О2 → 2BaО;
2К + О2 → К2О2, К2О2 + 2К → 2К2О;
2Сa + О2 → 2CaО (t = 300 oC);
4Li + О2 → 2Li2О;
2Cu + O2 → CaО;
6Na + 2О2 → Na2О2 + 2Na2О, Na2О2 + 2Na → 2Na2О.
- 2. термического разложения гидроксидов:
Ba(OH)2 → BaO + H2О (t = 780-800 oC);
Сa(OH)2 → СaO + H2О (t = 520-580 oC);
Cu(OH)2 → CuО + H2O (to);
- 3. термического разложения солей:
BaCO3 → BaO + CO2 (t = 1000-1450 oC);
Сa2СО3 → CaО + СО2 (t = 900-1200 oC);
MgCO3 → MgО + СО2 (t > 650 oC);
CuCO3 → CuО + CO2 (to);
2Na2СO3 → Na2O + СО2 (t = 851 oC).
Химические свойства основных оксидов. Химические реакции основных оксидов:
Для основных оксидов характерны следующие общие химические реакции:
1. взаимодействие с водой.
В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп периодической таблицы химических элементов Д.И. Менделеева (натрий, калий, кальций, барий и др.).
В результате взаимодействия основных оксидов с водой образуются основания.
BaO + H2O → Ba(OH)2;
К2О + Н2О → 2КОН;
CaО + Н2О → Ca(ОН)2;
Li2О + Н2О → 2LiОН;
MgО + Н2О → Mg(ОН)2 (t = 100-125 oC);
Na2О + Н2О → 2NaОН.
2. взаимодействие с кислотными оксидами.
В результате химической реакции основных оксидов с кислотными оксидам образуется соль.
BaO + CO2 → BaCO3;
BaO + SO3 → BaSO4;
К2О + СО2 → К2СО3;
К2О + SО2 → К2SО3;
К2О + SО3 → К2SО4;
К2О + SiО2 → К2SiО3;
CaО + СО2 → CaСО3;
CaО + SО2 → CaSО3;
CaО + SО3 → CaSО4;
CaО + SiО2 → CaSiО3 (t = 1100-1200 oC);
Li2О + СО2 → Li2СО3;
Li2О + SО2 → Li2SО3;
Li2О + SiО2 → Li2SiО3 (t = 1200-1300 oC);
MgО + СО2 → MgСО3;
MgО + SО2 → MgSО3;
MgО + SО3 → MgSО4;
MgО + SiО2 → MgSiО3 (t = 1100-1200 oC);
Na2О + СО2 → Na2СО3 (t = 450-550°C);
Na2О + SО2 → Na2SО3;
Na2О + SО3 → Na2SО4;
Na2О + SiО2 → Na2SiО3 (tо).
3. взаимодействие с кислотами.
В результате химической реакции основных оксидов с кислотами образуется соль и вода.
BaO + 2HF → BaF2 + H2O;
BaO + 2HNO3 → 2Ba(NO3)2 + H2O;
3BaO + 2H3PO4 → Ba3(PO4)2 + 3H2O;
K2O + 2HF → 2KF + H2O;
K2O + 2HNO3 → 2KNO3 + H2O;
СaO + 2HF → СaF2 + H2O;
СaO + 2HNO3 → 2Сa(NO3)2 + H2O;
Li2O + 2HF → 2LiF + H2O;
Li2O + 2HNO3 → 2LiNO3 + H2O;
MgO + 2HF → MgF2 + H2O;
MgO + 2HNO3 → 2Mg(NO3)2 + H2O;
CuO + 2HF → CuF2 + H2O;
CuO + 2HNO3 → 2Cu(NO3)2 + H2O;
Na2O + 2HF → 2NaF + H2O;
Na2O + 2HNO3 → 2NaNO3 + H2O.
Аналогично проходят реакции основных оксидов и с другими кислотами.
4. взаимодействие с амфотерными оксидами.
В результате химической реакции основных оксидов с амфотерными оксидам образуется соль.
BaO + ZnO → BaZnO2 (t = 1100 oC);
BaO + SnO → BaSnO2 (t = 1000 oC);
К2О + ZnО → К2ZnО2;
CaО + Al2O3 → Ca(AlО2)2 (t = 1200-1300 °C);
MgО + Al2O3 → MgAl2О4 (t = 1600 °C);
MgО + Fe2O3 → MgFe2О4 (to);
CuО + Fe2O3 → CuFe2О4 (to);
5Na2О + Fe2O3 → 2Na5FeО4 (t = 450-500 °C);
Na2О + Al2O3 → 2NaAlО2 (t = 2000 °C);
Na2О + PbO → 2Na2PbО2 (tо).
5. восстановление до простых веществ:
BaO + Be → Ba + BeO (t = 270 oC);
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 oC);
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 oC);
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 oC);
3BaO + Si → 2Ba + BaSiO3 (t = 1200 oC);
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 oC);
Li2O + Mg → 2Li + MgO (t > 800 oC);
3Li2O + 2Al → 6Li + Al2O3 (t > 1000 oC);
2Li2O + Si → 4Li + SiO2 (t = 1000 oC);
2MgО + Si → 2Mg + SiО2;
MgО + 2K → Mg + K2О;
MgО + Са → Mg + СаО (t = 1300 oC);
3MgО + 2Al → 3Mg + Al2О3;
CuО + H2 → Cu + H2О (t = 300 oC);
CuО + С → Cu + СО (t = 1200 oC);
3CuО + 2Al → 3Cu + Al2О3 (t = 1000-1100 oC).
6. взаимодействие с галогеноводородами (бромоводородом, йодоводородом и пр.).
В результате химической реакции основных оксидов с галогеноводородами образуется соль и вода.
BaO + 2HBr → BaBr2 + H2O;
BaO + 2HI → BaI2 + H2O;
K2O + 2HBr → 2KBr + H2O;
K2O + 2HI → 2KI + H2O;
СaO + 2HBr → СaBr2 + H2O;
СaO + 2HI → СaI2 + H2O;
Li2O + 2HBr → 2LiBr + H2O.
Li2O + 2HI → 2LiI + H2O;
MgO + 2HBr → MgBr2 + H2O;
MgO + 2HI → MgI2 + H2O;
CuO + 2HBr → CuBr2 + H2O;
CuO + 2HI → CuI2 + H2O;
Na2O + 2HBr → 2NaBr + H2O;
Na2O + 2HI → 2NaI + H2O.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
@ https://youtu.be/Lnq-gD6c83A
карта сайта
Коэффициент востребованности
6 928
Источник
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?

Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
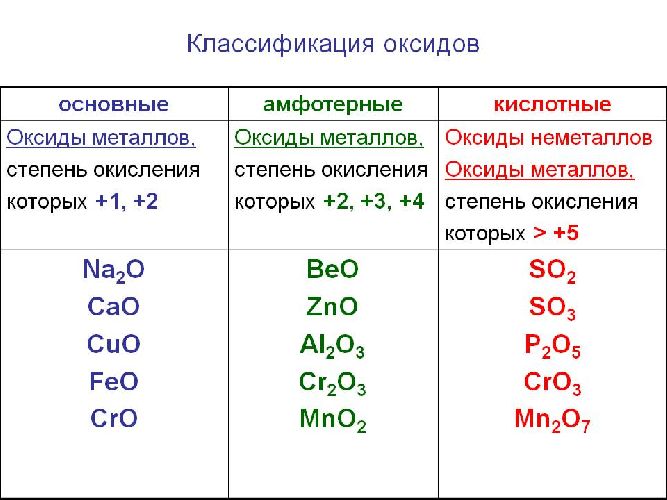
Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .

Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
CaO+ZnO=CaZnO2
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем. металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH3 =3Cu+3H2 O+N2
При нагревании разлагаются только оксиды ртути и благородных металлов:
2AU2O=4Au+O2
2HgO=2Hg+O2

Рис. 3. Оксид ртути.
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Инал Абдуллаев
10/10
Дворникова Кристина
8/10
Ахмад Махаров
7/10
Сергей Ефремов
8/10
Анастасия Вострикова
10/10
Данила Волков
10/10
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 1107.
Источник
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований : Взаимодействие некоторых металлов с водой:
Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Источник
Источник
